Resumo
O 3D-DXA, como implementado na ferramenta de software 3D-Shaper, é um método de software que gera uma reconstrução 3D do fêmur proximal a partir de uma única imagem 2D DXA através do registro de um modelo estatístico. As implementações do 3D-DXA visam fornecer estimativas de parâmetros trabeculares, corticais e estruturais semelhantes aos derivados da tomografia computadorizada quantitativa (QCT). Como inventor e desenvolvedor dos métodos de software nos quais o 3D-DXA foi construído, tenho observado a sua adoção e uso generalizado com crescente preocupação. Este artigo fornece uma avaliação crítica das limitações metodológicas inerentes ao 3D-DXA e discute as suas implicações para a pesquisa e o atendimento ao paciente. A questão principal é que a visibilidade limitada do córtex numa imagem DXA impede o 3D-DXA de derivar com precisão os parâmetros corticais. Em vez disso, o software baseia-se em previsões baseadas na DMO geral, ao invés de medições corticais diretas. Isto pode levar a resultados que não refletem as medições corticais reais. Preocupações adicionais incluem o viés populacional devido ao modelo estatístico ser derivado de um grupo demográfico específico, e a precisão de reconstrução limitada pelo uso de imagens DXA de visualização única. Essas limitações provavelmente resultaram em medições e resultados de pesquisa incorretos, que passaram em grande parte despercebidos devido ao uso de métricas de avaliação de desempenho inadequadas e à ausência de correções para comparações múltiplas em estudos envolvendo o 3D-DXA. Apesar destas limitações, o 3D-DXA recebeu aprovação regulatória em vários países, comprometendo potencialmente a precisão dos diagnósticos clínicos e decisões de tratamento. Ao destacar estas questões, este artigo visa informar clínicos, pesquisadores e órgãos reguladores sobre as limitações significativas do 3D-DXA. Ele ressalta a necessidade urgente de uma reavaliação do seu uso em ambientes de pesquisa e clínicos para evitar a má interpretação dos resultados e garantir a segurança do paciente.Palavras-chave
3D-DXA, 3D-Shaper, Tomografia Computadorizada Quantitativa, Densidade Mineral Óssea, Absorciometria de Raios-X de Dupla Energia, Mapeamento de Parâmetros Corticais, Análise da Estrutura do Quadril.Resumo para leigos
Esta revisão examina criticamente o software 3D-DXA, também conhecido como 3D-Shaper, que visa estimar parâmetros trabeculares, corticais e estruturais do fêmur proximal a partir de uma única imagem DXA. O 3D-DXA tem várias limitações inerentes que podem levar a medições imprecisas, afetando potencialmente os resultados da pesquisa e as decisões de tratamento do paciente. Compreender estas questões é crucial para pesquisadores e clínicos, a fim de evitar interpretações errôneas que poderiam impactar o nosso conhecimento sobre a fisiologia óssea, efeitos de tratamentos medicamentosos e a segurança do paciente.Introdução
O 3D-DXA é um método de software que registra um modelo estatístico deformável 3D em uma única imagem 2D DXA para gerar um modelo 3D do fêmur proximal [1]. O modelo é construído a partir de um conjunto de tomografias computadorizadas quantitativas (QCT) de uma população caucasiana espanhola de 81 mulheres e 30 homens com uma idade média de 56,2 ± 12,1 anos, variando entre 30 e 84 anos [2]. Os parâmetros do modelo estatístico descrevem subsequentemente a principal variação na forma e distribuição de densidade desta população. Num processo iterativo, os parâmetros do modelo, bem como a localização, orientação e tamanho, são procurados na tentativa de fazer com que a projeção do modelo se assemelhe à imagem DXA (Figura 1). A partir do modelo 3D resultante, os parâmetros corticais são então medidos através da superfície óssea, juntamente com os valores de DMO volumétrica trabecular no interior. Um erro absoluto médio de 0,33 mm para a espessura cortical e 72 mg/cm³ para a densidade cortical foi relatado ao comparar o 3D-DXA com a QCT, com coeficientes de correlação maiores ou iguais a 0,86 [2].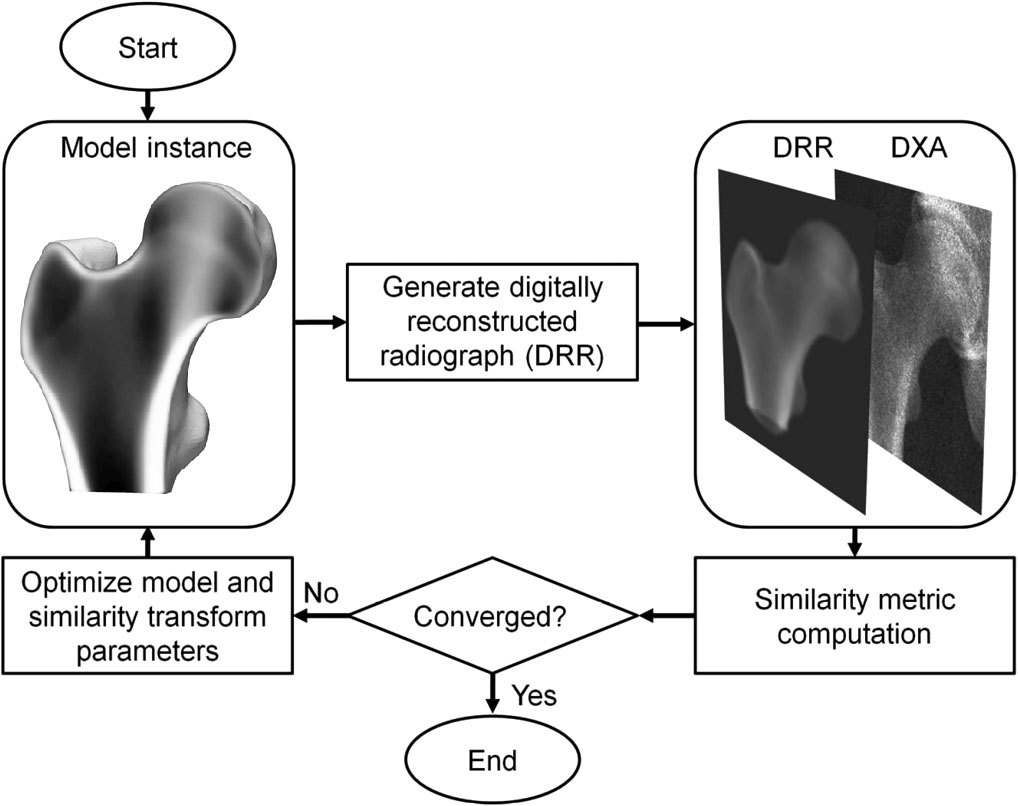
Embora outros métodos tenham sido propostos para a reconstrução 3D de estruturas ósseas a partir de imagens DXA usando um modelo estatístico [4, 5], é o método de software publicado pela primeira vez em 2010 [6] que foi posteriormente comercializado como 3D-DXA pela Galgo Medical SL (Barcelona, Espanha), uma empresa spin-off da Universidade Pompeu Fabra (Barcelona, Espanha). Este software foi posteriormente estendido para medir a espessura cortical e a densidade mineral óssea (DMO) cortical a partir das reconstruções volumétricas [2], que é agora comercializado como 3D-Shaper pela 3D-Shaper Medical SL (Barcelona, Espanha), uma nova empresa spin-off da Galgo Medical SL, fornecendo tanto um serviço quanto um software. O software é licenciado para a DMS Imaging (Mauguio, França) para ser vendido como 3D-DXA com os seus dispositivos Stratos/Medix DXA. A Fujifilm (Tóquio, Japão) está vendendo os mesmos dispositivos DXA da DMS sob a marca Fujifilm FDX Visionary DXA. Também a Imex Medical (São José, Brasil) vende estes dispositivos como a série Elipse e a Radiología SA (Madrid, Espanha) vende-os como Radioscore - DR. Todos estes incluem a opção de adicionar o 3D-DXA.
Tendo desenvolvido o método de software original [1], possuo uma compreensão profunda das suas limitações inerentes que podem não ser aparentes para outros usuários e pesquisadores. Embora eu tenha explicado a principal limitação com este software numa carta ao editor da Bone [7], o 3D-DXA continua a ser vendido e usado em todo o mundo. O 3D-Shaper recebeu aprovação de autoridades regulatórias na UE, Japão, Tailândia, Argentina e uma autorização 510(k) da FDA, autorizando o seu uso para diagnóstico e tomada de decisões de tratamento em pacientes. Dadas estas aprovações, é crítico e urgente abordar e esclarecer alguns dos equívocos sobre este software, melhorando assim a compreensão das suas limitações.
Limitações metodológicas
Nesta seção, explicarei algumas das limitações da metodologia na qual o 3D-DXA se baseia, bem como detalhes específicos de implementação que podem contribuir para imprecisões adicionais.Parâmetros corticais não são medidos
A principal questão reside na falta de visibilidade do córtex nas imagens DXA para que o 3D-DXA possa derivar seus parâmetros corticais. Para ilustrar isso, gostaria de revisitar uma figura da carta ao editor da Bone (Figura 2). A imagem DXA mostra claramente que, na maioria dos locais na superfície do osso, não há córtex discernível para derivar os parâmetros corticais. Isso se aplica ao contorno da projeção óssea (A) e é especialmente verdadeiro onde dois córtices opostos são perpendiculares ao detector de raios-X (B). Isso é evidente nesta imagem do scanner GE iDXA com um tamanho de pixel de 0,3 x 0,25 mm, mas torna-se ainda mais pronunciado em imagens usando dispositivos DXA GE Prodigy mais antigos, que produzem imagens de resolução consideravelmente menor com um tamanho de pixel de 0,6 x 1,05 mm, mas também são suportados pelo software 3D-Shaper.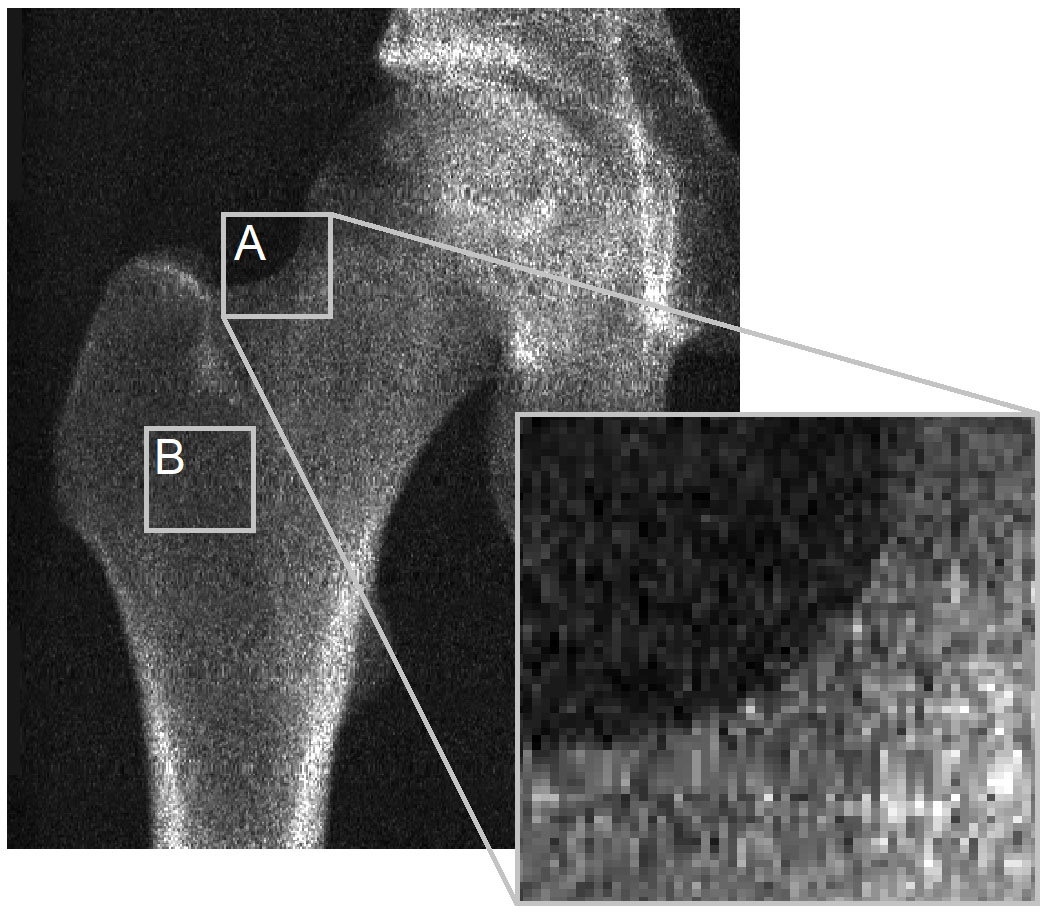
Em vez de medir os parâmetros corticais diretamente da imagem DXA, o 3D-DXA registra um modelo estatístico da forma e distribuição de densidade na imagem DXA [7], e extrai os parâmetros corticais deste modelo [2]. Este modelo é construído a partir de um conjunto de tomografias QCT calibradas, nas quais as unidades Hounsfield dos voxels em uma tomografia computadorizada padrão são convertidas em valores de DMO usando um fantoma de calibração.
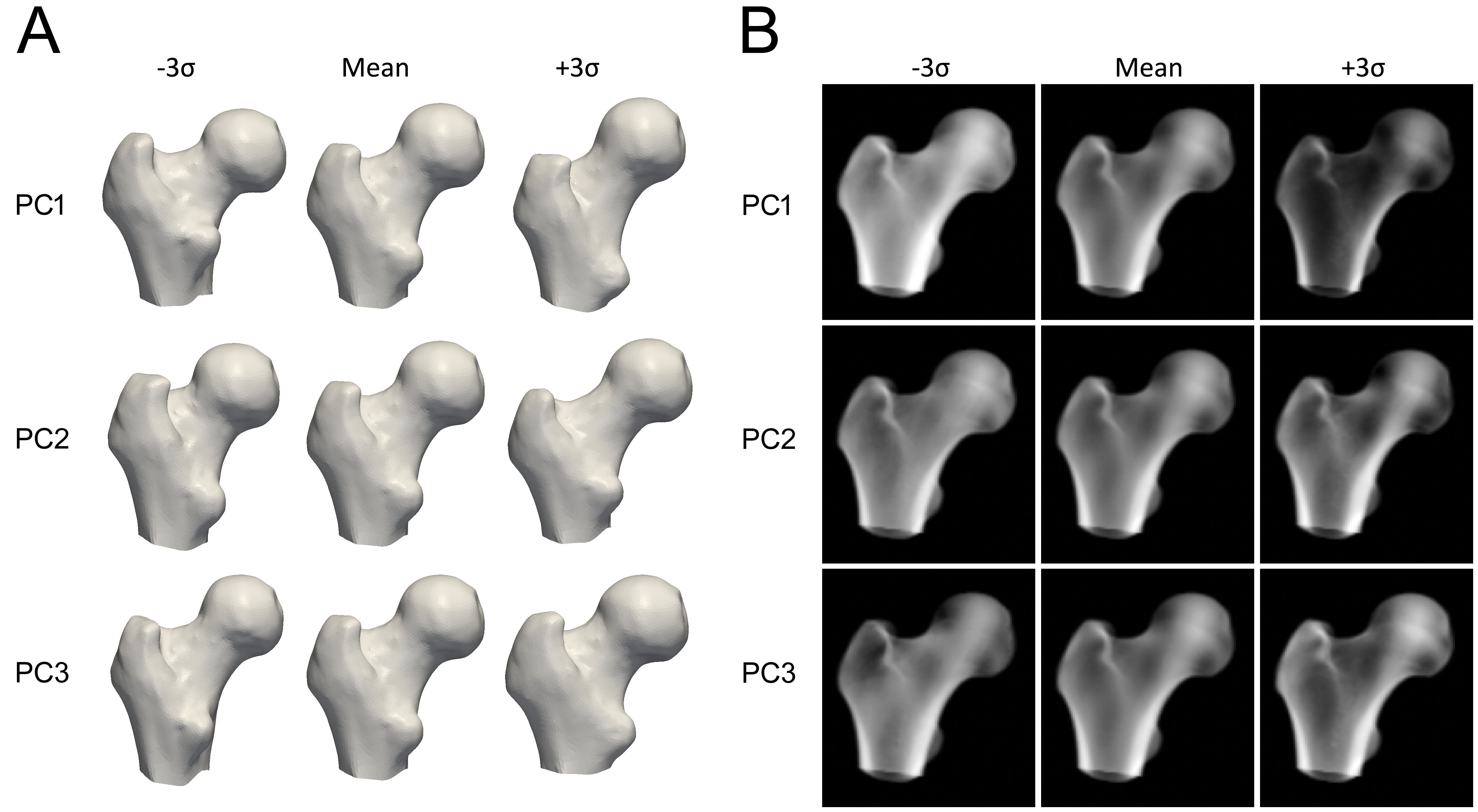
Para construir o modelo, o fêmur proximal em cada tomografia QCT é primeiro segmentado, o que significa que uma malha de superfície do fêmur proximal é construída. Uma técnica matemática, como a Análise de Componentes Principais (PCA), é então aplicada aos pontos das superfícies ósseas do fêmur alinhadas, resultando em uma forma média e um conjunto de Componentes Principais (PCs) que descrevem as variações na forma, ordenadas por sua importância.
Para construir o modelo estatístico da distribuição de densidade, os volumes QCT são deformados para a forma média, e o mesmo método estatístico é aplicado aos valores de DMO nos volumes, gerando um volume médio e um conjunto de PCs que descrevem a variação na densidade mineral óssea através do volume.
Cada componente principal representa a maneira pela qual a forma ou densidade do osso podem variar (Figura 3). Os parâmetros do modelo são fatores numéricos que determinam quanto de cada componente é adicionado ao modelo médio. Ajustar esses parâmetros modifica a forma ou distribuição de densidade, produzindo novas instâncias de modelo. Os parâmetros são restritos a tipicamente 2,5 a 3 desvios padrão de sua variação para garantir que o modelo ósseo sempre pareça realista de acordo com o conjunto de tomografias QCT a partir do qual é construído. Para criar uma nova instância do modelo, o volume de densidade é deformado para corresponder à nova forma, usando uma transformação Thin Plate Splines (TPS) calculada com um subconjunto dos pontos de forma.
O 3D-DXA gera subsequentemente uma reconstrução 3D mudando iterativamente os parâmetros do modelo e gerando instâncias de modelo correspondentes, bem como rotacionando e transladando o modelo, até que a projeção do modelo corresponda à imagem DXA de acordo com um limite de métrica de similaridade predeterminado (Figura 1).
A espessura cortical e a densidade cortical são então medidas a partir da instância do modelo usando um método equivalente a uma abordagem de deconvolução proposta para QCT [8]. Portanto, os parâmetros corticais não são medidos a partir da imagem DXA, mas de um modelo paramétrico que foi registrado nesta imagem.
Assim, quando mapas dos parâmetros corticais são apresentados pelo 3D-DXA, com valores em locais onde nenhum córtex poderia possivelmente ter sido medido [9, 10, 11, 12, 13], esses mapas foram meramente derivados da instância do modelo. Embora a 3D-Shaper Medical esclareça em uma resposta a uma carta ao editor da Bone [14] que esses parâmetros são estimados em vez de medidos, uma descrição mais precisa seria que o 3D-DXA prevê esses valores usando um método estatístico complexo e potencialmente propenso a erros. Dada a visibilidade limitada do córtex em imagens DXA, o software depende principalmente da densidade óssea global e é limitado pelas características estatísticas da população espanhola na qual o modelo é baseado. As implicações mais amplas dessa limitação são exploradas mais adiante na revisão.
Número de parâmetros de modelo utilizados
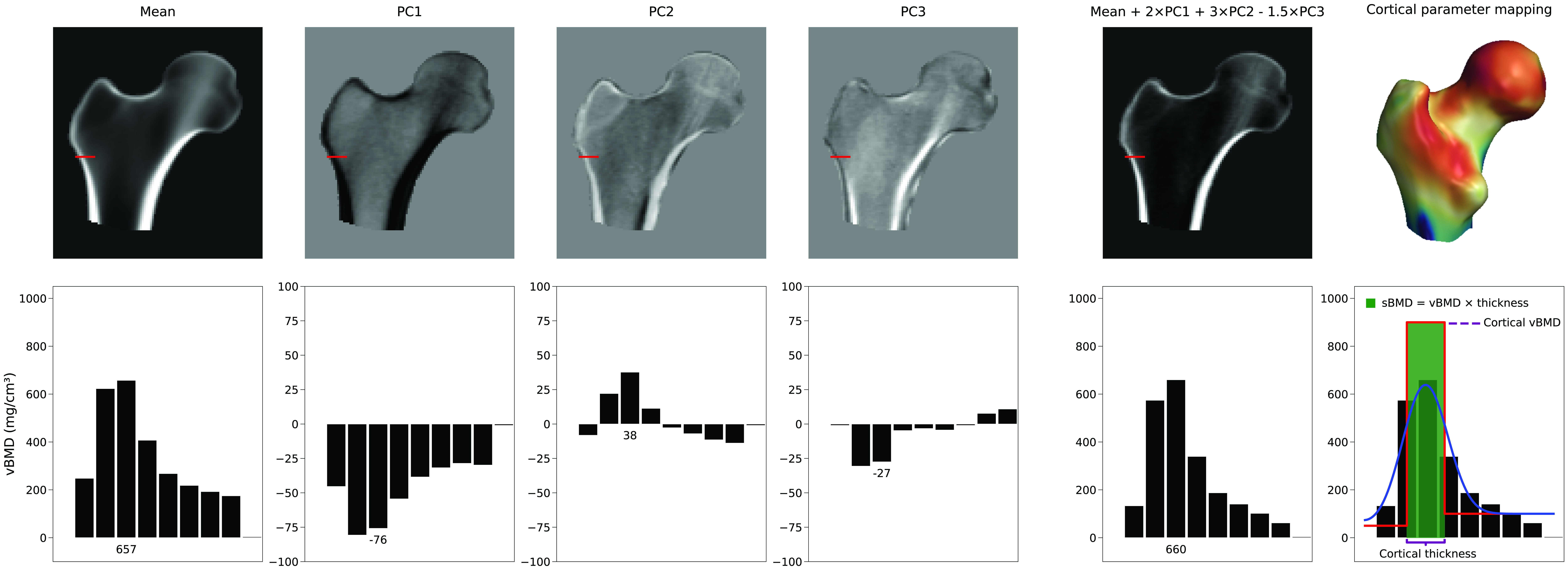
Não existe um único parâmetro que aumente a espessura cortical. Em vez disso, a representação do córtex depende de uma combinação linear do volume 3D médio e dos PCs do modelo de densidade. Na Figura 4 podemos ver um exemplo de como a média e os três primeiros PCs podem gerar uma nova instância de modelo. Neste exemplo, os parâmetros do modelo, que são os fatores de escala para os PCs, têm valores de 2, 3 e -1,5, respectivamente. Enquanto o PC1 aumenta ou diminui a densidade em todos os lugares, os outros PCs alteram a distribuição de densidade de maneiras não descritivas. Esta figura também ilustra como os parâmetros corticais são subsequentemente estimados a partir deste novo volume ajustando um modelo de degrau suavizado. Ajustes seletivos e independentes à espessura cortical, densidade cortical ou densidade trabecular, se atingíveis, exigiriam uma combinação complexa de múltiplos componentes principais e, consequentemente, muitos parâmetros de modelo.Tipicamente, um subconjunto de componentes principais é retido, descrevendo os principais modos de variação. Isso reduz a variação da distribuição de DMO e pontos de superfície para um conjunto reduzido de parâmetros. Quantos parâmetros de modelo são necessários é tipicamente determinado calculando o número de parâmetros de modelo de forma e densidade que descrevem 95% das variações dentro de sua população, ou determinando o "cotovelo" no gráfico de variância cumulativa. No entanto, mais preciso é usar a análise paralela de Horn [6] que avalia matematicamente quais PCs devem ser considerados ruído e, portanto, podem ser descartados.
Embora o número de parâmetros utilizados seja um elemento crítico em qualquer abordagem de modelagem estatística, para o meu conhecimento, este número, ou o método para derivar este número, nunca foi divulgado pela 3D-Shaper Medical. Se o número de parâmetros não for apropriadamente grande, conforme determinado pela análise paralela de Horn, pode não ser capaz de representar com precisão toda a gama de variação na morfologia do fêmur da população de entrada. Além disso, se esse número de parâmetros não for o mesmo em aplicações de pesquisa e clínicas, haverá uma desconexão na precisão relatada e clínica do 3D-DXA.
Viés populacional potencial
Qualquer modelo ósseo 3D gerado pelo 3D-DXA é derivado de estatísticas sobre as variações da população de entrada. No caso do 3D-Shaper, o modelo estatístico é construído a partir de uma população espanhola de 81 mulheres e 30 homens com uma idade média de 56,2 ± 12,1 anos [30 anos – 84 anos] [2] sem tratamentos ou doenças que afetam o metabolismo ósseo [15]. É claro que a morfologia do fêmur difere entre homens e mulheres, mas a demografia também desempenha um papel importante. Por exemplo, os ossos do fêmur de populações caucasianas são significativamente diferentes daqueles de populações asiáticas, conforme documentado em estudos anteriores [16].Um modelo construído a partir de uma população caucasiana não será capaz de gerar uma reconstrução que se ajuste a todos os sujeitos em uma população asiática. Isso ocorre porque os parâmetros de um modelo estatístico são restritos a 3 desvios padrão em torno do modelo médio do fêmur de uma população espanhola. Por exemplo, um estudo relata que mulheres brancas têm uma espessura cortical do colo femoral de 1,84 ± 0,03 mm, enquanto para mulheres coreanas é de 2,41 ± 0,71 mm, conforme medido por exames QCT [17]. Consequentemente, uma mulher coreana com uma espessura cortical média de 2,41 mm cairia fora da faixa de variação para uma população branca quando restrita a três desvios padrão (1,75–1,93 mm). Este exemplo ilustra a importância de ter o modelo representando a população-alvo.
Embora as medidas pelo 3D-DXA se correlacionem com o QCT em uma população japonesa [18], isso é simplesmente porque todos os parâmetros se correlacionam com a DMO areal. Isso não significa que reconstruções específicas do paciente foram obtidas. Em particular, os parâmetros corticais estimados podem se desviar substancialmente dos valores verdadeiros, especialmente em relação à sua distribuição espacial. Mesmo que a forma prevista do fêmur esteja incorreta, os valores de densidade, incluindo espessura cortical e DMO cortical, ainda espelharão a DMOa, desde que a projeção do modelo estatístico se sobreponha amplamente ao osso na imagem DXA. Uma pessoa com baixa DMOa terá uma baixa DMOv, uma baixa DMO cortical e córtex mais fino em comparação com um paciente com alta DMOa em qualquer população. Além disso, [18] relatou apenas correlações, e pode haver um viés significativo ao aplicar um modelo desenvolvido a partir de uma população espanhola a uma população japonesa, o que poderia ter consequências clínicas. Apesar desta limitação fundamental, o 3D-DXA está sendo comercializado atualmente na Ásia, incluindo países como Japão, Tailândia e Índia.
Um modelo estatístico precisa ser treinado na população à qual é aplicado. Isso poderia significar construir modelos separados para cada gênero, etnia e potencialmente tipo de tratamento, ou incluindo todos esses subgrupos em um único modelo, desde que parâmetros suficientes sejam retidos para capturar toda a gama de variabilidade. Este princípio é bem estabelecido para aprendizado de máquina e ferramentas de inteligência artificial [19, 20, 21, 22], mas é ainda mais crítico para abordagens de modelagem estatística, onde os modelos são ativamente restritos pela população de entrada. No entanto, o 3D-DXA tem sido usado em estudos com populações que obviamente diferem da população do modelo, incluindo: dançarinos profissionais [9], jogadores de futebol e nadadores [23], mulheres jovens com obesidade [24], mulheres negras [25], pacientes com alta massa óssea [11], com deficiência de hormônio do crescimento adulto [26], com doença psoriática [27], com diabetes tipo 2 [28], com hiperparatireoidismo primário [10, 29], com acromegalia [30], com síndrome de Down [13], após gastrectomia vertical [31], homens com lesão medular [32], homens australianos de meia-idade e idosos com baixa massa óssea [33], e talvez o mais preocupante de tudo, sobreviventes de câncer pediátrico [34].
Precisão de reconstrução limitada
O 3D-DXA é um método altamente complexo propenso a erros em múltiplos estágios. Estes incluem imprecisões da calibração QCT, registro deformável para construção de modelos estatísticos, deformação do modelo de densidade para a instância de forma, discrepâncias na DMO e resolução entre QCT e DXA, e simplificação da projeção do modelo por uma projeção isométrica em vez da projeção de feixe em leque. Cada um desses fatores pode introduzir vieses de maneiras imprevisíveis, potencialmente distorcendo os resultados. Além disso, detalhes específicos de implementação, como a construção do modelo estatístico a partir de um conjunto muito pequeno de 111 indivíduos espanhóis adultos (o que limita a variância na forma, densidade, e espessura cortical), restringem ainda mais a aplicabilidade desta ferramenta de software.Além disso, não está claro se o 3D-Shaper pode ler com precisão os arquivos de dados proprietários dos dispositivos GE e Hologic, particularmente com respeito à aplicação correta da calibração e fatores de correção para composições corporais variadas. Essas imprecisões potenciais podem influenciar os resultados do 3D-Shaper quando aplicados a diferentes populações ou à medida que as características da população mudam ao longo do tempo.
É lógico que, se a forma e a orientação do fêmur proximal não forem perfeitamente correspondidas com a imagem DXA, dentro de uma precisão submilimétrica, não deveria ser possível extrair a espessura cortical com uma precisão submilimétrica, nem a densidade cortical. Infelizmente, não é possível gerar uma reconstrução perfeita a partir de apenas uma única imagem 2D DXA, como um estudo inicial com 3D-DXA já mostrou [35]. Aqui foi mostrado que adicionar uma segunda visão reduz o erro de forma de 1,3 mm para 0,9 mm, e o erro de DMO de 4,4% para 3,2%, indicando uma reconstrução claramente subótima a partir de uma visão única. Em contraste, a tomografia computadorizada reconstrói um volume usando centenas de projeções adquiridas de todos os ângulos ao redor do fêmur. Desse modo, a QCT permite a medição independente de parâmetros corticais e trabeculares.
O 3D-DXA pode produzir modelos de fêmur com uma morfologia completamente diferente dependendo de onde a busca de parâmetros do modelo convergiu, em particular se a rotação correta não foi recuperada. Isso pode variar muito, como evidenciado por um estudo usando 3D-DXA envolvendo varreduras DXA repetidas no mesmo dia, que revelou diferenças na força prevista de até 62% [36]. Este estudo também relatou diferenças de DMO elemento por elemento atingindo 30 ± 50%, o que provavelmente refletirá em uma baixa precisão de repetibilidade para os parâmetros corticais também, embora esses números não tenham sido fornecidos. Em um estudo separado, a correlação entre valores de densidade 3D-Shaper e QCT também foi relatada como sendo baixa (r2 = 0,48) [37], indicando ainda mais uma precisão de reconstrução específica do sujeito limitada.
Em um estudo sobre medição dos parâmetros estruturais do fêmur usando 3D-DXA, um coeficiente de correlação de r = 0,86 foi relatado para o comprimento do eixo do colo femoral [38] ao correlacionar as medidas derivadas do volume 3D-DXA com as medidas de verdade terrestre da TC. Isso é pior do que quando medido diretamente na imagem DXA (r = 0,90, [39]). Além disso, os ângulos do eixo do colo femoral produzidos pelo 3D-DXA são de precisão limitada (r = 0,71, [38]). Uma razão óbvia para a falta dessa precisão é porque a cabeça femoral é excluída do processo de reconstrução usando uma máscara para evitar que a sobreposição da hemipelve interfira na reconstrução, embora isso pudesse ser resolvido adicionando um segundo modelo da hemipelve como em [5].
O estudo avaliando a capacidade do 3D-DXA de medir os parâmetros corticais relata uma diferença média (± desvio padrão) de espessura cortical entre 3D-DXA e QCT de 0,04 ± 0,21 mm no colo femoral e -0,07 ± 0,15 mm no trocanter [2]. Este estudo também apresentou uma figura mostrando os erros médios e máximos absolutos de estimativa de espessura cortical através da superfície do modelo do fêmur (Figura 5), com um erro médio maior que 0,2 mm e erro máximo maior que 1 mm em grande parte da superfície do fêmur. Em comparação, um estudo QCT medindo alterações na espessura cortical após um tratamento de 18 meses com alendronato relatou um aumento de 1,4%, correspondendo a um aumento aproximado de 0,018 mm na espessura cortical [40]. Dados compilados de três ensaios clínicos sobre teriparatida indicaram que a espessura cortical aumentou em 0,035 mm [41]. Considerando que o erro do 3D-DXA excede essas alterações típicas induzidas pelo tratamento, as medidas do 3D-DXA provavelmente não distinguirão de forma confiável entre efeitos reais impulsionados pela terapia e ruído metodológico. Em outras palavras, se o osso cortical de um indivíduo parece mudar, não está claro se isso decorre de mudança fisiológica genuína, ou do erro de medição inerente do 3D-DXA.
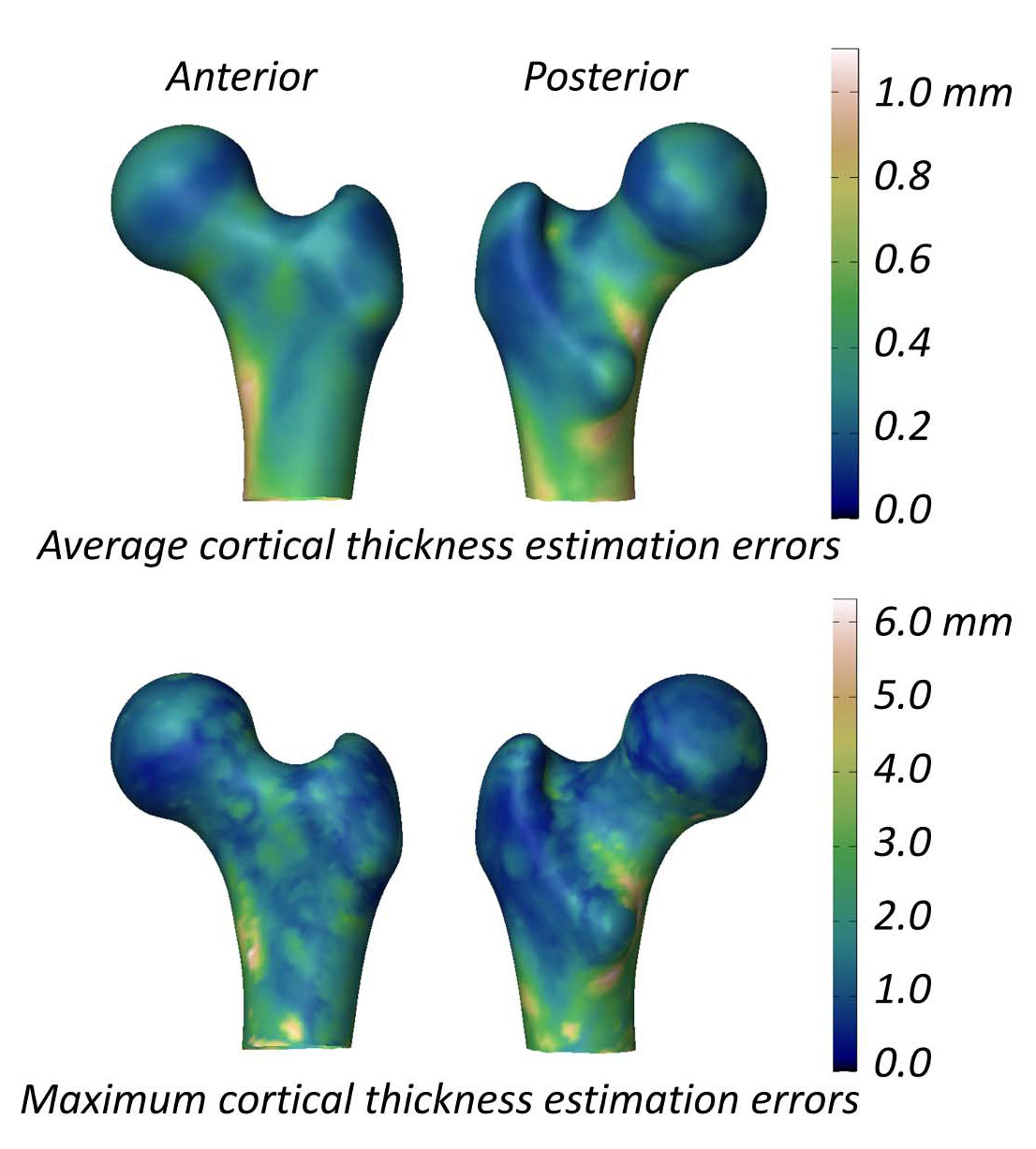
Benefício limitado sobre a DMO areal
No modelo estatístico de densidade que o 3D-DXA usa, o primeiro parâmetro do modelo é responsável pela vasta maioria da variação, e aumentar seu valor leva a um aumento tanto na densidade geral quanto em todos os parâmetros corticais [7]. Dado que há pouca informação sobre o córtex na imagem DXA, o 3D-DXA depende principalmente da densidade geral e, assim, do primeiro parâmetro do modelo. Como consequência, os parâmetros corticais e trabeculares são inerentemente correlacionados. Embora possa haver alguma contribuição dos córtices medial e lateral inferiores da diáfise que são visíveis na imagem DXA, os parâmetros retornados pelo 3D-DXA refletem predominantemente a DMO areal total (DMOa). Isso significa que, se a DMOa aumentar, a análise 3D-DXA mostrará aumentos simultâneos na DMO trabecular, DMO cortical e espessura cortical. De fato, um estudo recente apresentado no congresso de 2024 da European Calcified Tissue Society [42] e na reunião anual de 2024 da American Society for Bone and Mineral Research [43] confirma que os parâmetros do 3D-Shaper são altamente correlacionados com a DMOa e portanto não fornecem informações adicionais de previsão de fratura.Além disso, embora a reconstrução 3D-DXA capture a silhueta femoral geral visível na imagem DXA, sua capacidade de recuperar o comprimento do eixo do colo e o ângulo colo-diafisário é limitada. Como consequência, a forma reconstruída reflete principalmente o tamanho geral do osso, que já é fornecido pela DMOa e não acrescenta muito à previsão de força de fratura. Ilustrativo disso é o achado de que as previsões de força do 3D-DXA se correlacionaram com a QCT (r2 = 0,88), mas não foram estatisticamente melhores do que quando previstas apenas pela DMOa do colo femoral da imagem DXA (r2 = 0,87) [37]. Um estudo pela 3D-Shaper Medical mostra uma correlação semelhante (r2=0,86) mas uma comparação com a DMOa foi excluída [44]. Em um estudo diferente em uma população japonesa, medidas do 3D-Shaper não foram estatisticamente melhores na previsão de fratura de quadril do que a DMOa total do quadril [45].
Houve outros artigos publicados sobre um método semelhante de registrar um modelo estatístico 3D em uma imagem DXA 2D e prever a força femoral [46, 47], com um estudo mostrando uma melhoria em relação à DMOa na previsão de risco de fratura [48]. Este método pode oferecer algumas vantagens sobre o 3D-DXA, como o uso de um modelo pélvico adicional para ajudar a recuperar a forma completa do fêmur proximal. Embora permaneça sujeito a muitas das mesmas limitações metodológicas.
Se o 3D-DXA não consegue superar a DMOa sozinha, certamente não pode superar uma combinação de DMOa e parâmetros HSA, que são medidos diretamente a partir de imagens DXA. Isso destaca as limitações fundamentais do 3D-DXA e questiona sua justificativa para uso em ambientes clínicos ou de pesquisa. No entanto, a 3D-Shaper Medical agora oferece uma análise de elementos finitos baseada em 3D-DXA como um serviço.
Métodos de validação
Apesar das limitações inerentes do 3D-DXA, numerosas publicações relatam achados positivos sobre sua precisão. Esta discrepância pode ser atribuída ao uso de métodos de validação inadequados [21, 22] que tendem a obscurecer as verdadeiras limitações do software. Nas seções seguintes, discutirei as questões com essas validações e como elas criam uma percepção da confiabilidade e utilidade clínica do 3D-DXA.Métricas de avaliação de desempenho erradas
A 3D-Shaper Medical comparou a malha de superfície gerada pelo 3D-DXA a partir de uma imagem DXA com a malha de superfície gerada manualmente a partir da tomografia QCT dos mesmos sujeitos, resultando em uma distância média ponto-a-superfície de 0,93 mm [2]. Eles também compararam os parâmetros corticais, encontrando um erro médio absoluto de 0,33 mm para espessura cortical e 72 mg/cm³ para densidade cortical. No entanto, não há quadro de referência para determinar se esses erros relatados são aceitáveis, o que significa que essas métricas não validam necessariamente a eficácia do software.Outra maneira pela qual o 3D-DXA foi avaliado foi através do uso de correlações. Coeficientes de correlação de 0,86, 0,93, 0,95 e 0,91 foram relatados para DMOv trabecular, cortical e integral, e espessura cortical, respectivamente. No entanto, essas fortes correlações devem-se principalmente ao fato de que todos os parâmetros corticais, tanto nos modelos 3D-DXA quanto nas tomografias QCT, correlacionam-se fortemente com a densidade geral. Pacientes com DMOa acima da média em suas tomografias DXA exibirão, em média, também DMOv trabecular, cortical e integral aumentadas, juntamente com um córtex mais espesso. Esses resultados de correlação não fornecem evidências conclusivas da precisão do software na geração de reconstruções específicas do paciente e, de fato, podem criar uma impressão enganosa de seu desempenho.
Correlações também são usadas para avaliar estudos baseados na população usando 3D-DXA. Efeitos semelhantes podem ser vistos quando análises 3D-DXA mostram correlações significativas entre seus parâmetros e os fatores testados ou através de diferentes populações. Isso ocorre novamente porque esses parâmetros são inerentemente correlacionados com a DMO geral e, assim, refletem diretamente mudanças ou diferenças na DMOa. Os achados podem parecer sensatos e podem espelhar de perto as verdadeiras mudanças. Por exemplo, o exercício aumenta tanto a densidade geral quanto o conteúdo mineral ósseo cortical [49], levando a resultados aparentemente sensatos de uma análise 3D-DXA quando a DMOa aumenta devido ao exercício. No entanto, estes não refletem os parâmetros corticais reais em si, mas apenas as mudanças subjacentes ou diferenças na DMOa. Consequentemente, esses estudos podem criar uma impressão enganosa da eficácia do 3D-DXA, dando uma falsa sensação de sua capacidade de medir parâmetros corticais com precisão.
Uma avaliação mais apropriada envolveria comparar os parâmetros corticais com um modelo de linha de base, tal como um estimador cego. Aqui, um estimador cego refere-se a um método simples e ingênuo de estimativa que não leva em conta a variabilidade individual e, em vez disso, aplica um valor médio de toda a população a todos os sujeitos. Por exemplo, um estimador cego para espessura cortical usaria o mapa de espessura cortical média de um grupo de indivíduos e o aplicaria uniformemente a todos os casos, independentemente de suas características específicas. Essa abordagem serve como uma linha de base, ou padrão mínimo, contra a qual métodos mais avançados devem ser avaliados. Qualquer método sofisticado deve, no mínimo, superar essa estimativa básica. Até onde sei, tal avaliação ainda não foi publicada.
A maioria das publicações sobre o software 3D-DXA mostra apenas reconstruções bem-sucedidas, o que pode criar uma falsa sensação de confiança na confiabilidade do software. Para avaliar quantitativamente a confiabilidade do 3D-DXA, uma avaliação da taxa de falha pode ser realizada. Em um estudo anterior [51], embora não explicitamente declarado, apenas 80 de 173 sujeitos foram retidos após a exclusão de reconstruções identificadas como imprecisas através da comparação das projeções do modelo com as imagens DXA, resultando em uma taxa de falha superior a 50%. Para viabilizar tal avaliação, o 3D-Shaper precisaria fornecer uma exibição lado a lado da projeção do modelo e da imagem DXA. Uma avaliação mais robusta, no entanto, compararia renderizações e vistas transversais dos volumes resultantes com as tomografias QCT de verdade terrestre e avaliaria a taxa de falha em uma avaliação independente.
Em alguns casos, meramente observar mudanças significativas ou diferenças é apresentado como evidência de que o 3D-DXA funciona, desconsiderando se os efeitos reais estão corretos. Em resposta à minha carta ao editor, diferenças significativas entre grupos de tratamento foram apresentadas como evidência da eficácia do 3D-DXA. No entanto, nesta avaliação, os autores fornecem 2 resultados diferentes para alterações de DMO cortical após tratamento com TPTD, um mostrando um aumento significativo [52] e o outro uma diminuição não significativa [15]. Nenhum destes reflete a mudança real que se esperaria em tratamento com TPTD, como eu explico na Seção "Resultados enganosos em estudos de eficácia de medicamentos".
Ausência de correção de comparação múltipla
A preocupação nesta seção não está primariamente relacionada ao software 3D-DXA em si, mas sim ao serviço fornecido pela 3D-Shaper Medical e às publicações subsequentes. A questão crítica reside falta de correções de comparação múltipla ao relatar mudanças ou diferenças nos parâmetros 3D-DXA, particularmente nos mapas de parâmetros corticais.Aplicar correções de comparação múltipla é crucial ao analisar dados com múltiplas medições distintas. Para o 3D-Shaper, o software gera 71 parâmetros ósseos, com cada um representando um teste estatístico separado. Sem ajustar para essas múltiplas comparações, tal como com uma correção de Bonferroni, a probabilidade de obter resultados significativos por acaso aumenta, levando a conclusões falsas. Apesar disso, estudos usando 3D-Shaper frequentemente relatam mudanças ou diferenças significativas sem aplicar qualquer forma de correção de comparação múltipla [10, 24, 27, 28], criando uma sensação injustificada de confiança nos resultados. Isso pode ser enganoso quando certos parâmetros são medidos, mas não relatados, uma forma de viés de "p-hacking" [53], onde resultados significativos são destacados enquanto se ignora o risco aumentado de falsos positivos devido ao grande número de testes realizados.
Uma questão semelhante ocorre quando estudos usando o 3D-Shaper apresentam mapas codificados por cores mostrando mudanças ou diferenças nos parâmetros corticais na superfície do osso ou valores de DMO no volume. Nestes casos, cada vértice ou voxel representa um teste estatístico individual, com significância frequentemente determinada por um simples teste t em cada ponto [9, 10, 11, 12, 13, 28, 52, 54, 55]. Essa abordagem destaca regiões aparentemente significativas nos mapas codificados por cores, criando a ilusão de mudanças localizadas ou diferenças onde não há nenhuma. Ao apresentar mudanças ou diferenças no volume através de vistas transversais codificadas por cores, a significância estatística no nível do voxel geralmente não é fornecida de forma alguma [9, 11, 30, 52, 54, 55, 56]. Da mesma forma, isso sugere mudanças reais quando, na verdade, podem ser simplesmente resultado de variação aleatória. Consequentemente, esses mapas codificados por cores podem dar uma impressão excessivamente otimista do impacto de tratamentos ou intervenções, falsamente sugerindo eficácia onde pode não haver nenhuma.
A questão dos falsos positivos devido a correções de comparação múltipla inadequadas tem sido um desafio persistente no campo da neuroimagem [57]. Para resolver isso, a comunidade de neuroimagem desenvolveu soluções que também podem ser aplicadas a estudos examinando mudanças ósseas corticais na superfície óssea e mudanças de densidade nos voxels de exames QCT. Poole et al. [58] descrevem como o SurfStat (http://math.mccgill.ca/keith/surfstat/) pode ser usado para testar se diferenças nos parâmetros corticais em cada ponto na superfície óssea foram estatisticamente significativas, com a teoria de campo aleatório aplicada para correção de comparação múltipla. Pacotes semelhantes existem para análise baseada em voxel, como a biblioteca Statistical Parametric Mapping (https://www.fil.ion.ucl.ac.uk/spm/) e a FMRIB Software Library (https://fsl.fmrib.ox.ac.uk). O uso dessas ferramentas melhoraria o rigor estatístico dos estudos usando 3D-DXA, embora as mudanças ou diferenças observadas ainda refletiriam predominantemente a correlação de todos os parâmetros com a DMOa.
Implicações
O uso do 3D-DXA tem implicações de longo alcance tanto na pesquisa quanto na prática clínica. As seções seguintes aprofundarão esses desafios.Resultados enganosos em estudos de eficácia de medicamentos
Na maioria dos estudos, os resultados do 3D-DXA alinham-se com o que é esperado no córtex, já que parâmetros corticais em indivíduos saudáveis são tipicamente correlacionados com a DMOa. Isso frequentemente leva a resultados aparentemente sensatos. No entanto, esta abordagem torna-se falha quando as mudanças não seguem padrões convencionais. O método é particularmente problemático em ensaios de medicamentos onde a modelagem e remodelação óssea normal são alteradas, e os aumentos ou diminuições proporcionais usuais em todos os parâmetros podem não ocorrer.Um exemplo ilustrativo é um estudo sobre teriparatida, onde o 3D-DXA indicou um aumento em todos os parâmetros corticais, incluindo um aumento significativo na DMOv cortical comparado ao placebo [52]. Em contraste, usando uma técnica de medição cortical equivalente aplicada à QCT, a DMO cortical mostrou diminuir significativamente após o mesmo tratamento de 18 meses com teriparatida, o que foi visto consistentemente em dados de três ensaios clínicos diferentes [41]. Essa diminuição é atribuída a uma taxa aumentada de remodelação, que resulta em maior porosidade cortical, como também observado usando micro-CT [59].
Em um estudo anterior, a 3D-Shaper Medical relatou uma diminuição na DMO cortical em resposta à teriparatida [15]. Embora isso tenha sido notado pelos autores como uma diminuição, a mudança não foi estatisticamente significativa. Um estudo independente mais recente também não encontrou mudanças significativas na DMO cortical em resposta ao tratamento com teriparatida usando uma análise 3D-DXA [60]. Pode ser possível que haja alguma influência do córtex da diáfise, que é parcialmente visível na imagem DXA. Devido à natureza do 3D-DXA, uma diminuição da DMOa nesta região pode ter sido projetada através de todo o modelo do fêmur, incluindo áreas onde nenhum córtex é visível, uma vez que os parâmetros do modelo influenciam a distribuição de densidade globalmente. No entanto, isso não levou à diminuição correta e significativa na DMO cortical observada em estudos de QCT.
O estudo que relatou um aumento em todos os parâmetros corticais com teriparatida (TPTD) também avaliou abaloparatida em paralelo, mostrando um aumento ainda maior em todos os parâmetros para a última [52]. Estudos de acompanhamento usando análise 3D-DXA também relataram aumentos significativos na DMO cortical após tratamento com abaloparatida [55, 56]. Dado que a abaloparatida compartilha um mecanismo de ação semelhante com TPTD, aumentando a taxa de remodelação óssea, seria razoável esperar que também levasse a uma diminuição na DMO cortical. De fato, um estudo usando QCT observou uma diminuição na DMO cortical após um período semelhante de tratamento com abaloparatida em 35 pacientes [61], embora a redução não tenha sido estatisticamente significativa. Isso sugere que os estudos 3D-DXA não apenas produziram mudanças imprecisas, mas também provavelmente resultaram em uma avaliação excessivamente favorável dos efeitos da abaloparatida.
Um estudo de Lewiecki et al. [54] ilustra ainda mais as limitações do 3D-DXA em medir mudanças corticais discordantes. Sua análise 3D-DXA relatou aumentos em todos os parâmetros corticais em resposta ao romosozumabe. Em contraste, uma análise QCT anterior não encontrou aumento na DMO cortical após o mesmo tratamento [62]. Os autores observaram: “Não está claro por que os dados obtidos por QCT e 3D-SHAPER baseado em DXA para tratamento com romosozumabe sobre DMOv integral e trabecular do quadril foram semelhantes entre os estudos, mas diferiram para DMOv cortical.” Dado que a carta ao editor da Bone vista por alguns dos mesmos autores já havia explicado e previsto essa discrepância [7], parece que persiste um mal-entendido quanto às capacidades e limitações do 3D-DXA. Como resultado, esse mal-entendido provavelmente levou novamente a uma avaliação excessivamente otimista da eficácia do medicamento.
Esses estudos disseminam ainda mais resultados potencialmente incorretos apresentando mapas coloridos de mudanças ósseas corticais e trabeculares. O 3D-DXA não pode medir mudanças localizadas ou focais, em parte porque cada parâmetro do modelo afeta a distribuição de densidade globalmente, e também porque essas mudanças não são visíveis em uma imagem DXA. A falha em aplicar correções de comparação múltipla nesses estudos prejudica ainda mais os resultados, pois as regiões aparentemente significativas nos mapas são, de fato, muito menos significativas, levando a uma avaliação excessivamente otimista de vários medicamentos.
Manejo do paciente
Embora o software 3D-Shaper possa produzir 71 medidas, a versão clinicamente aprovada produz apenas a DMOv trabecular global e DMOs cortical, bem como um T-score e Z-score associados. Não está claro de qual população o T-score e Z-score são derivados, embora em um webinar da 3D-Shaper Medical dados de referência caucasianos sejam observados [63]. Gráficos de referência foram produzidos anteriormente para uma população espanhola [64] e argentina [65], que são ambos reproduzidos na Figura 6. Esses gráficos, no entanto, parecem distintos entre si e das figuras produzidas pelo software 3D-Shaper. A 3D-Shaper Medical, a DMS Imaging e os seus distribuidores não divulgam esta população, ou como estes dados foram derivados. No entanto, é confirmado pela Toyo Medic Co., Ltd. (Tóquio, Japão), distribuidora do 3D-Shaper no Japão, que o software 3D-Shaper aprovado para o mercado japonês não usa dados de referência de uma população japonesa. Considerando a grande diferença nos parâmetros corticais e trabeculares entre populações caucasianas e asiáticas [68], aplicar esses T-scores e Z-scores no Japão não parece prudente sem validação adicional. Sua validade também deve ser confirmada para cada população na qual eles são aplicados.
Em um webinar [66], a 3D-Shaper Medical sugeriu um uso clínico potencial onde o 3D-Shaper resultou em uma baixa DMOs cortical e DMOv trabecular muito baixa. Como a teriparatida, de acordo com a tabela, melhora o osso trabecular mais do que o osso cortical, a teriparatida foi dita ser o melhor tratamento. No entanto, com base nesta tabela, um clínico escolheria naturalmente Denosumabe ou Abaloparatida em vez de teriparatida se negligenciasse a DMOa vertebral.
O 3D-DXA provavelmente será usado apenas juntamente com avaliações regulares de T-score e Z-score de DXA. Assim, o perigo de perder um indivíduo de alto risco será mínimo. No entanto, devido ao erro associado ao 3D-DXA, a DMOs cortical e a DMOv trabecular serão sempre ligeiramente maiores ou menores. Em pacientes no limite do tratamento, isso pode influenciar o clínico a dar medicamentos anti-osteoporose onde isso não seria indicado apenas pela DMOa.
Um estudo sobre o Trabecular Bone Score (TBS) mostra que essa avaliação adicional influencia significativamente as decisões de tratamento na osteoporose secundária [67]. Nesse estudo, 21–25,5% dos pacientes com medidas de DMO irrelevantes tinham baixa qualidade óssea indicada pelo TBS, o que mudou a decisão de tratamento. Um efeito semelhante poderia ocorrer com o 3D-DXA, potencialmente levando a consequências não intencionais, como superprescrição. Se a tabela fosse usada, isso também poderia influenciar o clínico a escolher um medicamento em detrimento de outro.
Também é afirmado pela 3D-Shaper Medical que os pacientes podem ser monitorados para determinar se o tratamento selecionado de fato tem o efeito esperado no córtex e no compartimento trabecular. No entanto, considerando que os erros do 3D-DXA são maiores do que as mudanças esperadas, e que a repetibilidade é baixa [36], não pode ser averiguado se as mudanças vistas em uma avaliação de acompanhamento 3D-DXA são devido a efeitos reais ou apenas o erro inerente do 3D-DXA. Se um clínico confia nesses resultados, ele pode ser influenciado a mudar desnecessariamente o tratamento.
(A)
| DMOa 2D DXA (Quadril total) | 3D-DXA (3D-Shaper) DMOv Trabecular | 3D-DXA (3D-Shaper) DMOs Cortical | |
|---|---|---|---|
| Alendronato | + | + | + |
| Denosumabe | ++ | ++ | ++ |
| Ácido zoledrônico | + | + | ++ |
| Teriparatida [15, 52, 55*, 56] | + | ++ | = |
| Abaloparatida | ++ | ++ | ++ |
| Romosozumabe | +++ | +++ | +++ |
(B)
| DMOa | DMOv | DMOs | |
|---|---|---|---|
| Teriparatida [52, 56] (18 meses) | ++ (3.3%) | ++/+++ (9%) | + (1.8%) |
| Teriparatida [15] (24 meses) | = (p > 0.05) | ++/+++ (5.9%) | = (p > 0.05) |
| Teriparatida [60] (24 meses) | = (p > 0.05) | ++/+++ (>14%) | = (p > 0.05) |
(C)
| Símbolo | DMOa (Quadril total) | DMOv Trabecular | DMOs Cortical |
|---|---|---|---|
| +++ | Δ > n/a % | Δ > n/a % | Δ > n/a % |
| ++ | 2 < Δ ≤ n/a % | 4 < Δ ≤ n/a % | 2 < Δ ≤ n/a % |
| + | 0.5 < Δ ≤ 2 % | 0.5 < Δ ≤ 4 % | 0.5 < Δ ≤ 2 % |
| = | -0.5 ≤ Δ ≤ 0.5 % | -0.5 ≤ Δ ≤ 0.5 % | -0.5 ≤ Δ ≤ 0.5 % |
| - | -2 ≤ Δ < -0.5 % | -4 ≤ Δ < -0.5 % | -2 ≤ Δ < -0.5 % |
| -- | Δ < -2 % | Δ < -4 % | Δ < -2 % |
Embora a versão clínica do 3D-DXA não forneça informações sobre a DMOs cortical nas várias regiões anatômicas, ela exibe um modelo 3D codificado por cores da DMOs através da superfície óssea. A 3D-Shaper Medical subsequentemente sugere que isso pode ser usado para detectar fragilidade local [66]. Infelizmente, o 3D-DXA não pode reconstruir o mapa cortical específico do paciente. Vou referir novamente a Figura 2 para uma explicação intuitiva para isso. Assim, se um mapa cortical 3D-DXA sugere deficiências locais, estas podem ser saídas estatisticamente plausíveis do modelo, mas não correspondem à anatomia real do paciente. Isso novamente pode levar a uma decisão de tratamento desnecessária ou inapropriada.
O software 3D-Shaper recebeu agora também a aprovação da FDA através do processo de notificação pré-comercialização 510(k) [68]. A 3D-Shaper Medical obteve isso usando um estudo de correlação comparando a área transversal (CSA), momento de inércia transversal (CSMI), módulo de seção (Z), Razão de Flambagem (BR), densidade mineral óssea da superfície cortical (sBMD), densidade mineral óssea volumétrica trabecular (vBMD) e vBMD integral a medições semelhantes do software Hip Structural Analysis (HSA) da Hologic Inc., que havia recebido anteriormente a aprovação da FDA.
Notavelmente, o comprimento do eixo do colo e o ângulo colo-diafisário permaneceram ausentes desta avaliação e, portanto, o uso de esses parâmetros não é aprovado pela FDA. Deve-se notar que as diretrizes da Sociedade Internacional de Densitometria Clínica (ISCD) recomendam que os parâmetros de HSA não devem ser usados para avaliar o risco de fratura de quadril, com exceção do comprimento do eixo do quadril [69]. Além disso, esta aprovação regulatória não inclui um T-score ou Z-score para comparar as medições com dados de referência. Isso levanta preocupações sobre a aplicabilidade clínica do 3D-Shaper nos Estados Unidos.
Finalmente, os parâmetros do 3D-Shaper foram considerados substancialmente equivalentes à opção HSA para os densitômetros ósseos de raios-X Hologic QDR. A FDA não é capaz de confirmar se o 3D-Shaper pode ser usado com outros scanners DXA, deixando a questão da compatibilidade com outros dispositivos nos Estados Unidos não resolvida.
Discussão
Em resumo, o 3D-DXA produz uma variedade de parâmetros ósseos que parecem altamente detalhados, mas refletem principalmente a DMO regional geral em vez de medir propriedades corticais ou trabeculares distintas. Embora o software possa produzir resultados que se correlacionam com valores reais em populações onde mudanças corticais e trabeculares são proporcionais à DMOa, ele falha em capturar medições específicas do paciente ou mudanças localizadas. Essa limitação é especialmente pronunciada em cenários como terapia anabólica, onde parâmetros ósseos corticais e trabeculares podem mudar inversamente e o 3D-DXA falha em refletir essas mudanças verdadeiras observadas por QCT. Isso levanta preocupações significativas para seu uso no cuidado clínico de rotina ou como uma ferramenta de pesquisa confiável.O 3D-DXA foi inicialmente desenvolvido para diagnosticar melhor a osteoporose, fornecendo uma estimativa da DMOv integral [70, 71]. Ao não tentar avaliar separadamente os compartimentos cortical e trabecular, a DMOv integral produzida pelo 3D-DXA pode ainda representar uma estimativa válida. A metodologia foi posteriormente estendida para tentar melhorar as estimativas de risco de fratura analisando os parâmetros do modelo diretamente, uma vez que esses parâmetros descrevem totalmente a morfologia do modelo estatístico [51, 72, 73, 74]. No entanto, as principais limitações do 3D-DXA, conforme detalhado nesta revisão, permanecem e minam sua precisão e confiabilidade.
Este estudo foi limitado pela falta de transparência das empresas que comercializam o 3D-DXA, incluindo 3D-Shaper Medical, DMS Imaging e Fujifilm. Como resultado, baseia-se em informações publicamente disponíveis e na minha própria experiência no desenvolvimento desta metodologia. Encorajo os leitores a buscarem esclarecimentos destas empresas ou de seus representantes sobre aspectos do 3D-DXA e 3D-Shaper que não foram divulgados.
Avaliações de sociedades profissionais poderiam fornecer orientações valiosas, fornecendo avaliações independentes da validade do 3D-DXA e estabelecendo recomendações oficiais sobre seu uso. Embora uma atualização na diretriz de prática para absorciometria de raios-X de dupla energia pelo Grupo de Trabalho Internacional sobre Melhores Práticas de DXA declare em relação ao 3D-DXA que "mais evidências são necessárias para fazer recomendações para a aplicação dessas novas técnicas de imagem na prática clínica" [75], acredito que agora há evidências suficientes para basear uma recomendação, e espero que esta revisão seja útil a esse respeito.
Em conclusão, dadas as limitações fundamentais do 3D-DXA, é minha avaliação profissional que os parâmetros corticais e trabeculares fornecidos pelo 3D-DXA não devem ser usados para fins de pesquisa, nem são adequados para aplicações clínicas, como diagnóstico, monitoramento ou suporte à decisão de tratamento.
Contribuições do autor
TW contribuiu para a conceptualização, curadoria de dados, análise formal, investigação, metodologia, recursos, visualização e redação do manuscrito.Financiamento
Nenhum financiamento foi recebido para este estudo.Disponibilidade de dados
Todos os dados apresentados neste artigo estão disponíveis com o autor mediante solicitação.Conflitos de interesse
O autor é co-inventor de uma patente relacionada à metodologia subjacente ao software 3D-DXA. O autor esteve envolvido em discussões sobre a propriedade intelectual e as origens do código do software comercial 3D-DXA, modelos estatísticos e material promocional. O autor não é afiliado à 3D-Shaper Medical ou outras empresas envolvidas na exploração comercial do 3D-DXA e não recebeu capital, royalties ou outra compensação financeira. O autor ministrou palestras para a UCB em fóruns educacionais e recebeu apoio de subsídio de pesquisa da Amgen Inc. e Lilly. As opiniões expressas neste artigo são exclusivamente as do autor e baseiam-se numa avaliação crítica da metodologia e das evidências científicas disponíveis.Referências
- Whitmarsh T (2012). 3D Reconstruction of the Proximal Femur and Lumbar Vertebrae from Dual-Energy X-Ray Absorptiometry for Osteoporotic Risk Assessment
- Humbert L, Martelli Y, Fonolla R, et al. (2017). 3D-DXA: Assessing the Femoral Shape, the Trabecular Macrostructure and the Cortex in 3D from DXA images. IEEE Transactions on Medical Imaging, 36(1), 27–39.
- Whitmarsh T, Humbert L, De Craene M, et al. (2011). Reconstructing the 3D Shape and Bone Mineral Density Distribution of the Proximal Femur From Dual-Energy X-Ray Absorptiometry. IEEE Transactions on Medical Imaging, 30(12), 2101–2114.
- Ahmad O, Ramamurthi K, Wilson KE, et al. (2010). Volumetric DXA (VXA): A new method to extract 3D information from multiple in vivo DXA images. Journal of Bone and Mineral Research, 25(12), 2744–2751.
- Väänänen SP, Grassi L, Flivik G, et al. (). Generation of 3D shape, density, cortical thickness and finite element mesh of proximal femur from a DXA image. Medical Image Analysis, 24(1).
- Whitmarsh T, Humbert L, De Craene M, et al. 3D bone mineral density distribution and shape reconstruction of the proximal femur from a single simulated DXA image: an in vitro study. In: Dawant BM, Haynor DR, eds. Medical Imaging 2010: Image Processing. Vol. 7623. SPIE; 2010:76234U.
- Whitmarsh T. Concerns regarding the use of 3D-DXA. Bone. 2021;149:115939.
- Treece G, Gee A (2015). Independent measurement of femoral cortical thickness and cortical bone density using clinical CT. Medical Image Analysis, 20(1), 249–264.
- Freitas L, Amorim T, Humbert L, et al. (2018). Cortical and trabecular bone analysis of professional dancers using 3D-DXA: a case–control study. Journal of Sports Sciences, 37(1), 82–89.
- Gracia-Marco L, García-Fontana B, Ubago-Guisado E, et al. (2019). Analysis of Bone Impairment by 3D DXA Hip Measures in Patients With Primary Hyperparathyroidism: A Pilot Study. The Journal of Clinical Endocrinology \& Metabolism, 105(1), 175–184.
- Orduna G, Humbert L, Fonolla R, et al. (2018). Cortical and Trabecular Bone Analysis of Patients With High Bone Mass From the Barcelona Osteoporosis Cohort Using 3-Dimensional Dual-Energy X-ray Absorptiometry: A Case-Control Study. Journal of Clinical Densitometry, 21(4), 480–484.
- Gifre L, Humbert L, Muxi A, et al. (2017). Analysis of the evolution of cortical and trabecular bone compartments in the proximal femur after spinal cord injury by 3D-DXA. Osteoporosis International, 29(1), 201–209.
- García Hoyos M, Humbert L, Salmón Z, et al. (2019). Analysis of volumetric BMD in people with Down syndrome using DXA-based 3D modeling. Archives of Osteoporosis, 14(1).
- Beck B, Harding A, Weeks B, et al. (2021). Response to “Concerns regarding the use of 3D-DXA”. Bone, 149, 115936.
- Winzenrieth R, Humbert L, Di Gregorio S, Bonel E, García M, Del Rio L. Effects of osteoporosis drug treatments on cortical and trabecular bone in the femur using DXA-based 3D modeling. Osteoporos Int.2018;29(10):2323–2333.
- Cummings SR, Cauley JA, Palermo L, et al. Racial differences in hip axis lengths might explain racial differences in rates of hip fracture. Osteoporos Int.1994;4(4):226–229.
- Kim KM, Brown JK, Kim KJ, et al. Differences in femoral neck geometry associated with age and ethnicity. Osteoporos Int. 2010;22(7):2165–2174.
- Sone T, Humbert L, Lopez M, et al. (2022). Assessment of femoral shape, trabecular and cortical bone in Japanese subjects using DXA-based 3D modelling. JOURNAL OF BONE AND MINERAL RESEARCH, 37, 214--214.
- Varoquaux G, Cheplygina V (2022). Machine learning for medical imaging: methodological failures and recommendations for the future. npj Digital Medicine, 5(1).
- Hadjiiski L, Cha K, Chan H, et al. (). AAPM task group report 273: Recommendations on best practices for AI and machine learning for computer‐aided diagnosis in medical imaging. Medical Physics, 50(2).
- Huisman M (2024). When AUC-ROC and accuracy are not accurate: what everyone needs to know about evaluating artificial intelligence in radiology. European Radiology, 34(12), 7892–7894.
- Gallifant J, Bitterman DS, Celi LA, et al. (2024). Ethical debates amidst flawed healthcare artificial intelligence metrics. npj Digital Medicine, 7(1).
- Amani A, Bellver M, del Rio L, et al. (2022). Femur 3D-DXA Assessment in Female Football Players, Swimmers, and Sedentary Controls. International Journal of Sports Medicine, 44(06), 420–426.
- Maïmoun L, Renard E, Humbert L, et al. (2021). Modification of bone mineral density, bone geometry and volumetric BMD in young women with obesity. Bone, 150, 116005.
- Jain RK, López Picazo M, Humbert L, et al. (2025). Bone Structural Parameters as Measured by 3-Dimensional Dual-Energy X-Ray Absorptiometry Are Superior in Black Women and Demonstrate Unique Associations With Prior Fracture Versus White Women. Endocrine Practice, 31(2), 152–158.
- Gracia-Marco L, Gonzalez-Salvatierra S, Garcia-Martin A, et al. (2021). 3D DXA Hip Differences in Patients with Acromegaly or Adult Growth Hormone Deficiency. Journal of Clinical Medicine, 10(4), 657.
- Toussirot E, Winzenrieth R, Aubin F, et al. (2024). Areal bone mineral density, trabecular bone score and 3D-DXA analysis of proximal femur in psoriatic disease. Frontiers in Medicine, 11.
- Ubago-Guisado E, Moratalla-Aranda E, González-Salvatierra S, et al. (2023). Do patients with type 2 diabetes have impaired hip bone microstructure? A study using 3D modeling of hip dual-energy X-ray absorptiometry. Frontiers in Endocrinology, 13.
- Guerra FS, Palladino N, Winzenrieth R, et al. (2024). Advanced 3D-DXA insights into bone density changes in hyperparathyroidism. Journal of Diabetes \& Metabolic Disorders, 23(2), 2191–2199.
- Kužma M, Vaňuga P, Ságová I, et al. Non-invasive DXA derived bone structure assessment of acromegaly patients: a cross sectional study. Eur J Endocrinol. 2019;180(3):201–211.
- Maïmoun L, Aouinti S, Puech M, et al. Modification of bone architecture following sleeve gastrectomy: a five-year follow-up. J Bone Miner Res. 2024;40(2):251–261.
- Maïmoun L, Gelis A, Serrand C, et al. (2023). Alteration of Volumetric Bone Mineral Density Parameters in Men with Spinal Cord Injury. Calcified Tissue International, 113(3), 304–316.
- Harding AT, Weeks BK, Lambert C, et al. (2020). Effects of supervised high-intensity resistance and impact training or machine-based isometric training on regional bone geometry and strength in middle-aged and older men with low bone mass: The LIFTMOR-M semi-randomised controlled trial. Bone, 136, 115362.
- Gil-Cosano JJ, Ubago-Guisado E, Sánchez MJ, et al. (2020). The effect of an online exercise programme on bone health in paediatric cancer survivors (iBoneFIT): study protocol of a multi-centre randomized controlled trial. BMC Public Health, 20(1).
- Humbert L, Whitmarsh T, De Craene M, et al. (2010). 3D reconstruction of both shape and Bone Mineral Density distribution of the femur from DXA images. 2010 IEEE International Symposium on Biomedical Imaging: From Nano to Macro, 456–459.
- O’Rourke D, Beck BR, Harding AT, et al. (2021). Assessment of femoral neck strength and bone mineral density changes following exercise using 3D-DXA images. Journal of Biomechanics, 119, 110315.
- Dudle A, Gugler Y, Pretterklieber M, et al. (2023). 2D-3D reconstruction of the proximal femur from DXA scans: Evaluation of the 3D-Shaper software. Frontiers in Bioengineering and Biotechnology, 11.
- Clotet J, Martelli Y, Di Gregorio S, et al. (2018). Structural Parameters of the Proximal Femur by 3-Dimensional Dual-Energy X-ray Absorptiometry Software: Comparison With Quantitative Computed Tomography. Journal of Clinical Densitometry, 21(4), 550–562.
- Ramamurthi K, Ahmad O, Engelke K, et al. (2011). An in vivo comparison of hip structure analysis (HSA) with measurements obtained by QCT. Osteoporosis International, 23(2), 543–551.
- Whitmarsh T, Treece GM, Gee AH, et al. (2015). Mapping Bone Changes at the Proximal Femoral Cortex of Postmenopausal Women in Response to Alendronate and Teriparatide Alone, Combined or Sequentially. Journal of Bone and Mineral Research, 30(7), 1309–1318.
- Whitmarsh T, Treece GM, Gee AH, et al. (2016). The Effects on the Femoral Cortex of a 24 Month Treatment Compared to an 18 Month Treatment with Teriparatide: A Multi-Trial Retrospective Analysis. PLOS ONE, 11(2), e0147722.
- Huininga K, Koromani F, Zillikens M, et al. (2024). Use of 3D Shaper Analysis for the Assessment of Fracture Risk in a Population-Based Setting. JBMR Plus, 8(Supplement\_1), i1--i340.
- Huininga K, Koromani F, Zillikens MC, et al. (2024). Use of 3D Shaper Analysis for the Assessment of Fracture Risk in a Population-based Setting. ASBMR 2024 Annual Meeting Abstracts and Abstract Book.
- Qasim M, López Picazo M, Ruiz Wills C, et al. (2024). 3D-DXA Based Finite Element Modelling for Femur Strength Prediction: Evaluation Against QCT. Journal of Clinical Densitometry, 27(2), 101471.
- Iki M, Winzenrieth R, Tamaki J, et al. (2021). Predictive ability of novel volumetric and geometric indices derived from dual-energy X-ray absorptiometric images of the proximal femur for hip fracture compared with conventional areal bone mineral density: the Japanese Population-based Osteoporosis (JPOS) Cohort Study. Osteoporosis International, 32(11), 2289–2299.
- Grassi L, Väänänen SP, Ristinmaa M, et al. Prediction of femoral strength using 3D finite element models reconstructed from DXA images: validation against experiments. Biomechanics and Modeling in Mechanobiology, 16(3).
- Grassi L, Fleps I, Sahlstedt H, et al. (). Validation of 3D finite element models from simulated DXA images for biofidelic simulations of sideways fall impact to the hip. Bone, 142.
- Grassi L, Väänänen SP, Jehpsson L, et al. (). 3D Finite Element Models Reconstructed From 2D Dual‐Energy X‐Ray Absorptiometry (DXA) Images Improve Hip Fracture Prediction Compared to Areal BMD in Osteoporotic Fractures in Men (MrOS) Sweden Cohort. Journal of Bone and Mineral Research, 38(9).
- Grassi L, Väänänen SP, Voss A, et al. DXA-based 3D finite element models predict hip fractures better than areal BMD in elderly women. Bone. 2025;195:117457.
- Allison SJ, Poole KES, Treece GM, et al. (2015). The Influence of High-Impact Exercise on Cortical and Trabecular Bone Mineral Content and 3D Distribution Across the Proximal Femur in Older Men: A Randomized Controlled Unilateral Intervention. Journal of Bone and Mineral Research, 30(9), 1709–1716.
- Whitmarsh T, Fritscher KD, Humbert L, et al. (2011). Hip fracture discrimination using 3D reconstructions from Dual-energy X-ray Absorptiometry. 2011 IEEE International Symposium on Biomedical Imaging: From Nano to Macro, 1189–1192.
- Winzenrieth R, Ominsky M, Wang Y, et al. (2021). Differential effects of abaloparatide and teriparatide on hip cortical volumetric BMD by DXA-based 3D modeling. Osteoporosis International, 32(3), 575–583.
- England JR, Cheng PM (2019). Artificial Intelligence for Medical Image Analysis: A Guide for Authors and Reviewers. American Journal of Roentgenology, 212(3), 513–519.
- Lewiecki EM, Betah D, Humbert L, et al. (2024). 3D-modeling from hip DXA shows improved bone structure with romosozumab followed by denosumab or alendronate. Journal of Bone and Mineral Research, 39(4), 473–483.
- Winzenrieth R, Kostenuik P, Boxberger J, et al. (2022). Proximal Femur Responses to Sequential Therapy With Abaloparatide Followed by Alendronate in Postmenopausal Women With Osteoporosis by 3D Modeling of Hip Dual‐Energy X‐Ray Absorptiometry (DXA). JBMR Plus, 6(4).
- Winzenrieth R, Humbert L, Boxberger JI, et al. (2022). Abaloparatide Effects on Cortical Volumetric BMD and Estimated Strength Indices of Hip Subregions by 3D-DXA in Women With Postmenopausal Osteoporosis. Journal of Clinical Densitometry, 25(3), 392–400.
- Bennett C, Miller M, Wolford G (2009). Neural correlates of interspecies perspective taking in the post-mortem Atlantic Salmon: an argument for multiple comparisons correction. NeuroImage, 47, S125.
- Poole KE, Treece GM, Gee AH, et al. (2014). Denosumab Rapidly Increases Cortical Bone in Key Locations of the Femur: A 3D Bone Mapping Study in Women With Osteoporosis. Journal of Bone and Mineral Research, 30(1), 46–54.
- Sato M, Westmore M, Ma YL, et al. (2004). Teriparatide [PTH(1–34)] Strengthens the Proximal Femur of Ovariectomized Nonhuman Primates Despite Increasing Porosity. Journal of Bone and Mineral Research, 19(4), 623–629.
- Hadji P, Kamali L, Thomasius F, et al. (2024). Real-world efficacy of a teriparatide biosimilar (RGB-10) compared with reference teriparatide on bone mineral density, trabecular bone score, and bone parameters assessed using quantitative ultrasound, 3D-SHAPER® and high-resolution peripheral computer tomography in postmenopausal women with osteoporosis and very high fracture risk. Osteoporosis International, 35(12), 2107–2116.
- Sone T, Ohnaru K, Sugai T, et al. (2023). The effects of abaloparatide on hip geometry and biomechanical properties in Japanese osteoporotic patients assessed using DXA-based hip structural analysis: results of the Japanese phase 3 ACTIVE-J trial. Archives of Osteoporosis, 18(1).
- Genant HK, Engelke K, Bolognese MA, et al. (2016). Effects of Romosozumab Compared With Teriparatide on Bone Density and Mass at the Spine and Hip in Postmenopausal Women With Low Bone Mass. Journal of Bone and Mineral Research, 32(1), 181–187.
- MEDICAL 3S (2021). Webinar - Use of 3D-Shaper in clinical research: state of the art and potential applications
- Casado Burgos E, Di Gregorio S, González Macías J, et al. (2019). Datos de referencia de mediciones óseas en modelos 3D de fémur proximal en población española cn DXA: Proyecto SEIOMM 3D-SHAPPER. Congreso SEIOMM (24º : 2019 : Gerona).
- Brance ML, Saravi FD, Henr{\'i}quez MM, et al. (2020). Reference Values of Three-Dimensional Proximal Femur Parameters from Bone Densitometry Images in Healthy Subjects from Argentina. World Congress on Osteoporosis, Osteoarthritis and Musculoskeletal Diseases, 372--372.
- Jennings I (). 3D Shaper Technology: Revolutionizing Bone Health Analysis
- Al-Hashimi L, Klotsche J, Ohrndorf S, et al. (2023). Trabecular Bone Score Significantly Influences Treatment Decisions in Secondary Osteoporosis. Journal of Clinical Medicine, 12(12), 4147.
- Food {, Administration} D (2022). 510(k) Summary: K220822
- Broy SB, Cauley JA, Lewiecki ME, et al. (2015). Fracture Risk Prediction by Non-BMD DXA Measures: the 2015 ISCD Official Positions Part 1: Hip Geometry. Journal of Clinical Densitometry, 18(3), 287–308.
- Whitmarsh T, Humbert L, Craene MD, et al. (2009). Reconstrucción de la forma del fémur y densidad mineral ósea en 3D para el diagnóstico de osteoporosis a partir de DXA
- Whitmarsh T, Humbert L, Del Río Barquero LM, et al. (2011). Volumetric Bone Mineral Density Estimation using a 3D Reconstruction Method from Dual-energy X-ray Absorptiometry. ASBMR 2011 Annual Meeting Abstracts and Abstract Book.
- Whitmarsh T, Fritscher KD, Humbert L, et al. (2011). A Statistical Model of Shape and Bone Mineral Density Distribution of the Proximal Femur for Fracture Risk Assessment. Medical Image Computing and Computer-Assisted Intervention – MICCAI 2011, 393–400.
- Whitmarsh T, Fritscher KD, Humbert L, et al. (2012). Hip fracture discrimination from dual-energy X-ray absorptiometry by statistical model registration. Bone, 51(5), 896–901.
- Martelli Y, Whitmarsh T, Humbert L, et al. (2012). A software framework for 3D reconstruction and fracture risk assessment of the proximal femur from dual-energy x-ray absorptiometry. Proceedings of VPH 2012: Virtual Physiological Human - Integrative approaches to computational biomedicine.
- Slart RHJA, Punda M, Ali DS, et al. (2024). Updated practice guideline for dual-energy X-ray absorptiometry (DXA). European Journal of Nuclear Medicine and Molecular Imaging, 52(2), 539–563.