Samenvatting
3D-DXA, zoals geimplementeerd in de softwaretool 3D-Shaper, is een methode die een 3D-reconstructie van het proximale femur genereert uit een 2D-DXA-beeld door een statistisch model te registreren. Implementaties van 3D-DXA beogen schattingen te leveren van trabeculaire, corticale en structurele parameters vergelijkbaar met metingen op basis van kwantitatieve computertomografie (QCT). Als uitvinder en ontwikkelaar van de softwaremethoden waarop 3D-DXA is gebaseerd, volg ik de adoptie en brede toepassing met toenemende zorg. Dit artikel geeft een kritische evaluatie van de methodologische beperkingen die inherent zijn aan 3D-DXA en bespreekt de implicaties voor onderzoek en patientenzorg.
Het belangrijkste probleem is dat de beperkte zichtbaarheid van de cortex in een DXA-beeld verhindert dat 3D-DXA corticale parameters nauwkeurig kan afleiden. De software vertrouwt in plaats daarvan op voorspellingen gebaseerd op de totale bone mineral density (BMD) in plaats van op directe corticale metingen. Dit kan leiden tot resultaten die niet overeenkomen met werkelijke corticale metingen.
Aanvullende zorgen zijn onder meer populatiebias door het statistische model dat uit een specifieke demografie is afgeleid, en een beperkte reconstructienauwkeurigheid bij gebruik van enkelvoudige DXA-beelden.
Deze beperkingen hebben waarschijnlijk geleid tot onjuiste metingen en onderzoeksuitkomsten, die grotendeels onopgemerkt zijn gebleven door het gebruik van ongeschikte prestatiemaatstaven en het ontbreken van correcties voor multiple testing in studies met 3D-DXA.
Ondanks deze beperkingen heeft 3D-DXA in verschillende landen regulatoire goedkeuring gekregen, wat de nauwkeurigheid van klinische diagnoses en behandelbeslissingen mogelijk in gevaar brengt. Door deze kwesties te belichten wil dit artikel clinici, onderzoekers en toezichthouders informeren over de belangrijke beperkingen van 3D-DXA en de dringende noodzaak om het gebruik in onderzoek en kliniek te herevalueren om misinterpretatie te voorkomen en de patientveiligheid te waarborgen.
Trefwoorden
3D-DXA, 3D-Shaper, Quantitative Computed Tomography, bone mineral density, Dual-energy X-ray Absorptiometry, Corticale parameterkartering, Hip Structure Analysis.
Samenvatting voor leken
Deze review onderzoekt kritisch de 3D-DXA-software, ook bekend als 3D-Shaper, die beoogt trabeculaire, corticale en structurele parameters van het proximale femur te schatten uit een enkele DXA-opname. 3D-DXA kent verschillende inherente beperkingen die kunnen leiden tot onnauwkeurige metingen, wat onderzoeksuitkomsten en behandelbeslissingen kan beinvloeden. Inzicht in deze kwesties is cruciaal voor onderzoekers en clinici om misinterpretaties te vermijden die onze kennis van botfysiologie, geneesmiddeleffecten en patientveiligheid kunnen aantasten.
Inleiding
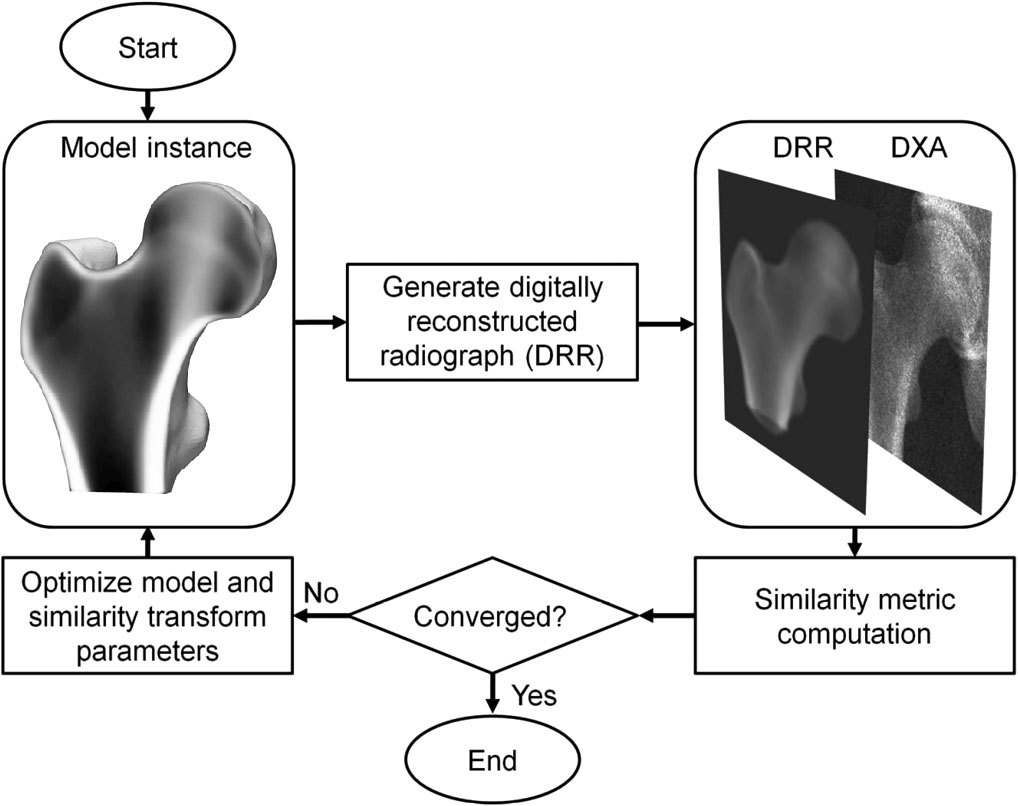
3D-DXA is een softwaremethode die een 3D statistisch deformeerbaar model registreert op een 2D-DXA-beeld om een 3D-model van het proximale femur te genereren [1]. Het model is geconstrueerd uit QCT-scans van een Spaanse Kaukasiatische populatie van 81 vrouwen en 30 mannen met een gemiddelde leeftijd van 56.2 ± 12.1 jaar, varierend tussen 30 en 84 jaar [2]. De parameters van het statistische model beschrijven de belangrijkste variatie in vorm en dichtheidsverdeling van deze populatie. In een iteratief proces worden de modelparameters, en ook locatie, orientatie en schaal geoptimaliseerd zodat de projectie van het model overeenkomt met het DXA-beeld (Figuur 1). Vanuit het resulterende 3D-model worden vervolgens corticale parameters over het botoppervlak gemeten, samen met trabeculaire volumetric bone mineral density (vBMD). Een mean absolute error van 0.33 mm voor corticale dikte en 72 mg/cm³ voor corticale dichtheid werd gerapporteerd bij vergelijking met QCT, met correlatiecoefficienten ≥ 0.86 [2].
Hoewel andere methoden zijn voorgesteld voor 3D-reconstructie van botstructuren uit DXA-beelden met behulp van een statistisch model [4, 5], is het de in 2010 gepubliceerde methode [6] die later werd gecommercialiseerd als 3D-DXA door Galgo Medical SL (Barcelona, Spanje), een spin-off van de Pompeu Fabra Universiteit. Deze software werd later uitgebreid om corticale dikte en corticale BMD te meten uit de volumetrische reconstructies [2], en wordt nu gecommercialiseerd als 3D-Shaper door 3D-Shaper Medical SL (Barcelona, Spanje), zowel als dienst als software. De software is in licentie gegeven aan DMS Imaging (Mauguio, Frankrijk) om als 3D-DXA te worden verkocht met hun Stratos/Medix DXA-apparaten. Fujifilm (Tokyo, Japan) verkoopt dezelfde door DMS gemaakte DXA-apparaten onder het merk FDX Visionary DXA. Ook Imex Medical (Sao Jose, Brazilie) verkoopt deze apparaten als de Elipse-serie en Radiologia SA (Madrid, Spanje) als Radioscore - DR. Al deze systemen bieden de optie 3D-DXA.
Als ontwikkelaar van de oorspronkelijke methode [1] heb ik een diep inzicht in de inherente beperkingen die voor andere gebruikers en onderzoekers mogelijk niet evident zijn. Hoewel ik de belangrijkste beperking eerder heb uitgelegd in een brief aan Bone [7], wordt 3D-DXA nog steeds wereldwijd verkocht en gebruikt. 3D-Shaper heeft goedkeuring gekregen van regelgevende instanties in de EU, Japan, Thailand en Argentinie, en een 510(k) clearance van de FDA, waarmee gebruik voor diagnose en behandelbeslissingen wordt toegestaan. Gezien deze endorsingen is het essentieel om misvattingen rond deze software te adresseren en de beperkingen te verduidelijken.
Methodologische beperkingen
In dit hoofdstuk licht ik beperkingen toe van de methode waarop 3D-DXA is gebaseerd, en implementatiedetails die tot extra onnauwkeurigheden kunnen leiden.
Corticale parameters worden niet gemeten
Het kernprobleem is het ontbreken van zichtbare cortex in DXA-beelden, waardoor 3D-DXA geen corticale parameters kan meten. Ter illustratie verwijs ik naar een figuur uit de brief aan Bone (Figuur 2). Het DXA-beeld laat zien dat op de meeste plaatsen op het botoppervlak geen cortex zichtbaar is waaruit parameters kunnen worden afgeleid. Dit geldt voor de projectiecontour (A) en vooral waar twee tegenoverliggende cortices loodrecht op de detector staan (B). Dit is zichtbaar op een GE iDXA-scanner met pixelgrootte 0.3 x 0.25 mm, en nog duidelijker bij oudere GE Prodigy-apparaten (0.6 x 1.05 mm), die eveneens door 3D-Shaper worden ondersteund.
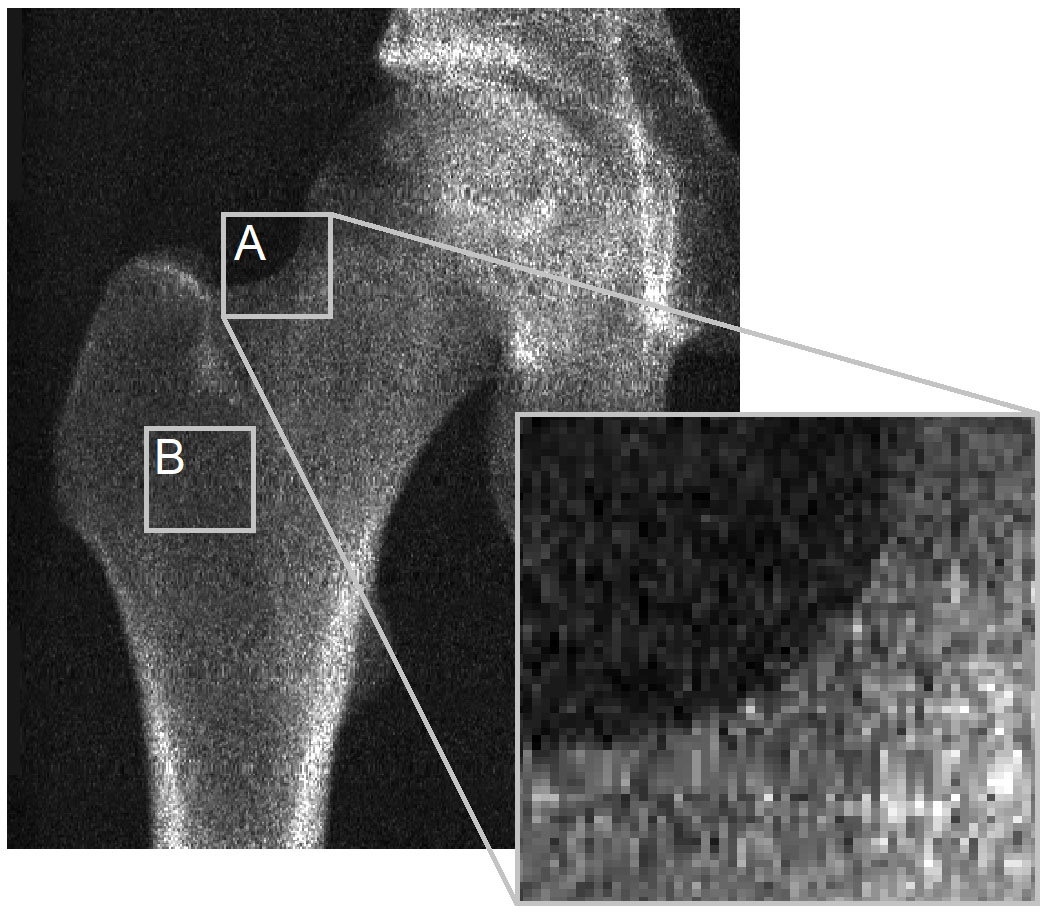
In plaats van corticale parameters rechtstreeks uit het DXA-beeld te meten, registreert 3D-DXA een statistisch model van vorm en dichtheidsverdeling op het DXA-beeld [7] en haalt de corticale parameters uit dat model [2]. Dit model is opgebouwd uit gekalibreerde QCT-scans, waarbij Hounsfield-eenheden zijn omgezet naar BMD met een kalibratiefantoom.
Voor de modelopbouw wordt het proximale femur per QCT-scan gesegmenteerd (oppervlakmesh). Vervolgens wordt Principal Component Analysis (PCA) toegepast op de uitgelijnde oppervlakspunten, wat resulteert in een gemiddelde vorm en PC's die de variatie beschrijven.
Voor de statistische dichtheidscomponent worden de QCT-volumes naar de gemiddelde vorm gedeformeerd en wordt dezelfde techniek toegepast op de BMD-waarden, wat een gemiddeld volume en PC's van de volumetrische dichtheidsvariatie oplevert.
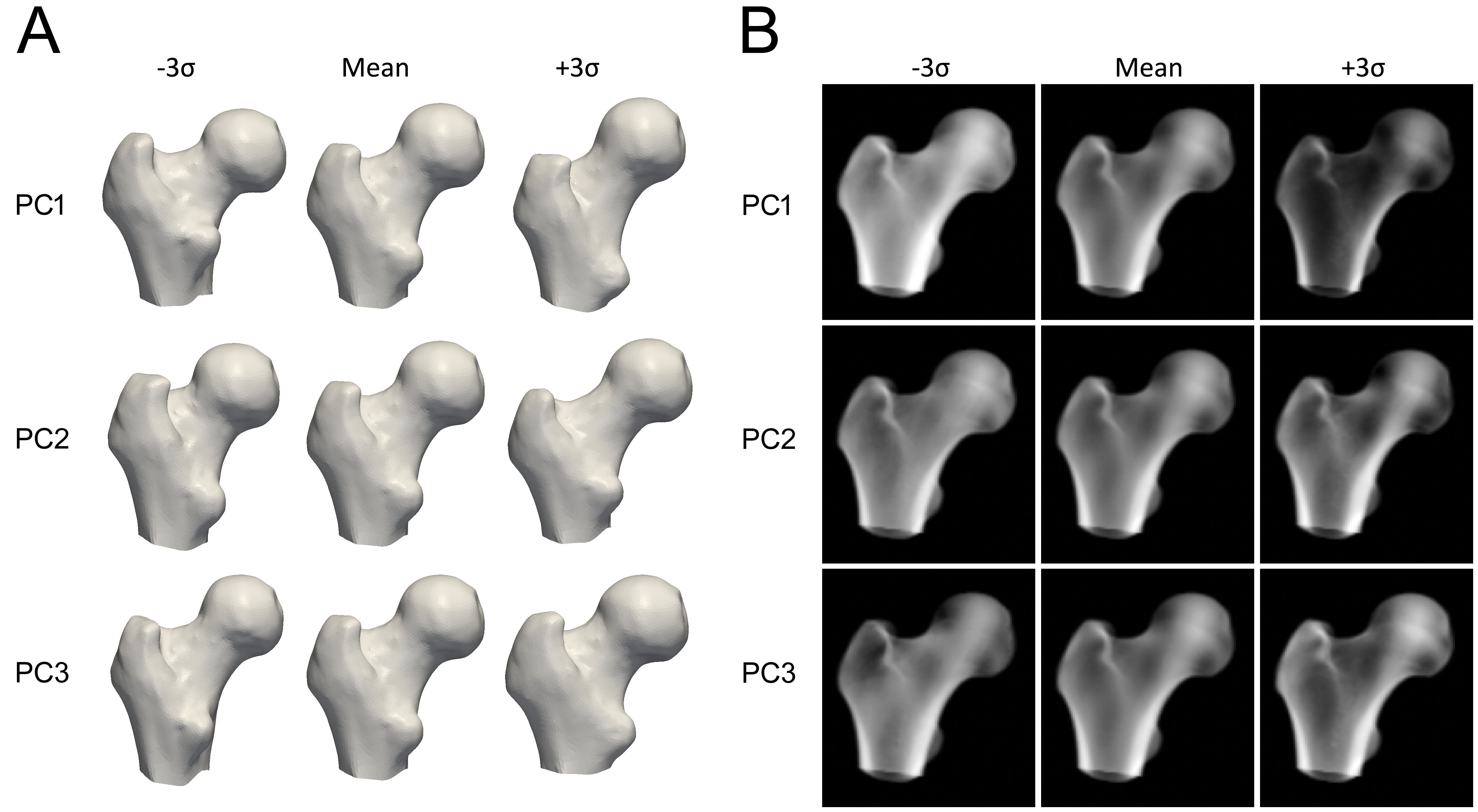
Elke PC beschrijft een manier waarop vorm of dichtheid kan variëren (Figuur 3). De modelparameters (gewichten) bepalen hoeveel van elke component wordt toegevoegd. De parameters worden meestal begrensd tot 2.5 tot 3 standaarddeviaties om realistische vormen te behouden. Voor een nieuwe instantie wordt het dichtheidsvolume naar de nieuwe vorm gedeformeerd met een Thin Plate Splines transformatie.
Daarna zoekt 3D-DXA iteratief naar modelparameters en pose tot de projectie van het model voldoende overeenkomt met het DXA-beeld (Figuur 1).
De corticale dikte en corticale dichtheid worden vervolgens gemeten op de modelinstantie met een methode die equivalent is aan een deconvolutie-benadering voor QCT [8]. De parameters worden dus niet uit het DXA-beeld gemeten, maar afgeleid uit een parametrisch model dat op het beeld is geregistreerd.
Wanneer 3D-DXA kaarten van corticale parameters toont met waarden op locaties waar geen cortex zichtbaar is [9 tot 13], zijn deze kaarten afgeleid van het model. Hoewel 3D-Shaper Medical in een reactie erkent dat het om schattingen gaat [14], is een accuratere omschrijving dat 3D-DXA de waarden voorspelt met een statistische methode die complex en foutgevoelig kan zijn. Gezien de beperkte cortexcues in DXA vertrouwt de software vooral op de totale BMD en wordt zij begrensd door de statistiek van de Spaanse populatie waarop het model is gebaseerd.
Aantal gebruikte modelparameters
Er bestaat geen enkele parameter die uitsluitend de corticale dikte verhoogt. De cortexweergave hangt af van een lineaire combinatie van het gemiddelde volume en de PC's van het dichtheidsmodel. Figuur 4 illustreert hoe de gemiddelde component met de eerste drie PC's een nieuwe instantie kan opleveren. Selectieve, onafhankelijke aanpassingen van corticale dikte, corticale dichtheid of trabeculaire dichtheid vereisen een complexe combinatie van meerdere PC's en dus veel parameters.
Gewoonlijk wordt een subset van PC's behouden die de belangrijkste variatie beschrijven. Hoeveel parameters nodig zijn, wordt vaak bepaald via het percentage verklaarde variantie (bijv. 95%) of de "elleboog" in de cumulatieve variantiecurve. Nauwkeuriger is Horn's parallelle analyse [6] om PC's die ruis vertegenwoordigen te verwerpen.
Hoewel het aantal parameters cruciaal is, is dit aantal (of de methode om het te bepalen) voor 3D-Shaper, voor zover bekend, nooit openbaar gemaakt. Als het aantal niet voldoende is volgens parallelle analyse, kan het de variatie van de doelpopulatie onvoldoende representeren. Wanneer onderzoek en klinische toepassing bovendien verschillende aantallen gebruiken, ontstaat een discrepantie tussen gerapporteerde en klinische nauwkeurigheid.
Mogelijke populatiebias
Elke 3D-reconstructie van 3D-DXA is afgeleid van statistiek op de variatie in de invoerpopulatie. Voor 3D-Shaper is het model gebouwd uit een Spaanse populatie van 81 vrouwen en 30 mannen met een gemiddelde leeftijd van 56.2 ± 12.1 jaar [2, 15]. Femur-morfologie verschilt tussen mannen en vrouwen, maar ook demografie speelt een rol. Zo wijkt de morfologie bij Kaukasiers significant af van die bij Aziaten [16].
Een model uit een Kaukasiatische populatie kan niet alle individuen uit een Aziatische populatie nauwkeurig representeren, zeker niet wanneer parameters tot ±3 SD rond het Spaanse gemiddelde worden begrensd. Een studie rapporteert bijvoorbeeld dat witte vrouwen een corticale dikte in de femurhals van 1.84 ± 0.03 mm hebben, terwijl die voor Koreaanse vrouwen 2.41 ± 0.71 mm bedraagt [17]. Een gemiddelde van 2.41 mm valt dan buiten het variatiebereik van de witte populatie bij ±3 SD (1.75-1.93 mm). Dit onderstreept het belang van modelafstemming op de doelpopulatie.
Hoewel 3D-DXA-maten met QCT correleren in een Japanse populatie [18], komt dit vooral doordat alle parameters met aBMD correleren. Dit impliceert geen patientspecifieke reconstructies. Vooral corticale parameters kunnen sterk afwijken in absolute waarde en in ruimtelijke verdeling. Zelfs bij foutieve vorm zal de dichtheid (inclusief corticale dikte en BMD) nog steeds met aBMD mee variëren zolang de modelprojectie grofweg over het bot in het DXA-beeld valt. Toch wordt 3D-DXA in Azie vermarkt (Japan, Thailand, India).
Een statistisch model moet zijn getraind op de populatie waarop het wordt toegepast. Dat kan door aparte modellen per geslacht, etniciteit en eventueel behandeling, of door voldoende representatie van al deze subgroepen binnen een model met voldoende parameters. Dit principe is bekend in machine learning [19 tot 22], en is nog belangrijker voor statistische modellen die actief door de inputpopulatie worden begrensd. Niettemin is 3D-DXA gebruikt in uiteenlopende populaties, waaronder: professionele dansers [9], voetbalsters en zwemmers [23], jonge vrouwen met obesitas [24], zwarte vrouwen [25], patienten met hoge botmassa [11], volwassenen met groeihormoondeficientie [26], psoriatische ziekte [27], type 2 diabetes [28], primaire hyperparathyreoidie [10, 29], acromegalie [30], downsyndroom [13], na sleeve gastrectomie [31], mannen met dwarslaesie [32], Australische mannen met lage botmassa [33], en pediatrische kankeroverlevenden [34].
Beperkte reconstructienauwkeurigheid
3D-DXA is complex en gevoelig voor fouten in meerdere stappen: QCT-kalibratie, deformeerbare registratie voor modelopbouw, deformatie van dichtheid naar vorm, verschillen in BMD en resolutie tussen QCT en DXA, en benadering van de projectie (isometrisch i.p.v. fan beam). Elk van deze factoren kan bias introduceren. Daarbovenop beperken implementatiedetails, zoals een kleine trainingsset van 111 volwassen Spaanse subjecten, de variatie in vorm, dichtheid en corticale dikte en dus de toepasbaarheid.
Daarnaast is onduidelijk of 3D-Shaper de proprieta ire gegevensbestanden van GE en Hologic correct kan lezen en kalibraties en correcties voor uiteenlopende lichaamssamenstellingen juist toepast. Mogelijke onnauwkeurigheden kunnen resultaten beinvloeden in diverse populaties of bij populatiedrift.
Het is aannemelijk dat, wanneer vorm en orientatie van het proximale femur niet met sub-millimeterprecisie worden teruggevonden, ook corticale dikte en dichtheid niet met sub-millimeter- of procentnauwkeurigheid bepaald kunnen worden. Een vroege studie met 3D-DXA liet zien dat een tweede projectie de vormfout reduceert van 1.3 mm naar 0.9 mm en de BMD-fout van 4.4% naar 3.2% [35], wat de suboptimale reconstructie uit een aanzicht bevestigt. QCT reconstrueert een volume uit honderden projecties en maakt wel onafhankelijke meting van corticale en trabeculaire parameters mogelijk.
3D-DXA kan verschillende morfologieen opleveren afhankelijk van het optimum waar de parameterzoektocht convergeert, zeker bij foutieve rotatie. In een studie met herhaalde zelfde-dag DXA's liepen voorspelde sterktes uiteen tot 62% [36], met element-voor-element BMD-verschillen tot 30 ± 50%. Dat impliceert waarschijnlijk een lage herhaalbaarheid van corticale parameters. In een andere studie was de correlatie van 3D-Shaper en QCT-dichtheden laag (r2 = 0.48) [37].
Voor structurele parameters rapporteerde een studie een correlatie van r = 0.86 voor de femurhals-aslengte [38] tussen 3D-DXA en CT, slechter dan direct gemeten in DXA (r = 0.90 [39]). Ook de hals-schacht-hoek uit 3D-DXA is beperkt nauwkeurig (r = 0.71 [38]), mede doordat de femurkop uit de reconstructie wordt gemaskeerd om overlap met het hemibekken te vermijden. Een extra bekkenmodel zou dit kunnen verbeteren [5].
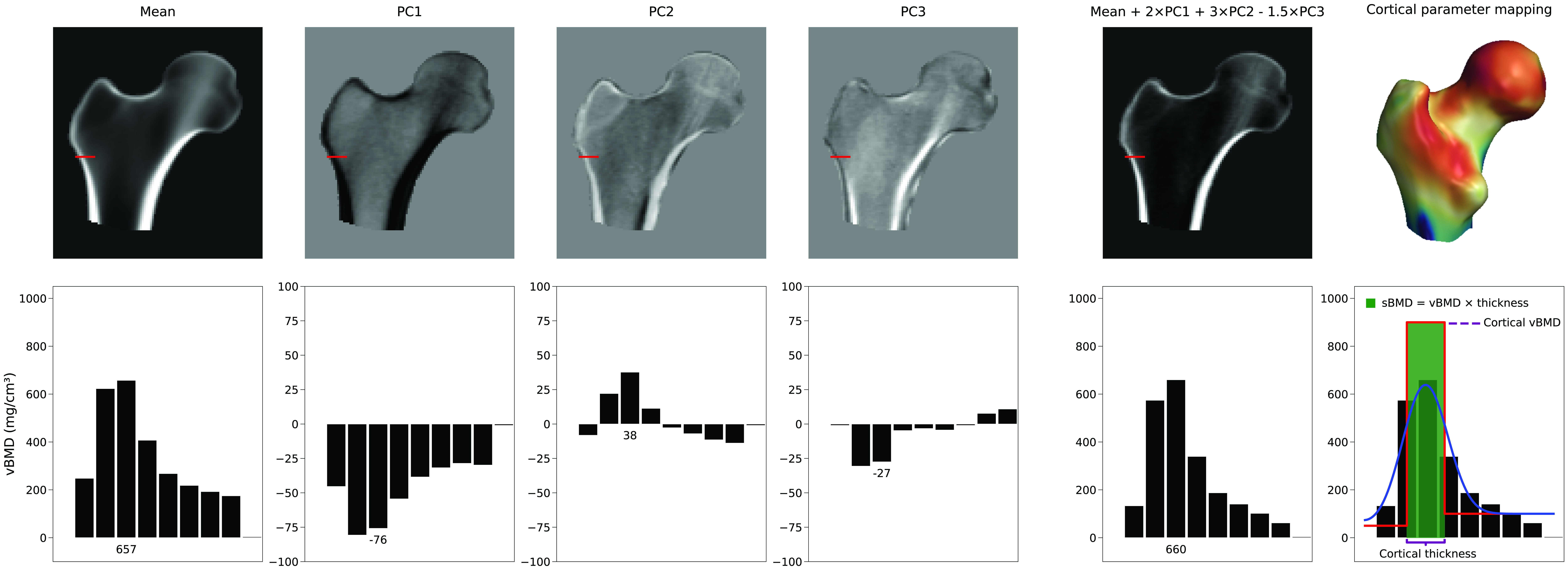
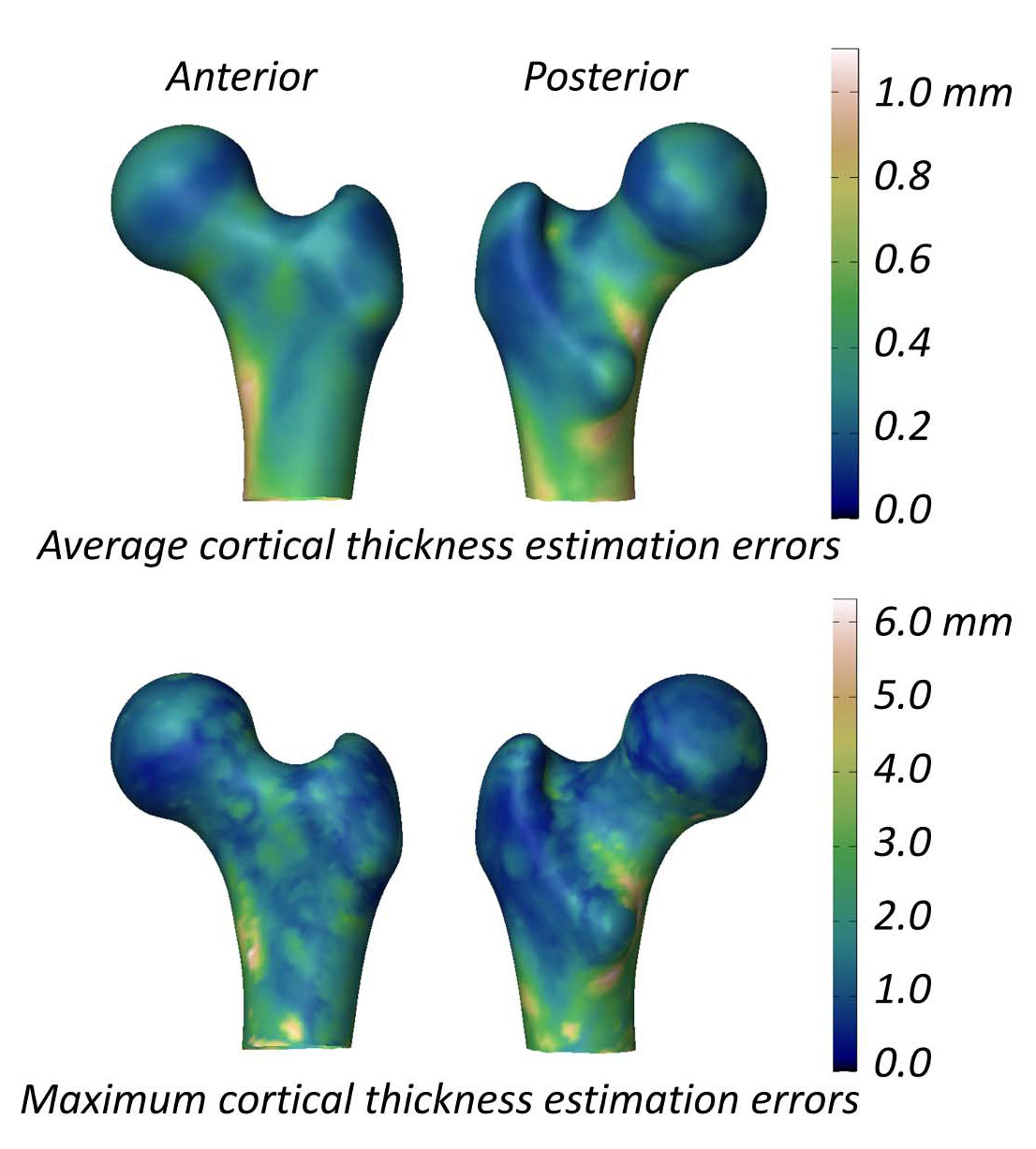
De studie naar corticale parameters rapporteerde gemiddelde (± SD) verschillen in corticale dikte tussen 3D-DXA en QCT van 0.04 ± 0.21 mm (hals) en -0.07 ± 0.15 mm (trochanter) [2]. Figuur 5 toont gemiddelde en maximale absolute fouten over het oppervlak, met een gemiddelde fout > 0.2 mm en maxima > 1 mm. Ter vergelijking: QCT na 18 maanden alendronaat liet een toename van 1.4% zien, ongeveer 0.018 mm [40]; teriparatide uit drie trials toonde ongeveer 0.035 mm [41]. Omdat de 3D-DXA-fout groter is dan typische therapie-effecten, kan de methode veranderingen waarschijnlijk niet betrouwbaar onderscheiden van ruis.
Beperkte meerwaarde t.o.v. areal BMD
In het statistische dichtheidsmodel verklaart de eerste component meestal het grootste deel van de variantie. Een hogere waarde verhoogt zowel de totale dichtheid als corticale parameters [7]. Door het gebrek aan cortexcues berust 3D-DXA grotendeels op deze component, waardoor corticale en trabeculaire parameters inherent met aBMD meebewegen. Als aBMD stijgt, laten 3D-DXA-analyses dus een gelijktijdige toename zien van trabecular vBMD, cortical BMD en corticale dikte. Recente studies (ECTS 2024 en ASBMR 2024) bevestigen dat 3D-Shaper-parameters sterk met aBMD correleren en geen extra fractuurpredictie bieden [42, 43].
Verder vangt de reconstructie de globale femursilhouet uit het DXA-beeld, maar de terugwinning van hals-aslengte en hals-schacht-hoek is beperkt. Daardoor weerspiegelt de vorm vooral de algemene botsize, die al in aBMD besloten ligt en weinig toevoegt aan sterktevoorspelling. Illustratief: voorspelde sterkte uit 3D-DXA correleerde met QCT (r2 = 0.88), maar was niet beter dan voorspelling uit alleen femurhals aBMD (r2 = 0.87) [37]. Een studie van 3D-Shaper Medical liet vergelijkbaar zien (r2) zonder vergelijking met aBMD [44]. In een Japanse cohortstudie presteerden 3D-Shaper-indices niet statistisch beter dan total hip aBMD [45].
Andere publicaties over een vergelijkbare 2D-naar-3D-registratiemethode rapporteerden soms verbetering t.o.v. aBMD [46 tot 48], mogelijk door o.a. een extra bekkenmodel, maar de belangrijkste methodologische beperkingen blijven.
Als 3D-DXA aBMD niet overtreft, is het onwaarschijnlijk dat het beter presteert dan aBMD gecombineerd met HSA-parameters, die rechtstreeks uit DXA worden gemeten. Niettemin biedt 3D-Shaper Medical inmiddels een finite element analyse dienst gebaseerd op 3D-DXA.
Validatiemethoden
Ondanks de beperkingen rapporteren veel publicaties positieve bevindingen over 3D-DXA. Dit is deels te wijten aan ongeschikte validatiemethoden [21, 22] die beperkingen maskeren. Hieronder de belangrijkste problemen.
Onjuiste prestatiemaatstaven
3D-Shaper Medical vergeleek een door 3D-DXA gegenereerde oppervlakmesh met een handmatig uit QCT gereconstrueerde mesh en vond een gemiddelde punt-tot-oppervlak afstand van 0.93 mm [2]. Ook voor corticale parameters werden fouten gerapporteerd (0.33 mm dikte; 72 mg/cm³ dichtheid). Zonder referentiekader is onduidelijk of deze fouten acceptabel zijn, dus valideren deze cijfers de methode niet per se.
Daarnaast worden correlaties gebruikt (bijv. 0.86 tot 0.95 voor vBMD en dikte). Die sterke correlaties vloeien vooral voort uit de onderlinge correlatie met totale BMD. Patiënten met hogere aBMD hebben gemiddeld hogere trabecular, cortical en integral vBMD en een dikkere cortex, in zowel QCT als 3D-DXA. Zulke correlaties bewijzen geen patientspecifieke nauwkeurigheid.
Ook in populatiestudies kunnen significante verbanden opduiken die de schijn wekken dat 3D-DXA zinvolle verschillen toont, terwijl feitelijk aBMD-verschillen worden gereflecteerd. Een betere evaluatie is vergelijking met een eenvoudige blinde schatter (bijv. gemiddelde cortexkaart van de populatie). Elke geavanceerde methode moet zo'n baseline overtreffen. Voor zover bekend is dit niet gepubliceerd.
Publicaties tonen vaak alleen geslaagde reconstructies, wat een vals vertrouwen kan wekken. Een betrouwbaarheidstest is rapporteren van faalpercentages. In een eerdere studie [51] bleven bijvoorbeeld 80 van 173 subjects over na uitsluiting van slechte reconstructies op basis van projectie-visuele vergelijking, dus meer dan 50% uitval. Hiervoor zou 3D-Shaper de modelprojectie naast het DXA-beeld moeten tonen; idealiter worden ook renderings en doorsneden met QCT vergeleken.
Regelmatig worden significante veranderingen of verschillen als "bewijs" gepresenteerd zonder te toetsen of de effecten inhoudelijk kloppen. In reactie op mijn brief werden tegengestelde resultaten voor corticale BMD na TPTD getoond (een studie stijging, een andere geen verandering) [52, 15], terwijl QCT typische dalingen in corticale BMD rapporteert bij TPTD (zie hieronder).
Geen correctie voor multiple testing
Dit punt betreft vooral publicaties met de 3D-Shaper dienst. De software levert 71 parameters; elk vormt een afzonderlijke test. Zonder correctie, zoals Bonferroni, neemt de kans op toevallige "significantie" toe. Toch ontbreken correcties vaak [10, 24, 27, 28]. Ook kleurkaarten (oppervlak of volume) markeren vaak "significante" regio's via puntsgewijze t-toetsen zonder ruimtelijke multiple-correctie [9 tot 12, 13, 28, 52, 54, 55]. In voxelkaarten ontbreekt significantie vaak geheel [9, 11, 30, 52, 54, 55, 56]. Dit wekt een te rooskleurige indruk van effecten.
In de neuroimaging is dit probleem bekend [57]. Oplossingen zoals SurfStat (oppervlak; random field theory) en SPM/FSL (voxel) zijn gangbaar [58]. Hun toepassing op 3D-DXA-kaarten zou de statistische strengheid verbeteren, al blijven de gemeten veranderingen grotendeels aBMD-gedreven.
Implicaties
Misleidende resultaten in geneesmiddelstudies
In veel studies stemmen 3D-DXA-resultaten overeen met wat men bij de cortex verwacht, omdat corticale parameters in gezonde individuen doorgaans met aBMD correleren. Problematisch wordt het wanneer veranderingen niet proportioneel verlopen, zoals bij anabole therapie.
Een voorbeeld is teriparatide: 3D-DXA rapporteerde stijging van alle corticale parameters, inclusief een significante stijging in corticale vBMD t.o.v. placebo [52], terwijl QCT-studies consistent een daling van corticale BMD laten zien door verhoogde remodellering en porositeit [41, 59]. Andere 3D-DXA-studies vonden geen significante verandering [15, 60]. Mogelijke zichtbare bijdragen van de schachtcortex (deels zichtbaar op DXA) worden via het model globaal uitgesmeerd, maar leiden niet tot de QCT-conforme daling.
Voor abaloparatide toonden 3D-DXA-studies eveneens stijgingen [52, 55, 56], terwijl een QCT-studie in 35 patienten een niet-significante daling van corticale BMD rapporteerde [61]. Voor romosozumab vond een 3D-DXA-studie stijging in alle corticale parameters [54], terwijl QCT geen stijging in corticale BMD liet zien [62]. Dit verschil was te verwachten op basis van de eerder beschreven beperkingen [7].
Daarnaast verspreiden deze studies mogelijk onjuiste conclusies via kleurrijke "lokale" verschilkaarten. 3D-DXA kan geen patientspecifieke lokale patronen meten; elke modelparameter beinvloedt het hele dichtheidsveld, en DXA geeft lokale cortexcues nauwelijks weer. Zonder passende multiple-correcties leiden zulke kaarten tot overschatting van geneesmiddeleffecten.
Patientenzorg
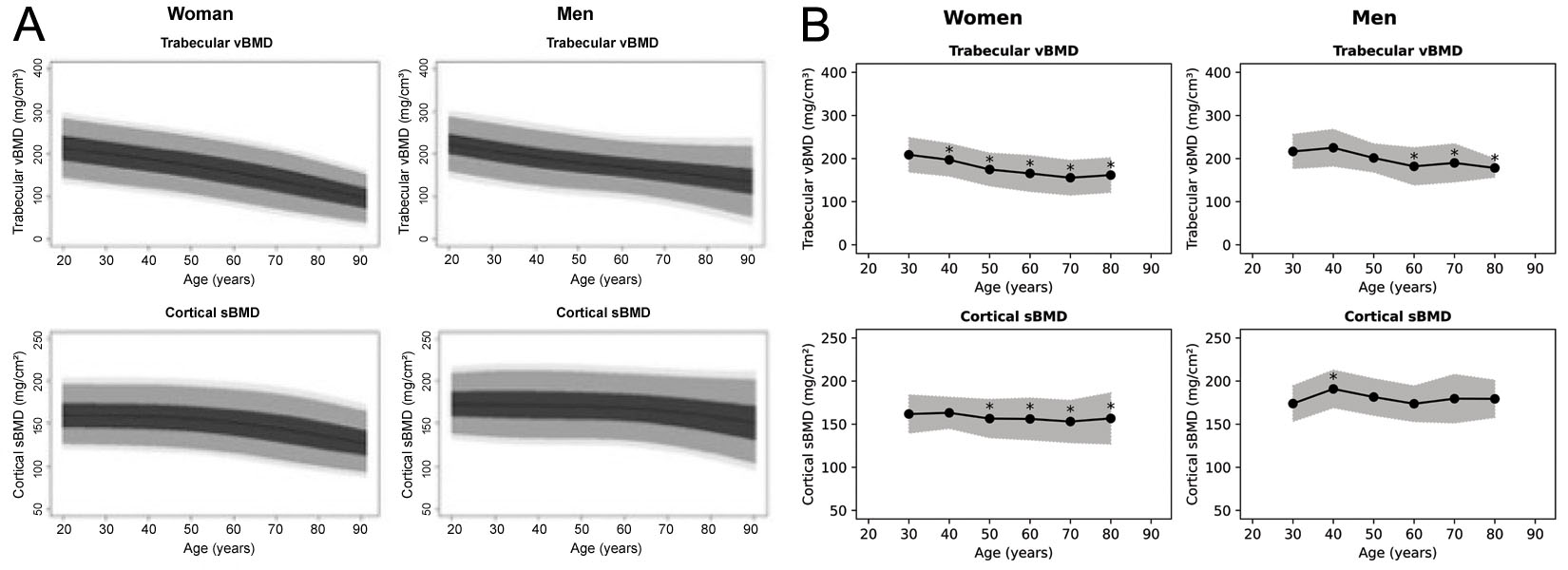
Hoewel 3D-Shaper 71 maten kan berekenen, levert de klinisch goedgekeurde versie vooral globale trabecular vBMD en cortical surface BMD (sBMD) plus T-score en Z-score. Het is onduidelijk uit welke populatie de referenties komen; in een webinar wordt Kaukasiatische referentie genoemd [63]. Spaanse en Argentijnse referentiedata zijn gepubliceerd (Figuur 6) [64, 65], maar deze lijken te verschillen van de softwareplots. De Japanse distributie bevestigt dat voor de Japanse markt geen Japanse referentiepopulatie wordt gebruikt. Gezien bekende verschillen tussen Kaukasiatische en Aziatische populaties [68] is voorzichtigheid geboden.
Promotiemateriaal suggereert een tabel om therapiekeuze te ondersteunen op basis van 3D-DXA-uitkomsten (Tabel A-C bij "tab-bone_density_changes"). De onderliggende drempels lijken arbitrair of ongespecificeerd; bovendien wijken samenvattingen per studie af van de in de tabel weergegeven symboliek, wat de geldigheid voor klinische besluitvorming in twijfel trekt.
In een webinar [66] werd gesuggereerd dat 3D-Shaper gebruikt kan worden om therapie te kiezen wanneer sBMD laag is en vBMD zeer laag; teriparatide zou dan de voorkeur hebben. Een clinicus zou op basis van dezelfde tabel echter ook voor denosumab of abaloparatide kunnen kiezen, afhankelijk van welke parameters worden benadrukt.
In de praktijk zal 3D-DXA naast conventionele DXA T- en Z-scores worden gebruikt. Het risico om hoogrisico patienten te missen is klein, maar dicht bij behandelgrenzen kan ruis in sBMD en vBMD onnodige medicatie uitlokken. Een studie met Trabecular Bone Score (TBS) laat zien dat zo'n extra metric beslissingen aanzienlijk kan beinvloeden [67]; iets soortgelijks kan optreden met 3D-DXA.
Voor follow-up is 3D-DXA problematisch: de meetfouten zijn groter dan verwachte therapie-effecten en de herhaalbaarheid is laag [36]. Waargenomen veranderingen kunnen dus evenzeer ruis zijn als fysiologie, wat tot onnodige therapie-aanpassingen kan leiden.
| 2D DXA (Total hip) aBMD | 3D-DXA (3D-Shaper) Trabecular vBMD | 3D-DXA (3D-Shaper) Cortical sBMD | |
|---|---|---|---|
| Alendronate | + | + | + |
| Denosumab | ++ | ++ | ++ |
| Zoledronic acid | + | + | ++ |
| Teriparatide [15, 52, 55*, 56] | + | ++ | = |
| Abaloparatide | ++ | ++ | ++ |
| Romosozumab | +++ | +++ | +++ |
| aBMD | vBMD | sBMD | |
|---|---|---|---|
| Teriparatide [52, 56] (18 months) | ++ (3.3%) | ++/+++ (9%) | + (1.8%) |
| Teriparatide [15] (24 months) | = (p > 0.05) | ++/+++ (5.9%) | = (p > 0.05) |
| Teriparatide [60] (24 months) | = (p > 0.05) | ++/+++ (>14%) | = (p > 0.05) |
| Symbol | (Total hip) aBMD | Trabecular vBMD | Cortical sBMD |
|---|---|---|---|
| +++ | Δ > n/a % | Δ > n/a % | Δ > n/a % |
| ++ | 2 < Δ ≤ n/a % | 4 < Δ ≤ n/a % | 2 < Δ ≤ n/a % |
| + | 0.5 < Δ ≤ 2 % | 0.5 < Δ ≤ 4 % | 0.5 < Δ ≤ 2 % |
| = | -0.5 ≤ Δ ≤ 0.5 % | -0.5 ≤ Δ ≤ 0.5 % | -0.5 ≤ Δ ≤ 0.5 % |
| - | -2 ≤ Δ < -0.5 % | -4 ≤ Δ < -0.5 % | -2 ≤ Δ < -0.5 % |
| -- | Δ < -2 % | Δ < -4 % | Δ < -2 % |
Hoewel de klinische versie geen regionale sBMD-waarden presenteert, toont zij wel een kleurgecodeerd 3D-model van sBMD over het oppervlak. 3D-Shaper Medical suggereert dit te gebruiken om lokale fragiliteit te detecteren [66]. Helaas kan 3D-DXA geen patientspecifieke cortexkaart reconstrueren (zie opnieuw Figuur 2). Als een 3D-DXA-kaart lokale "deficienties" suggereert, zijn dit statistisch plausibele outputs van het model, niet noodzakelijk de anatomie van de patient.
De software heeft in de VS FDA-clearance via 510(k) verkregen [68], gebaseerd op correlaties tussen 3D-Shaper-maten (CSA, CSMI, Z, BR, sBMD, trabecular vBMD en integral vBMD) en HSA-maten van Hologic-DXA's. De hals-aslengte en hals-schacht-hoek maakten geen deel uit van de beoordeling en zijn dus niet door de FDA goedgekeurd, terwijl ISCD-richtlijnen HSA-maten over het algemeen niet aanbevelen voor risicoschatting, met uitzondering van HAL [69]. Ook omvat de goedkeuring geen T- of Z-scores t.o.v. referenties. De FDA bevestigt bovendien niet de compatibiliteit met andere DXA-fabrikanten.
Discussie
Samengevat levert 3D-DXA diverse parameters die gedetailleerd lijken, maar vooral de totale areal BMD weerspiegelen in plaats van afzonderlijke corticale of trabeculaire eigenschappen te meten. In populaties waarin cortex en trabeculae proportioneel met aBMD veranderen, kunnen resultaten plausibel ogen; patientspecifieke metingen of lokale veranderingen worden echter niet betrouwbaar vastgelegd. Dit is vooral problematisch bij anabole therapie waar cortex en trabeculae tegengesteld kunnen reageren, wat door QCT wel wordt gezien maar door 3D-DXA niet.
3D-DXA werd aanvankelijk ontwikkeld om osteoporose beter te diagnosticeren via integral vBMD [70, 71]. Zonder poging tot strikte scheiding van cortex en trabeculae kan die integral vBMD nog steeds een bruikbare schatting zijn. Later is de methode uitgebreid met fractuurrisico-analyse op basis van modelparameters [51, 72 tot 74]. Toch blijven de hier beschreven kernbeperkingen de nauwkeurigheid en betrouwbaarheid aantasten.
Deze review is beperkt door een gebrek aan transparantie van de bedrijven die 3D-DXA commercialiseren (3D-Shaper Medical, DMS Imaging, Fujifilm). Daardoor ben ik aangewezen op publiek beschikbare informatie en eigen ervaring. Ik moedig lezers aan om verduidelijking bij deze bedrijven te vragen waar informatie ontbreekt.
Onafhankelijke evaluaties door beroepsverenigingen kunnen richting geven via objectieve beoordelingen en aanbevelingen. Hoewel een recente leidraad-update stelt dat "meer bewijs nodig is" voor 3D-DXA in de kliniek [75], meen ik dat er inmiddels voldoende aanknopingspunten zijn voor een concrete aanbeveling.
Concluderend: gezien de fundamentele beperkingen dienen de corticale en trabeculaire parameters van 3D-DXA niet voor onderzoek te worden gebruikt en zijn ze ongeschikt voor klinische toepassingen zoals diagnose, monitoring of therapeutische besluitvorming.
Belangenverstrengeling
De auteur is mede-uitvinder van een patent dat gerelateerd is aan de onderliggende methodologie. De auteur was betrokken bij discussies over intellectueel eigendom en herkomst van de commerciële 3D-DXA-softwarecode, statistische modellen en promotiemateriaal. De auteur is niet verbonden aan 3D-Shaper Medical of andere bedrijven die 3D-DXA commercieel exploiteren en ontvangt geen equity, royalties of andere financiele compensatie. De auteur gaf lezingen voor UCB en ontving onderzoeksondersteuning van Amgen Inc. en Lilly. De hier geuite opvattingen zijn uitsluitend die van de auteur en zijn gebaseerd op een kritische evaluatie van de methodologie en beschikbare wetenschappelijke evidentie.
Referenties
- Whitmarsh T (2012). 3D Reconstruction of the Proximal Femur and Lumbar Vertebrae from Dual-Energy X-Ray Absorptiometry for Osteoporotic Risk Assessment
- Humbert L, Martelli Y, Fonolla R, et al. (2017). 3D-DXA: Assessing the Femoral Shape, the Trabecular Macrostructure and the Cortex in 3D from DXA images. IEEE Transactions on Medical Imaging, 36(1), 27–39.
- Whitmarsh T, Humbert L, De Craene M, et al. (2011). Reconstructing the 3D Shape and Bone Mineral Density Distribution of the Proximal Femur From Dual-Energy X-Ray Absorptiometry. IEEE Transactions on Medical Imaging, 30(12), 2101–2114.
- Ahmad O, Ramamurthi K, Wilson KE, et al. (2010). Volumetric DXA (VXA): A new method to extract 3D information from multiple in vivo DXA images. Journal of Bone and Mineral Research, 25(12), 2744–2751.
- Väänänen SP, Grassi L, Flivik G, et al. (). Generation of 3D shape, density, cortical thickness and finite element mesh of proximal femur from a DXA image. Medical Image Analysis, 24(1).
- Whitmarsh T, Humbert L, De Craene M, et al. 3D bone mineral density distribution and shape reconstruction of the proximal femur from a single simulated DXA image: an in vitro study. In: Dawant BM, Haynor DR, eds. Medical Imaging 2010: Image Processing. Vol. 7623. SPIE; 2010:76234U.
- Whitmarsh T. Concerns regarding the use of 3D-DXA. Bone. 2021;149:115939.
- Treece G, Gee A (2015). Independent measurement of femoral cortical thickness and cortical bone density using clinical CT. Medical Image Analysis, 20(1), 249–264.
- Freitas L, Amorim T, Humbert L, et al. (2018). Cortical and trabecular bone analysis of professional dancers using 3D-DXA: a case–control study. Journal of Sports Sciences, 37(1), 82–89.
- Gracia-Marco L, García-Fontana B, Ubago-Guisado E, et al. (2019). Analysis of Bone Impairment by 3D DXA Hip Measures in Patients With Primary Hyperparathyroidism: A Pilot Study. The Journal of Clinical Endocrinology \& Metabolism, 105(1), 175–184.
- Orduna G, Humbert L, Fonolla R, et al. (2018). Cortical and Trabecular Bone Analysis of Patients With High Bone Mass From the Barcelona Osteoporosis Cohort Using 3-Dimensional Dual-Energy X-ray Absorptiometry: A Case-Control Study. Journal of Clinical Densitometry, 21(4), 480–484.
- Gifre L, Humbert L, Muxi A, et al. (2017). Analysis of the evolution of cortical and trabecular bone compartments in the proximal femur after spinal cord injury by 3D-DXA. Osteoporosis International, 29(1), 201–209.
- García Hoyos M, Humbert L, Salmón Z, et al. (2019). Analysis of volumetric BMD in people with Down syndrome using DXA-based 3D modeling. Archives of Osteoporosis, 14(1).
- Beck B, Harding A, Weeks B, et al. (2021). Response to “Concerns regarding the use of 3D-DXA”. Bone, 149, 115936.
- Winzenrieth R, Humbert L, Di Gregorio S, Bonel E, García M, Del Rio L. Effects of osteoporosis drug treatments on cortical and trabecular bone in the femur using DXA-based 3D modeling. Osteoporos Int.2018;29(10):2323–2333.
- Cummings SR, Cauley JA, Palermo L, et al. Racial differences in hip axis lengths might explain racial differences in rates of hip fracture. Osteoporos Int.1994;4(4):226–229.
- Kim KM, Brown JK, Kim KJ, et al. Differences in femoral neck geometry associated with age and ethnicity. Osteoporos Int. 2010;22(7):2165–2174.
- Sone T, Humbert L, Lopez M, et al. (2022). Assessment of femoral shape, trabecular and cortical bone in Japanese subjects using DXA-based 3D modelling. JOURNAL OF BONE AND MINERAL RESEARCH, 37, 214--214.
- Varoquaux G, Cheplygina V (2022). Machine learning for medical imaging: methodological failures and recommendations for the future. npj Digital Medicine, 5(1).
- Hadjiiski L, Cha K, Chan H, et al. (). AAPM task group report 273: Recommendations on best practices for AI and machine learning for computer‐aided diagnosis in medical imaging. Medical Physics, 50(2).
- Huisman M (2024). When AUC-ROC and accuracy are not accurate: what everyone needs to know about evaluating artificial intelligence in radiology. European Radiology, 34(12), 7892–7894.
- Gallifant J, Bitterman DS, Celi LA, et al. (2024). Ethical debates amidst flawed healthcare artificial intelligence metrics. npj Digital Medicine, 7(1).
- Amani A, Bellver M, del Rio L, et al. (2022). Femur 3D-DXA Assessment in Female Football Players, Swimmers, and Sedentary Controls. International Journal of Sports Medicine, 44(06), 420–426.
- Maïmoun L, Renard E, Humbert L, et al. (2021). Modification of bone mineral density, bone geometry and volumetric BMD in young women with obesity. Bone, 150, 116005.
- Jain RK, López Picazo M, Humbert L, et al. (2025). Bone Structural Parameters as Measured by 3-Dimensional Dual-Energy X-Ray Absorptiometry Are Superior in Black Women and Demonstrate Unique Associations With Prior Fracture Versus White Women. Endocrine Practice, 31(2), 152–158.
- Gracia-Marco L, Gonzalez-Salvatierra S, Garcia-Martin A, et al. (2021). 3D DXA Hip Differences in Patients with Acromegaly or Adult Growth Hormone Deficiency. Journal of Clinical Medicine, 10(4), 657.
- Toussirot E, Winzenrieth R, Aubin F, et al. (2024). Areal bone mineral density, trabecular bone score and 3D-DXA analysis of proximal femur in psoriatic disease. Frontiers in Medicine, 11.
- Ubago-Guisado E, Moratalla-Aranda E, González-Salvatierra S, et al. (2023). Do patients with type 2 diabetes have impaired hip bone microstructure? A study using 3D modeling of hip dual-energy X-ray absorptiometry. Frontiers in Endocrinology, 13.
- Guerra FS, Palladino N, Winzenrieth R, et al. (2024). Advanced 3D-DXA insights into bone density changes in hyperparathyroidism. Journal of Diabetes \& Metabolic Disorders, 23(2), 2191–2199.
- Kužma M, Vaňuga P, Ságová I, et al. Non-invasive DXA derived bone structure assessment of acromegaly patients: a cross sectional study. Eur J Endocrinol. 2019;180(3):201–211.
- Maïmoun L, Aouinti S, Puech M, et al. Modification of bone architecture following sleeve gastrectomy: a five-year follow-up. J Bone Miner Res. 2024;40(2):251–261.
- Maïmoun L, Gelis A, Serrand C, et al. (2023). Alteration of Volumetric Bone Mineral Density Parameters in Men with Spinal Cord Injury. Calcified Tissue International, 113(3), 304–316.
- Harding AT, Weeks BK, Lambert C, et al. (2020). Effects of supervised high-intensity resistance and impact training or machine-based isometric training on regional bone geometry and strength in middle-aged and older men with low bone mass: The LIFTMOR-M semi-randomised controlled trial. Bone, 136, 115362.
- Gil-Cosano JJ, Ubago-Guisado E, Sánchez MJ, et al. (2020). The effect of an online exercise programme on bone health in paediatric cancer survivors (iBoneFIT): study protocol of a multi-centre randomized controlled trial. BMC Public Health, 20(1).
- Humbert L, Whitmarsh T, De Craene M, et al. (2010). 3D reconstruction of both shape and Bone Mineral Density distribution of the femur from DXA images. 2010 IEEE International Symposium on Biomedical Imaging: From Nano to Macro, 456–459.
- O’Rourke D, Beck BR, Harding AT, et al. (2021). Assessment of femoral neck strength and bone mineral density changes following exercise using 3D-DXA images. Journal of Biomechanics, 119, 110315.
- Dudle A, Gugler Y, Pretterklieber M, et al. (2023). 2D-3D reconstruction of the proximal femur from DXA scans: Evaluation of the 3D-Shaper software. Frontiers in Bioengineering and Biotechnology, 11.
- Clotet J, Martelli Y, Di Gregorio S, et al. (2018). Structural Parameters of the Proximal Femur by 3-Dimensional Dual-Energy X-ray Absorptiometry Software: Comparison With Quantitative Computed Tomography. Journal of Clinical Densitometry, 21(4), 550–562.
- Ramamurthi K, Ahmad O, Engelke K, et al. (2011). An in vivo comparison of hip structure analysis (HSA) with measurements obtained by QCT. Osteoporosis International, 23(2), 543–551.
- Whitmarsh T, Treece GM, Gee AH, et al. (2015). Mapping Bone Changes at the Proximal Femoral Cortex of Postmenopausal Women in Response to Alendronate and Teriparatide Alone, Combined or Sequentially. Journal of Bone and Mineral Research, 30(7), 1309–1318.
- Whitmarsh T, Treece GM, Gee AH, et al. (2016). The Effects on the Femoral Cortex of a 24 Month Treatment Compared to an 18 Month Treatment with Teriparatide: A Multi-Trial Retrospective Analysis. PLOS ONE, 11(2), e0147722.
- Huininga K, Koromani F, Zillikens M, et al. (2024). Use of 3D Shaper Analysis for the Assessment of Fracture Risk in a Population-Based Setting. JBMR Plus, 8(Supplement\_1), i1--i340.
- Huininga K, Koromani F, Zillikens MC, et al. (2024). Use of 3D Shaper Analysis for the Assessment of Fracture Risk in a Population-based Setting. ASBMR 2024 Annual Meeting Abstracts and Abstract Book.
- Qasim M, López Picazo M, Ruiz Wills C, et al. (2024). 3D-DXA Based Finite Element Modelling for Femur Strength Prediction: Evaluation Against QCT. Journal of Clinical Densitometry, 27(2), 101471.
- Iki M, Winzenrieth R, Tamaki J, et al. (2021). Predictive ability of novel volumetric and geometric indices derived from dual-energy X-ray absorptiometric images of the proximal femur for hip fracture compared with conventional areal bone mineral density: the Japanese Population-based Osteoporosis (JPOS) Cohort Study. Osteoporosis International, 32(11), 2289–2299.
- Grassi L, Väänänen SP, Ristinmaa M, et al. Prediction of femoral strength using 3D finite element models reconstructed from DXA images: validation against experiments. Biomechanics and Modeling in Mechanobiology, 16(3).
- Grassi L, Fleps I, Sahlstedt H, et al. (). Validation of 3D finite element models from simulated DXA images for biofidelic simulations of sideways fall impact to the hip. Bone, 142.
- Grassi L, Väänänen SP, Jehpsson L, et al. (). 3D Finite Element Models Reconstructed From 2D Dual‐Energy X‐Ray Absorptiometry (DXA) Images Improve Hip Fracture Prediction Compared to Areal BMD in Osteoporotic Fractures in Men (MrOS) Sweden Cohort. Journal of Bone and Mineral Research, 38(9).
- Grassi L, Väänänen SP, Voss A, et al. DXA-based 3D finite element models predict hip fractures better than areal BMD in elderly women. Bone. 2025;195:117457.
- Allison SJ, Poole KES, Treece GM, et al. (2015). The Influence of High-Impact Exercise on Cortical and Trabecular Bone Mineral Content and 3D Distribution Across the Proximal Femur in Older Men: A Randomized Controlled Unilateral Intervention. Journal of Bone and Mineral Research, 30(9), 1709–1716.
- Whitmarsh T, Fritscher KD, Humbert L, et al. (2011). Hip fracture discrimination using 3D reconstructions from Dual-energy X-ray Absorptiometry. 2011 IEEE International Symposium on Biomedical Imaging: From Nano to Macro, 1189–1192.
- Winzenrieth R, Ominsky M, Wang Y, et al. (2021). Differential effects of abaloparatide and teriparatide on hip cortical volumetric BMD by DXA-based 3D modeling. Osteoporosis International, 32(3), 575–583.
- England JR, Cheng PM (2019). Artificial Intelligence for Medical Image Analysis: A Guide for Authors and Reviewers. American Journal of Roentgenology, 212(3), 513–519.
- Lewiecki EM, Betah D, Humbert L, et al. (2024). 3D-modeling from hip DXA shows improved bone structure with romosozumab followed by denosumab or alendronate. Journal of Bone and Mineral Research, 39(4), 473–483.
- Winzenrieth R, Kostenuik P, Boxberger J, et al. (2022). Proximal Femur Responses to Sequential Therapy With Abaloparatide Followed by Alendronate in Postmenopausal Women With Osteoporosis by 3D Modeling of Hip Dual‐Energy X‐Ray Absorptiometry (DXA). JBMR Plus, 6(4).
- Winzenrieth R, Humbert L, Boxberger JI, et al. (2022). Abaloparatide Effects on Cortical Volumetric BMD and Estimated Strength Indices of Hip Subregions by 3D-DXA in Women With Postmenopausal Osteoporosis. Journal of Clinical Densitometry, 25(3), 392–400.
- Bennett C, Miller M, Wolford G (2009). Neural correlates of interspecies perspective taking in the post-mortem Atlantic Salmon: an argument for multiple comparisons correction. NeuroImage, 47, S125.
- Poole KE, Treece GM, Gee AH, et al. (2014). Denosumab Rapidly Increases Cortical Bone in Key Locations of the Femur: A 3D Bone Mapping Study in Women With Osteoporosis. Journal of Bone and Mineral Research, 30(1), 46–54.
- Sato M, Westmore M, Ma YL, et al. (2004). Teriparatide [PTH(1–34)] Strengthens the Proximal Femur of Ovariectomized Nonhuman Primates Despite Increasing Porosity. Journal of Bone and Mineral Research, 19(4), 623–629.
- Hadji P, Kamali L, Thomasius F, et al. (2024). Real-world efficacy of a teriparatide biosimilar (RGB-10) compared with reference teriparatide on bone mineral density, trabecular bone score, and bone parameters assessed using quantitative ultrasound, 3D-SHAPER{\textregistered} and high-resolution peripheral computer tomography in postmenopausal women with osteoporosis and very high fracture risk. Osteoporosis International, 35(12), 2107–2116.
- Sone T, Ohnaru K, Sugai T, et al. (2023). The effects of abaloparatide on hip geometry and biomechanical properties in Japanese osteoporotic patients assessed using DXA-based hip structural analysis: results of the Japanese phase 3 ACTIVE-J trial. Archives of Osteoporosis, 18(1).
- Genant HK, Engelke K, Bolognese MA, et al. (2016). Effects of Romosozumab Compared With Teriparatide on Bone Density and Mass at the Spine and Hip in Postmenopausal Women With Low Bone Mass. Journal of Bone and Mineral Research, 32(1), 181–187.
- MEDICAL 3S (2021). Webinar - Use of 3D-Shaper in clinical research: state of the art and potential applications
- Casado Burgos E, Di Gregorio S, González Macías J, et al. (2019). Datos de referencia de mediciones óseas en modelos 3D de fémur proximal en población española cn DXA: Proyecto SEIOMM 3D-SHAPPER. Congreso SEIOMM (24º : 2019 : Gerona).
- Brance ML, Saravi FD, Henr{\'i}quez MM, et al. (2020). Reference Values of Three-Dimensional Proximal Femur Parameters from Bone Densitometry Images in Healthy Subjects from Argentina. World Congress on Osteoporosis, Osteoarthritis and Musculoskeletal Diseases, 372--372.
- Jennings I (). 3D Shaper Technology: Revolutionizing Bone Health Analysis
- Al-Hashimi L, Klotsche J, Ohrndorf S, et al. (2023). Trabecular Bone Score Significantly Influences Treatment Decisions in Secondary Osteoporosis. Journal of Clinical Medicine, 12(12), 4147.
- Food {, Administration} D (2022). 510(k) Summary: K220822
- Broy SB, Cauley JA, Lewiecki ME, et al. (2015). Fracture Risk Prediction by Non-BMD DXA Measures: the 2015 ISCD Official Positions Part 1: Hip Geometry. Journal of Clinical Densitometry, 18(3), 287–308.
- Whitmarsh T, Humbert L, Craene MD, et al. (2009). Reconstrucción de la forma del fémur y densidad mineral ósea en 3D para el diagnóstico de osteoporosis a partir de DXA
- Whitmarsh T, Humbert L, Del Río Barquero LM, et al. (2011). Volumetric Bone Mineral Density Estimation using a 3D Reconstruction Method from Dual-energy X-ray Absorptiometry. ASBMR 2011 Annual Meeting Abstracts and Abstract Book.
- Whitmarsh T, Fritscher KD, Humbert L, et al. (2011). A Statistical Model of Shape and Bone Mineral Density Distribution of the Proximal Femur for Fracture Risk Assessment. Medical Image Computing and Computer-Assisted Intervention – MICCAI 2011, 393–400.
- Whitmarsh T, Fritscher KD, Humbert L, et al. (2012). Hip fracture discrimination from dual-energy X-ray absorptiometry by statistical model registration. Bone, 51(5), 896–901.
- Martelli Y, Whitmarsh T, Humbert L, et al. (2012). A software framework for 3D reconstruction and fracture risk assessment of the proximal femur from dual-energy x-ray absorptiometry. Proceedings of VPH 2012: Virtual Physiological Human - Integrative approaches to computational biomedicine.
- Slart RHJA, Punda M, Ali DS, et al. (2024). Updated practice guideline for dual-energy X-ray absorptiometry (DXA). European Journal of Nuclear Medicine and Molecular Imaging, 52(2), 539–563.