Abstrak
3D-DXA, seperti yang dilaksanakan dalam alat perisian 3D-Shaper, adalah kaedah perisian yang menghasilkan pembinaan semula 3D femur proksimal daripada satu imej 2D DXA dengan mendaftarkan model statistik. Pelaksanaan 3D-DXA bertujuan untuk memberikan anggaran parameter trabekular, kortikal, dan struktur yang serupa dengan yang diperoleh daripada tomografi berkomputer kuantitatif (QCT). Sebagai pencipta dan pembangun kaedah perisian yang menjadi asas kepada 3D-DXA, saya telah memerhatikan penerimaan dan penggunaannya yang meluas dengan kebimbangan yang semakin meningkat. Artikel ini memberikan penilaian kritikal terhadap had metodologi yang wujud dalam 3D-DXA dan membincangkan implikasinya untuk penyelidikan dan penjagaan pesakit. Isu utama ialah keterlihatan korteks yang terhad dalam imej DXA menghalang 3D-DXA daripada memperoleh parameter kortikal dengan tepat. Sebaliknya, perisian ini bergantung pada ramalan berdasarkan BMD keseluruhan dan bukannya pengukuran kortikal secara langsung. Ini mungkin membawa kepada keputusan yang tidak mencerminkan pengukuran kortikal yang sebenar. Kebimbangan tambahan termasuk bias populasi disebabkan oleh model statistik yang diperoleh daripada demografi tertentu, dan ketepatan pembinaan semula yang terhad dengan menggunakan imej DXA pandangan tunggal. Had-had ini mungkin telah mengakibatkan pengukuran dan hasil penyelidikan yang tidak betul, yang sebahagian besarnya tidak disedari kerana penggunaan metrik penilaian prestasi yang tidak sesuai dan ketiadaan pembetulan perbandingan berganda dalam kajian yang melibatkan 3D-DXA. Walaupun terdapat had-had ini, 3D-DXA telah menerima kelulusan kawal selia di pelbagai negara, yang berpotensi menjejaskan ketepatan diagnosis klinikal dan keputusan rawatan. Dengan mengetengahkan isu-isu ini, artikel ini bertujuan untuk memaklumkan kepada doktor, penyelidik, dan badan kawal selia mengenai had ketara 3D-DXA. Ia menekankan keperluan mendesak untuk penilaian semula penggunaannya dalam tetapan penyelidikan dan klinikal untuk mengelakkan salah tafsir keputusan dan memastikan keselamatan pesakit.Kata kunci
3D-DXA, 3D-Shaper, Osteoporosis, Ketumpatan Mineral Tulang, Absorptiometri Sinar-X Tenaga Ganda, Pemetaan Parameter Kortikal, Analisis Struktur Pinggul.Ringkasan Awam
Ulasan ini meneliti secara kritis perisian 3D-DXA, juga dikenali sebagai 3D-Shaper, yang bertujuan untuk menganggarkan parameter trabekular, kortikal, dan struktur femur proksimal daripada satu imej DXA. 3D-DXA mempunyai beberapa had yang wujud yang boleh menyebabkan pengukuran yang tidak tepat, yang berpotensi mempengaruhi hasil penyelidikan dan keputusan rawatan pesakit. Memahami isu-isu ini adalah penting bagi penyelidik dan doktor untuk mengelakkan salah tafsir yang boleh memberi kesan kepada pengetahuan kita tentang fisiologi tulang, kesan rawatan ubat, dan keselamatan pesakit.Pengenalan
3D-DXA adalah kaedah perisian yang mendaftarkan model ubah bentuk statistik 3D ke atas satu imej 2D DXA untuk menghasilkan model 3D femur proksimal [1]. Model ini dibina daripada satu set imbasan tomografi berkomputer kuantitatif (QCT) populasi Kaukasia Sepanyol yang terdiri daripada 81 wanita dan 30 lelaki dengan umur purata 56.2 ± 12.1 tahun, antara 30 dan 84 tahun [2]. Parameter model statistik kemudiannya menerangkan variasi utama dalam bentuk dan taburan ketumpatan populasi ini. Dalam proses berulang, parameter model, serta lokasi, orientasi dan saiz, dicari dalam usaha untuk menjadikan unjuran model menyerupai imej DXA (Rajah 1). Daripada model 3D yang dihasilkan, parameter kortikal kemudiannya diukur merentasi permukaan tulang, bersama-sama dengan nilai BMD volumetrik trabekular di dalamnya. Ralat mutlak purata sebanyak 0.33 mm untuk ketebalan kortikal dan 72 mg/cm³ untuk ketumpatan kortikal dilaporkan apabila membandingkan 3D-DXA dengan QCT, dengan pekali korelasi lebih besar atau sama dengan 0.86 [2].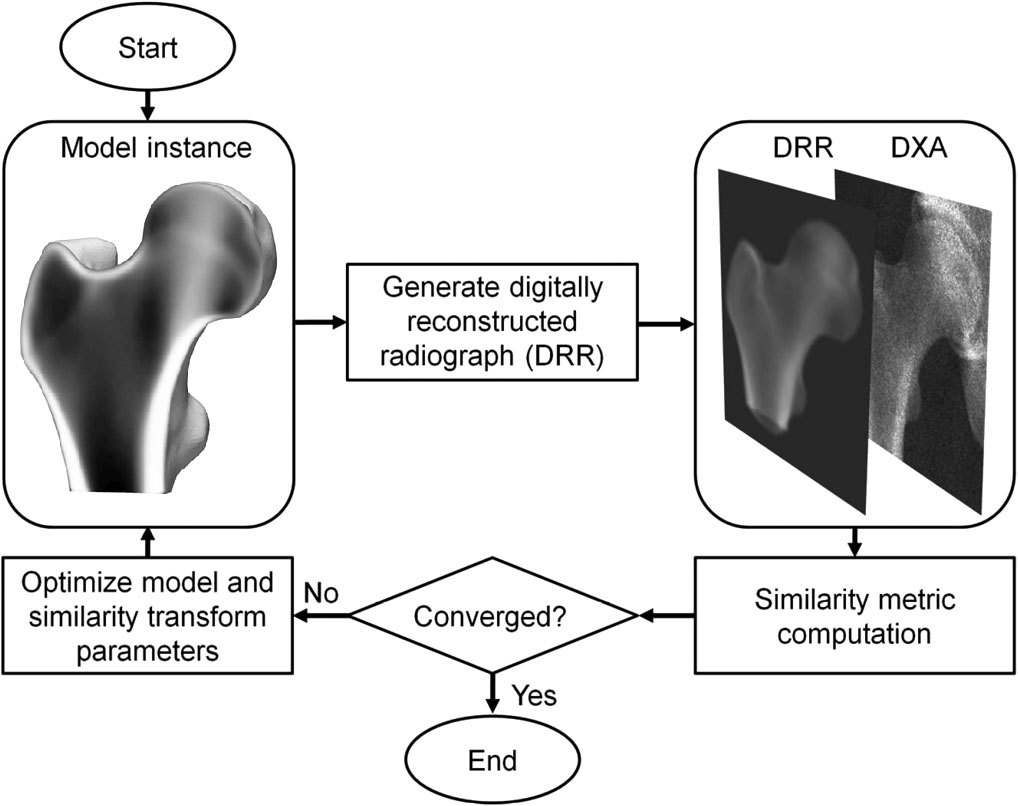
Walaupun kaedah lain telah dicadangkan untuk pembinaan semula struktur tulang 3D daripada imej DXA menggunakan model statistik [4, 5], ia adalah kaedah perisian yang pertama kali diterbitkan pada 2010 [6] yang kemudiannya dikomersialkan sebagai 3D-DXA oleh Galgo Medical SL (Barcelona, Sepanyol), sebuah syarikat sampingan Universiti Pompeu Fabra (Barcelona, Sepanyol). Perisian ini kemudiannya diperluaskan untuk mengukur ketebalan kortikal dan ketumpatan mineral tulang (BMD) kortikal daripada pembinaan semula volumetrik [2], yang kini dikomersialkan sebagai 3D-Shaper oleh 3D-Shaper Medical SL (Barcelona, Sepanyol), sebuah lagi syarikat sampingan Galgo Medical SL, menyediakan perkhidmatan dan perisian. Perisian ini dilesenkan kepada DMS Imaging (Mauguio, Perancis) untuk dijual sebagai 3D-DXA dengan peranti Stratos/Medix DXA mereka. Fujifilm (Tokyo, Jepun) menjual peranti DXA yang sama oleh DMS di bawah jenama Fujifilm FDX Visionary DXA. Juga Imex Medical (São José, Brazil) menjual peranti ini sebagai siri Elipse dan Radiología SA (Madrid, Sepanyol) menjualnya sebagai Radioscore - DR. Kesemuanya termasuk pilihan untuk menambah 3D-DXA.
Setelah membangunkan kaedah perisian asal [1], saya mempunyai pemahaman mendalam tentang had, batasan wujud yang mungkin tidak jelas kepada pengguna dan penyelidik lain. Walaupun saya telah menjelaskan had utama perisian ini dalam satu surat kepada editor Bone [7], 3D-DXA terus dijual dan digunakan di seluruh dunia. 3D-Shaper telah menerima kelulusan daripada pihak berkuasa kawal selia di EU, Jepun, Thailand, Argentina, dan pelepasan 510(k) daripada FDA, membenarkan penggunaannya untuk mendiagnosis dan membuat keputusan rawatan pada pesakit. Memandangkan sokongan ini, adalah kritikal dan mendesak untuk menangani dan menjelaskan beberapa salah tanggapan mengenai perisian ini, dengan itu meningkatkan pemahaman tentang hadnya.
Had Metodologi
Dalam bahagian ini saya akan menerangkan beberapa had metodologi yang menjadi asas 3D-DXA, serta butiran pelaksanaan khusus yang mungkin menyumbang kepada ketidaktepatan selanjutnya.Parameter kortikal tidak diukur
Isu utama terletak pada kekurangan keterlihatan korteks dalam imej DXA untuk 3D-DXA memperoleh parameter kortikalnya. Untuk menggambarkan ini, saya ingin melihat semula satu rajah daripada surat kepada editor Bone (Rajah 2). Imej DXA menunjukkan dengan jelas bahawa di kebanyakan lokasi pada permukaan tulang, tiada korteks yang dapat dilihat untuk memperoleh parameter kortikal. Ini terpakai kepada kontur unjuran tulang (A) dan terutamanya benar di mana dua korteks bertentangan berserenjang dengan pengesan sinar-X (B). Ini jelas dalam imej ini daripada pengimbas GE iDXA dengan saiz piksel 0.3 x 0.25mm, tetapi menjadi lebih ketara dalam imej menggunakan peranti GE Prodigy DXA yang lebih lama, yang menghasilkan imej resolusi lebih rendah dengan saiz piksel 0.6 x 1.05mm, tetapi juga disokong oleh perisian 3D-Shaper.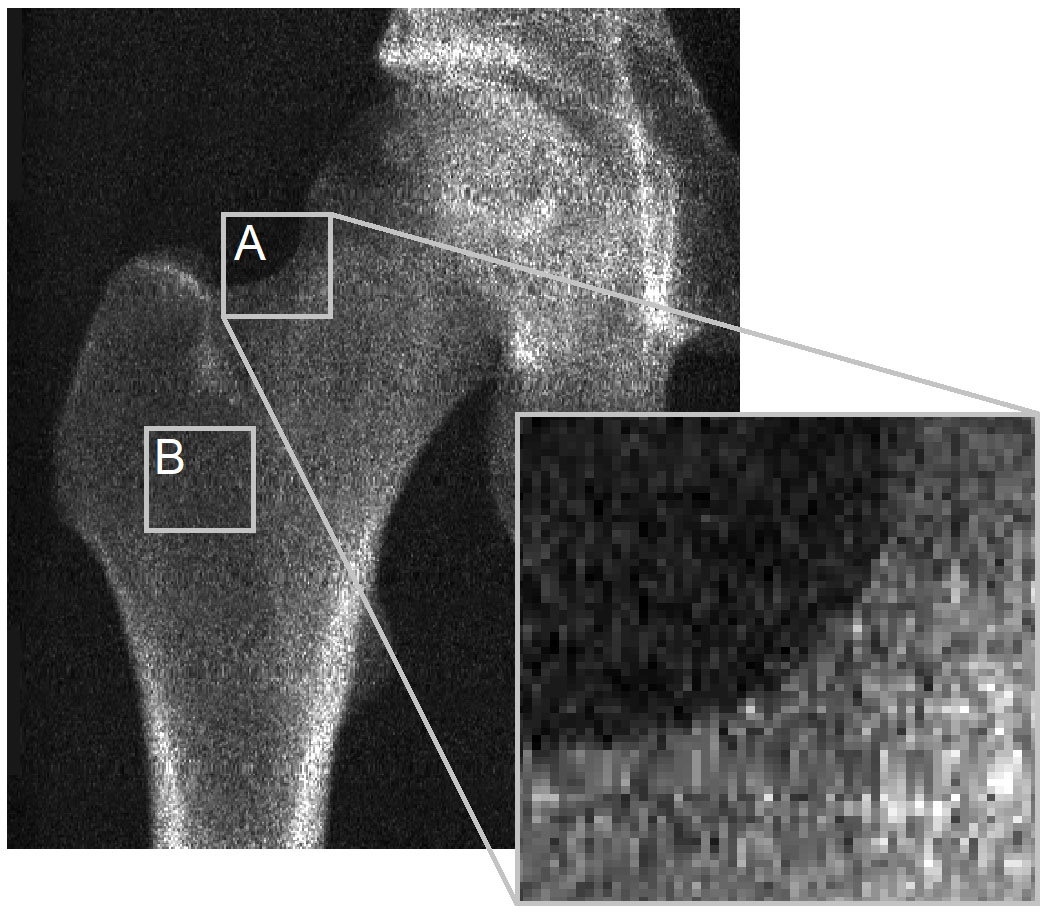
Daripada mengukur parameter kortikal secara langsung daripada imej DXA, 3D-DXA mendaftarkan model statistik bentuk dan taburan ketumpatan ke atas imej DXA [3], dan mengekstrak parameter kortikal daripada model ini [2]. Model ini dibina daripada satu set imbasan QCT yang dikalibrasi.
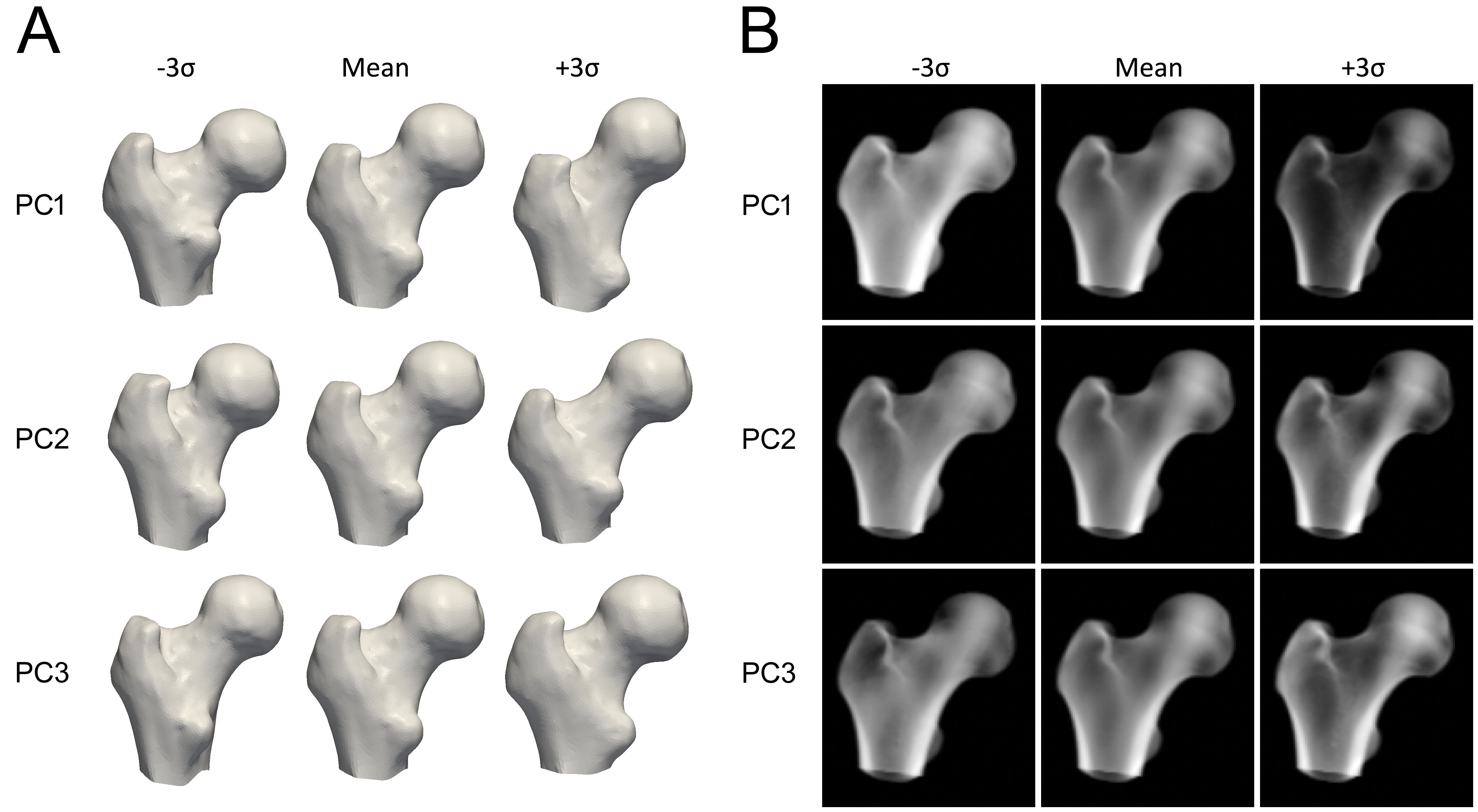
Dalam model ketumpatan statistik ini, parameter model tunggal—komponen utama pertama—yang merangkumi sebahagian besar (87% dalam femur proksimal) variasi dalam ketumpatan tulang merentas keseluruhan model (Rajah 3) [3]. Parameter ini berkaitan secara langsung dengan ketumpatan keseluruhan: meningkatkan nilainya membawa kepada peningkatan serentak dan berkadar dalam semua nilai ketumpatan dan parameter kortikal di seluruh femur (Rajah 4) [7].
Maka, apabila peta parameter kortikal dibentangkan oleh 3D-DXA, dengan nilai di lokasi di mana tiada korteks yang mungkin dapat diukur [9, 10, 11, 12, 13], peta ini hanyalah diperoleh daripada contoh model itu. Walaupun 3D-Shaper Medical menjelaskan dalam satu maklum balas kepada surat kepada editor Bone [14] bahawa parameter ini dianggarkan dan bukannya diukur, penerangan yang lebih tepat adalah bahawa 3D-DXA meramalkan nilai-nilai ini menggunakan kaedah statistik yang kompleks dan berpotensi terdedah kepada ralat.
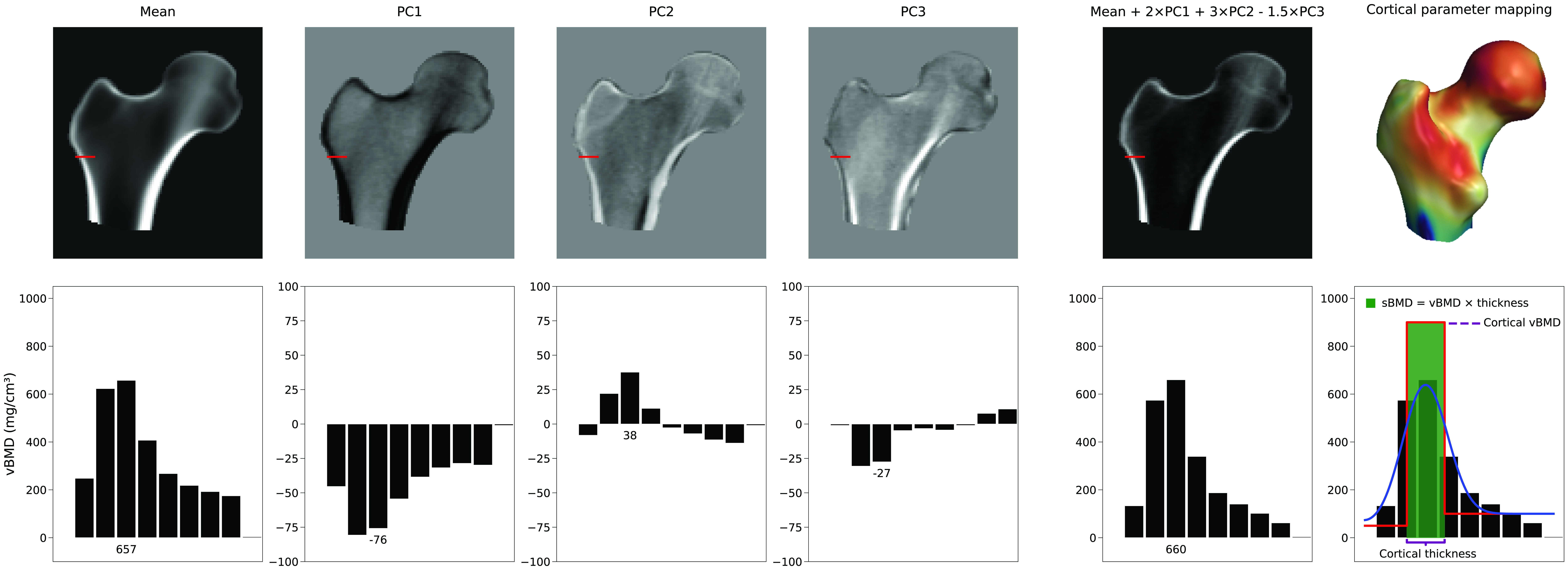
Bias populasi yang berpotensi
Sebarang model tulang 3D yang dihasilkan oleh 3D-DXA diperoleh daripada statistik mengenai variasi populasi input. Dalam kes 3D-Shaper, model statistik dibina daripada populasi Sepanyol. Adalah jelas bahawa morfologi femur berbeza antara lelaki dan wanita, tetapi demografi juga memainkan peranan penting. Sebagai contoh, tulang femur populasi Kaukasia berbeza dengan ketara daripada populasi Asia, seperti yang didokumenkan dalam kajian terdahulu [16].Model yang dibina daripada populasi Kaukasia tidak akan dapat menghasilkan pembinaan semula yang sesuai dengan setiap subjek dalam populasi Asia. Walaupun 3D-DXA dipasarkan di Asia termasuk Jepun, Thailand, dan India, had ini menimbulkan kebimbangan.
Ketepatan pembinaan semula yang terhad
3D-DXA adalah kaedah yang sangat kompleks dan terdedah kepada ralat pada pelbagai peringkat. Adalah munasabah bahawa, jika bentuk femur proksimal dan orientasinya tidak dipadankan dengan sempurna dengan imej DXA, dalam ketepatan sub-milimeter, adalah mustahil untuk mengekstrak ketebalan kortikal dalam ketepatan sub-milimeter, mahupun ketumpatan kortikal.Rajah 5 menunjukkan ralat ketebalan yang ketara.
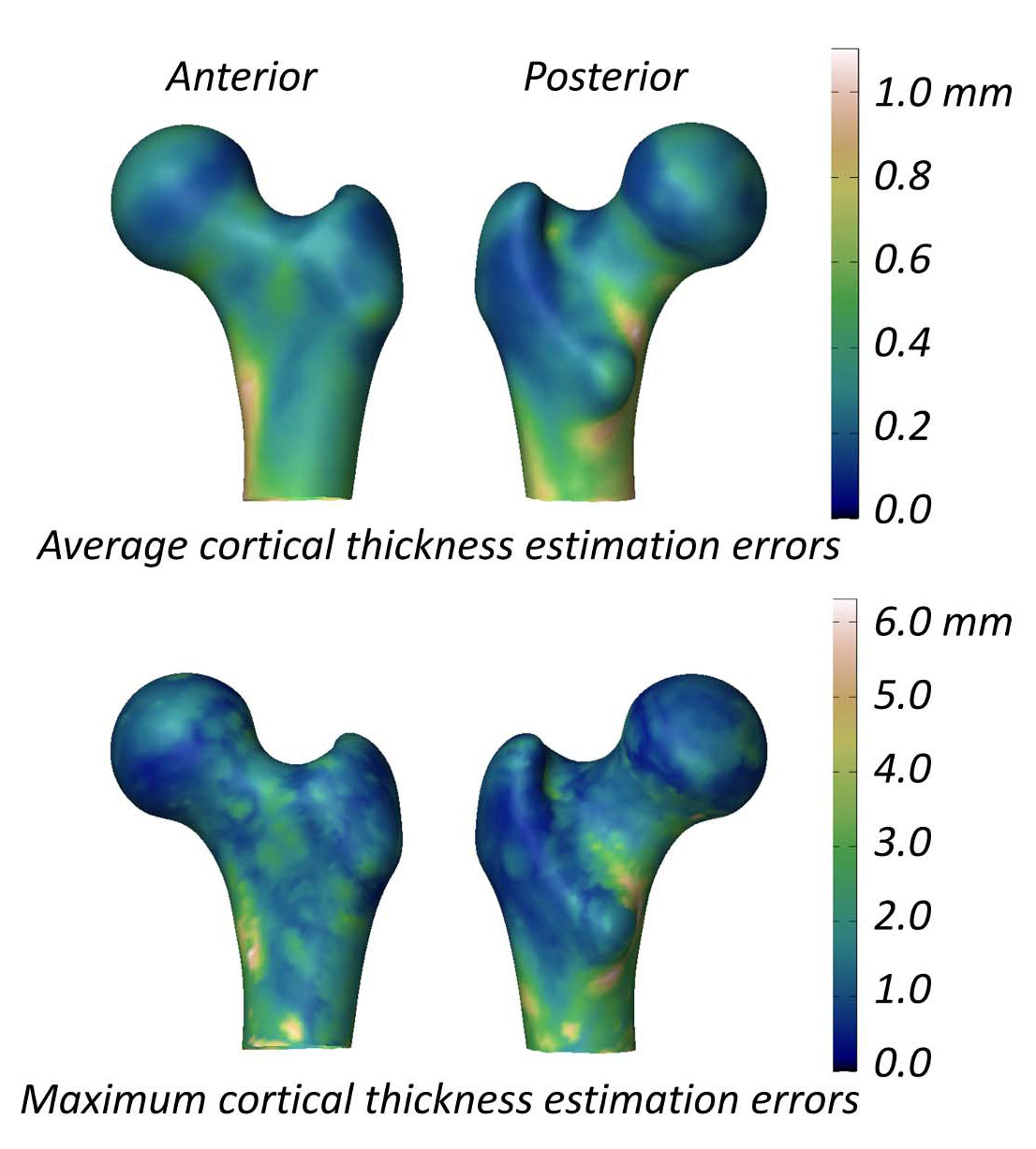
Faedah terhad berbanding BMD kawasan
Oleh kerana terdapat sedikit maklumat mengenai korteks dalam imej DXA, 3D-DXA terutamanya bergantung pada ketumpatan keseluruhan, dan dengan itu, pada parameter model pertama. Akibatnya, parameter kortikal dan trabekular secara inheren berkorelasi. Walaupun terdapat batasan wujud 3D-DXA, banyak penerbitan melaporkan penemuan positif mengenai ketepatannya. Percanggahan ini boleh dikaitkan dengan penggunaan kaedah pengesahan yang tidak sesuai.Metrik penilaian prestasi yang salah
3D-Shaper Medical membandingkan mesh permukaan yang dihasilkan oleh 3D-DXA daripada imej DXA dengan mesh permukaan yang dihasilkan secara manual daripada imbasan QCT subjek yang sama, menghasilkan jarak purata titik-ke-permukaan sebanyak 0.93 mm [2]. Mereka juga membandingkan parameter kortikal, mendapati ralat mutlak purata sebanyak 0.33 mm untuk ketebalan kortikal dan 72 mg/cm³ untuk ketumpatan kortikal. Walau bahawasanya, tiada rangka rujukan untuk menentukan sama ada ralat yang dilaporkan ini boleh diterima, yang bermaksud metrik ini tidak semestinya mengesahkan keberkesanan perisian tersebut.Satu lagi cara di mana 3D-DXA dinilai adalah melalui penggunaan korelasi. Pekali korelasi masing-masing sebanyak 0.86, 0.93, 0.95 dan 0.91 dilaporkan untuk vBMD trabekular, kortikal, dan integral, serta ketebalan kortikal. Walau bagaimanapun, korelasi yang kuat ini terutamanya disebabkan oleh fakta bahawa semua parameter kortikal dalam kedua-dua model 3D-DXA dan imbasan QCT berkorelasi kuat dengan ketumpatan keseluruhan. Pesakit dengan aBMD yang lebih tinggi daripada purata dalam imbasan DXA mereka akan, secara purata, juga menunjukkan peningkatan vBMD trabekular, kortikal, dan integral, bersama-sama dengan korteks yang lebih tebal. Keputusan korelasi ini tidak memberikan bukti konklusif tentang ketepatan perisian dalam menghasilkan pembinaan semula khusus pesakit dan, malah, mungkin mencipta gambaran yang mengelirukan tentang prestasinya.
Korelasi juga digunakan untuk menilai kajian berasaskan populasi menggunakan 3D-DXA. Kesan yang sama dapat dilihat apabila analisis 3D-DXA menunjukkan korelasi yang signifikan antara parameternya dan faktor yang diuji atau merentas populasi yang berbeza. Ini sekali lagi kerana parameter ini secara inheren berkorelasi dengan BMD keseluruhan dan dengan itu mencerminkan secara langsung perubahan atau perbezaan dalam aBMD. Penemuan mungkin kelihatan munasabah dan boleh mencerminkan perubahan sebenar dengan teliti. Sebagai contoh, senaman meningkatkan ketumpatan keseluruhan dan kandungan mineral tulang kortikal [49], membawa kepada keputusan yang nampaknya munasabah daripada analisis 3D-DXA apabila aBMD meningkat disebabkan oleh senaman. Walau bagaimanapun, ini tidak mencerminkan parameter kortikal sebenar itu sendiri, tetapi hanyalah perubahan atau perbezaan asas dalam aBMD. Oleh itu, kajian-kajian ini boleh mencipta gambaran yang mengelirukan tentang keberkesanan 3D-DXA, memberikan rasa palsu tentang keupayaannya untuk mengukur parameter kortikal secara tepat.
Penilaian yang lebih sesuai akan melibatkan perbandingan parameter kortikal dengan model garis dasar asas, seperti penganggar buta (blind estimator). Di sini penganggar buta merujuk kepada kaedah anggaran yang mudah dan naif yang tidak mengambil kira kebolehubahan individu dan sebaliknya menggunakan nilai purata daripada keseluruhan populasi kepada semua subjek. Sebagai contoh, penganggar buta untuk ketebalan kortikal akan menggunakan peta ketebalan kortikal purata daripada sekumpulan individu dan menerapkannya secara seragam pada setiap kes, tanpa mengira ciri-ciri khusus mereka. Pendekatan ini berfungsi sebagai garis dasar, atau piawaian minimum, yang mana kaedah yang lebih maju harus dinilai. Sebarang kaedah canggih sekurang-kurangnya harus mengatasi anggaran asas ini. Setakat pengetahuan saya, penilaian sedemikian belum lagi diterbitkan.
Kebanyakan penerbitan mengenai perisian 3D-DXA hanya mempamerkan pembinaan semula yang berjaya, yang boleh mewujudkan rasa yakin palsu terhadap kebolehpercayaan perisian tersebut. Untuk menilai kebolehpercayaan 3D-DXA secara kuantitatif, penilaian kadar kegagalan boleh dilakukan. Dalam satu kajian terdahulu [51], walaupun tidak dinyatakan secara nyata, hanya 80 daripada 173 subjek yang dikekalkan selepas mengecualikan pembinaan semula yang dikenal pasti sebagai tidak tepat melalui perbandingan unjuran model dengan imej DXA, menghasilkan kadar kegagalan melebihi 50%. Untuk membolehkan penilaian sedemikian, 3D-Shaper perlu menyediakan paparan sebelah-menyebelah unjuran model dan imej DXA. Penilaian yang lebih mantap, bagaimanapun, akan membandingkan rendering dan pandangan keratan rentas isipadu yang dihasilkan dengan imbasan QCT kebenaran asas (ground-truth) dan menilai kadar kegagalan dalam penilaian bebas.
Dalam beberapa kes, sekadar memerhati perubahan atau perbezaan yang signifikan dibentangkan sebagai bukti bahawa 3D-DXA berfungsi, sambil mengabaikan sama ada kesan sebenar adalah betul. Dalam maklum balas kepada surat saya kepada editor, perbezaan signifikan antara kumpulan rawatan dibentangkan sebagai bukti keberkesanan 3D-DXA. Walau bagaimanapun, dalam penilaian ini, penulis memberikan 2 keputusan yang berbeza untuk perubahan BMD kortikal selepas rawatan TPTD, satu menunjukkan peningkatan yang signifikan [52] und satu lagi penurunan yang tidak signifikan [15]. Tiada satu pun daripada ini mencerminkan perubahan sebenar yang dijangkakan dalam rawatan TPTD, seperti yang saya terangkan dalam Bahagian “Keputusan yang mengelirukan dalam kajian keberkesanan ubat”.
Ketiadaan pembetulan perbandingan berganda
Kebimbangan dalam bahagian ini bukan terutamanya berkaitan dengan perisian 3D-DXA itu sendiri, tetapi lebih kepada perkhidmatan yang disediakan oleh 3D-Shaper Medical dan penerbitan seterusnya. Isu kritikal terletak pada kekurangan pembetulan perbandingan berganda apabila melaporkan perubahan atau perbezaan dalam parameter 3D-DXA, terutamanya dalam peta parameter kortikal.Mengaplikasikan pembetulan perbandingan berganda adalah sangat penting apabila menganalisis data dengan pelbagai ukuran yang berbeza. Untuk 3D-Shaper, perisian menjana 71 parameter tulang, dengan setiap satu mewakili ujian statistik yang berasingan. Tanpa melaraskan perbandingan berganda ini, seperti dengan pembetulan Bonferroni, kemungkinan untuk memperoleh keputusan yang signifikan secara kebetulan meningkat, membawa kepada kesimpulan yang salah. Walau bagaimanapun, kajian yang menggunakan 3D-Shaper sering melaporkan perubahan atau perbezaan signifikan tanpa menggunakan sebarang bentuk pembetulan perbandingan berganda [10, 24, 27, 28], mewujudkan rasa yakin yang tidak wajar terhadap keputusan tersebut. Ini boleh mengelirukan apabila parameter tertentu diukur tetapi tidak dilaporkan, satu bentuk bias p-hacking [53], di mana keputusan signifikan diserlahkan sambil mengabaikan peningkatan risiko positif palsu (false positives) disebabkan oleh jumlah ujian yang besar yang dijalankan.
Isu yang sama berlaku apabila kajian menggunakan 3D-Shaper membentangkan peta kod warna yang menunjukkan perubahan atau perbezaan dalam parameter kortikal pada permukaan tulang atau nilai BMD dalam isipadu. Dalam kes ini, setiap verteks atau voksel mewakili ujian statistik individu, dengan kepentingan sering ditentukan oleh ujian-t mudah pada setiap titik [9, 10, 11, 12, 13, 28, 52, 54, 55]. Pendekatan ini menyerlahkan kawasan yang nampaknya signifikan dalam peta kod warna, mewujudkan ilusi perubahan atau perbezaan setempat di mana sebenarnya tiada. Apabila membentangkan perubahan atau perbezaan dalam isipadu melalui pandangan keratan rentas berkod warna, kepentingan statistik pada tahap voksel secara amnya tidak disediakan langsung [9, 11, 30, 52, 54, 55, 56]. Cara ini mencadangkan perubahan sebenar padahal, pada hakikatnya, ia mungkin sekadar hasil daripada variasi rawak. Akibatnya, peta kod warna ini boleh memberikan gambaran yang terlalu optimistik tentang kesan rawatan atau intervensi, secara palsu mencadangkan keberkesanan di mana mungkin tiada.
Isu positif palsu disebabkan oleh pembetulan perbandingan berganda yang tidak mencukupi telah menjadi cabaran berterusan dalam bidang neuroimejan [57]. Untuk menangani perkara ini, komuniti neuroimejan telah membangunkan penyelesaian yang juga boleh digunakan untuk kajian yang meneliti perubahan tulang kortikal pada permukaan tulang dan perubahan ketumpatan dalam voksel imbasan QCT. Poole et al. [58] menerangkan cara SurfStat (http://math.mccgill.ca/keith/surfstat/) boleh digunakan untuk menguji sama ada perbezaan dalam parameter kortikal pada setiap titik pada permukaan tulang adalah signifikan secara statistik, dengan teori medan rawak digunakan untuk pembetulan perbandingan berganda. Pakej serupa wujud untuk analisis berasaskan voksel, seperti perpustakaan Statistical Parametric Mapping (https://www.fil.ion.ucl.ac.uk/spm/) dan FMRIB Software Library (https://fsl.fmrib.ox.ac.uk). Penggunaan alatan ini akan meningkatkan ketegasan statistik kajian yang menggunakan 3D-DXA, walaupun perubahan atau perbezaan yang diperhatikan masih sebahagian besarnya mencerminkan korelasi semua parameter dengan aBMD.
Implikasi
Penggunaan 3D-DXA mempunyai implikasi yang luas dalam penyelidikan dan amalan klinikal.Keputusan yang mengelirukan dalam kajian keberkesanan ubat
Dalam kebanyakan kajian, keputusan 3D-DXA selaras dengan apa yang dijangkakan dalam korteks, kerana parameter kortikal pada individu yang sihat biasanya berkorelasi dengan aBMD. Ini sering membawa kepada keputusan yang nampaknya munasabah. Walau bagaimanapun, pendekatan ini menjadi cacat apabila perubahan tidak mengikut corak konvensional. Kaedah ini amat bermasalah dalam ujian ubat di mana pemodelan dan pembentukan semula tulang yang normal diubah, dan peningkatan atau penurunan berkadar biasa dalam semua parameter mungkin tidak berlaku.Contoh ilustrasi ialah kajian tentang teriparatide, di mana 3D-DXA menunjukkan peningkatan dalam semua parameter kortikal, termasuk peningkatan signifikan dalam vBMD kortikal berbanding plasebo [52]. Sebaliknya, menggunakan teknik pengukuran kortikal yang setara yang digunakan pada QCT, BMD kortikal ditunjukkan menurun secara signifikan berikutan rawatan teriparatide selama 18 bulan yang sama, yang dilihat secara konsisten dalam data daripada tiga ujian klinikal yang berbeza [41]. Penurunan ini dikaitkan dengan peningkatan kadar pembentukan semula, yang menghasilkan keliangan kortikal (cortical porosity) yang lebih besar, seperti yang juga diperhatikan menggunakan micro-CT [59].
Dalam kajian terdahulu, 3D-Shaper Medical melaporkan penurunan dalam BMD kortikal sebagai tindak balas kepada teriparatide [15]. Walaupun ini dicatatkan oleh penulis sebagai penurunan, perubahan itu tidak signifikan secara statistik. Satu kajian bebas yang lebih baru juga mendapati tiada perubahan signifikan dalam BMD kortikal sebagai tindak balas kepada rawatan teriparatide menggunakan analisis 3D-DXA [60]. Berkemungkinan terdapat kesan daripada korteks syaf, yang sebahagiannya kelihatan dalam imej DXA. Disebabkan sifat 3D-DXA, penurunan aBMD di kawasan ini mungkin telah dipancarkan ke seluruh model femur, termasuk kawasan di mana tiada korteks kelihatan, memandangkan parameter model mempengaruhi taburan ketumpatan secara global. Walau bagaimanapun, ini tidak membawa kepada penurunan signifikan yang betul dalam BMD kortikal seperti yang diperhatikan dalam kajian QCT.
Kajian yang melaporkan peningkatan dalam semua parameter kortikal dengan teriparatide (TPTD) juga menilai abaloparatide secara selari, menunjukkan peningkatan yang lebih besar dalam semua parameter untuk abaloparatide [52]. Kajian susulan menggunakan analisis 3D-DXA juga melaporkan peningkatan signifikan dalam BMD kortikal selepas rawatan abaloparatide [55, 56]. Memandangkan abaloparatide berkongsi mekanisme tindakan yang serupa dengan TPTD, meningkatkan kadar pembentukan semula tulang, seseorang secara munasabah menjangkakan ia juga akan membawa kepada penurunan dalam BMD kortikal. Malah, satu kajian menggunakan QCT memerhatikan penurunan dalam BMD kortikal berikutan tempoh rawatan abaloparatide yang sama dalam 35 pesakit [61], walaupun pengurangan itu tidak signifikan secara statistik. Ini mencadangkan bahawa kajian 3D-DXA bukan sahaja menghasilkan perubahan yang tidak tepat tetapi juga berkemungkinan menghasilkan penilaian yang terlalu menggalakkan terhadap kesan abaloparatide.
Satu kajian oleh Lewiecki et al. [54] seterusnya menggambarkan had 3D-DXA dalam mengukur perubahan kortikal yang tidak seiring. Analisis 3D-DXA mereka melaporkan peningkatan dalam semua parameter kortikal sebagai tindak balas kepada romosozumab. Sebaliknya, analisis QCT terdahulu mendapati tiada peningkatan dalam BMD kortikal berikutan rawatan yang sama [62]. Penulis mencatatkan: “Adalah tidak jelas mengapa data yang diperoleh oleh QCT dan 3D-SHAPER berasaskan DXA untuk rawatan romosozumab pada vBMD integral dan trabekular pinggul adalah serupa merentas kajian tetapi berbeza untuk vBMD kortikal.” Memandangkan surat kepada editor Bone yang dilihat oleh beberapa penulis yang sama telah pun menjelaskan dan meramalkan perbezaan ini [7], nampaknya masih wujud salah faham mengenai keupayaan dan had 3D-DXA. Akibatnya, salah faham ini berkemungkinan sekali lagi membawa kepada penilaian yang terlalu optimistik terhadap keberkesanan ubat tersebut.
Kajian-kajian ini seterusnya menyebarkan keputusan yang berpotensi tidak betul dengan membentangkan peta warna perubahan tulang kortikal dan trabekular. 3D-DXA tidak boleh mengukur perubahan setempat atau fokal, sebahagiannya kerana setiap parameter model mempengaruhi taburan ketumpatan secara global, dan juga kerana perubahan ini tidak kelihatan pada imej DXA. Kegagalan untuk mengaplikasikan pembetulan perbandingan berganda dalam kajian-kajian ini seterusnya menjejaskan keputusan, kerana kawasan yang nampaknya signifikan dalam peta sebenarnya adalah jauh kurang signifikan, membawa kepada penilaian yang terlalu optimistik terhadap pelbagai ubat.
Pengurusan Pesakit
Walaupun perisian 3D-Shaper boleh menghasilkan 71 ukuran, versi yang diluluskan secara klinikal hanya menghasilkan vBMD trabekular global dan sBMD kortikal serta T-skor dan Z-skor yang berkaitan. Tidak jelas daripada populasi mana T- dan Z-skor diperoleh, walaupun dalam webinar oleh 3D-Shaper Medical, data rujukan Kaukasia telah dinyatakan [63]. Plot rujukan sebelum ini telah dihasilkan untuk populasi Sepanyol [64] dan Argentina [65], yang kedua-duanya diterbitkan semula dalam Rajah 6. Walau bagaimanapun, plot ini kelihatan berbeza antara satu sama lain dan juga daripada angka yang dihasilkan oleh perisian 3D-Shaper. 3D-Shaper Medical, DMS Imaging dan pengedar mereka tidak mendedahkan populasi ini, atau bagaimana data ini diperoleh. Walau bagaimanapun, ia disahkan oleh Toyo Medic Co., Ltd. (Tokyo, Jepun), pengedar 3D-Shaper di Jepun, bahawa perisian 3D-Shaper yang diluluskan untuk pasaran Jepun tidak menggunakan data rujukan daripada populasi Jepun. Memandangkan perbezaan besar dalam parameter kortikal dan trabekular antara populasi Kaukasia dan Asia [68], penggunaan T- dan Z-skor ini di Jepun nampaknya tidak wajar tanpa pengesahan lanjut. Kesahihannya juga harus disahkan untuk setiap populasi di mana ia digunakan.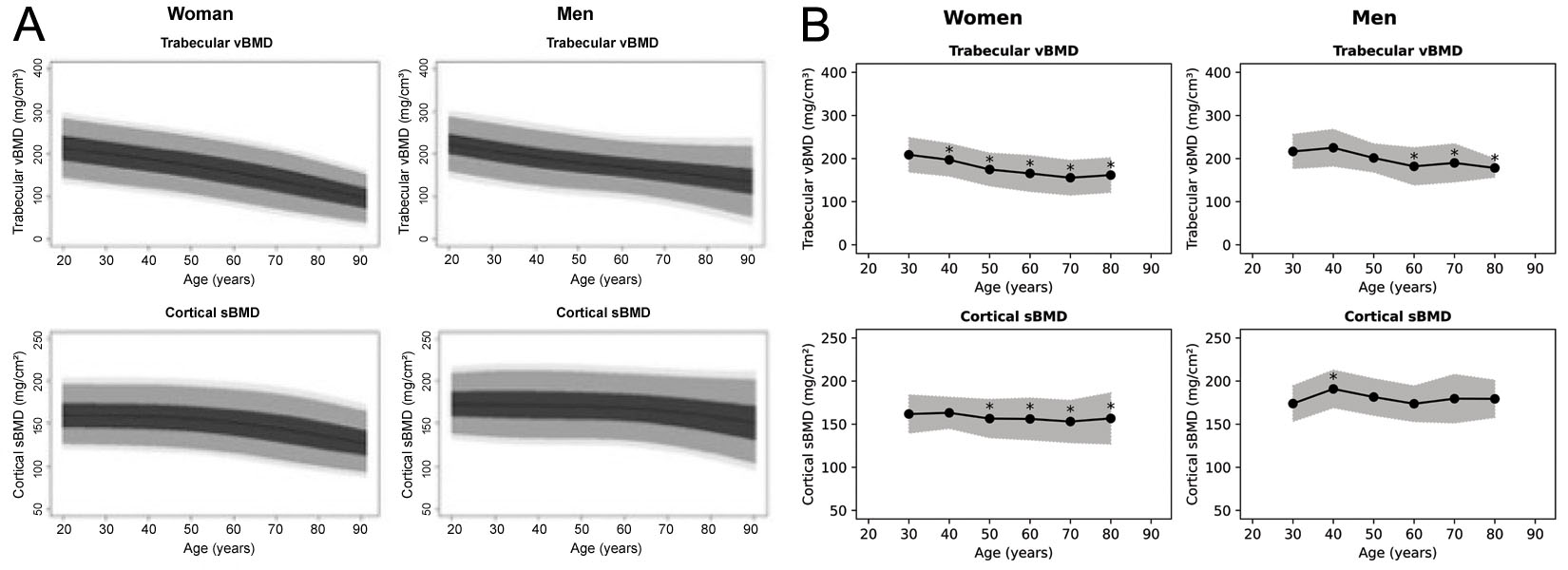
(A)
| 2D DXA (Jumlah pinggul) aBMD | 3D-DXA (3D-Shaper) vBMD Trabekular | 3D-DXA (3D-Shaper) sBMD Kortikal | |
|---|---|---|---|
| Alendronate | + | + | + |
| Denosumab | ++ | ++ | ++ |
| Zoledronic acid | + | + | ++ |
| Teriparatide [15, 52, 55*, 56] | + | ++ | = |
| Abaloparatide | ++ | ++ | ++ |
| Romosozumab | +++ | +++ | +++ |
(B)
| aBMD | vBMD | sBMD | |
|---|---|---|---|
| Teriparatide [52, 56] (18 bulan) | ++ (3.3%) | ++/+++ (9%) | + (1.8%) |
| Teriparatide [15] (24 bulan) | = (p > 0.05) | ++/+++ (5.9%) | = (p > 0.05) |
| Teriparatide [60] (24 bulan) | = (p > 0.05) | ++/+++ (>14%) | = (p > 0.05) |
(C)
| Simbol | (Jumlah pinggul) aBMD | vBMD Trabekular | sBMD Kortikal |
|---|---|---|---|
| +++ | Δ > n/a % | Δ > n/a % | Δ > n/a % |
| ++ | 2 < Δ ≤ n/a % | 4 < Δ ≤ n/a % | 2 < Δ ≤ n/a % |
| + | 0.5 < Δ ≤ 2 % | 0.5 < Δ ≤ 4 % | 0.5 < Δ ≤ 2 % |
| = | -0.5 ≤ Δ ≤ 0.5 % | -0.5 ≤ Δ ≤ 0.5 % | -0.5 ≤ Δ ≤ 0.5 % |
| - | -2 ≤ Δ < -0.5 % | -4 ≤ Δ < -0.5 % | -2 ≤ Δ < -0.5 % |
| -- | Δ < -2 % | Δ < -4 % | Δ < -2 % |
Dalam satu webinar [66] 3D-Shaper Medical mencadangkan potensi penggunaan klinikal di mana 3D-Shaper menghasilkan sBMD kortikal yang rendah dan vBMD trabekular yang sangat rendah. Oleh kerana teriparatide, menurut jadual, meningkatkan tulang trabekular lebih daripada tulang kortikal, teriparatide dikatakan sebagai rawatan terbaik. Walau bagaimanapun, berdasarkan jadual ini, seorang doktor secara semulajadi akan memilih Denosumab atau Abaloparatide berbanding teriparatide jika mengabaikan aBMD tulang belakang.
3D-DXA kemungkinan besar hanya akan digunakan bersama penilaian T-skor dan Z-skor DXA biasa. Oleh itu, bahaya terlepas individu berisiko tinggi adalah minimum. Walau bagaimanapun, disebabkan ralat yang berkaitan dengan 3D-DXA, sBMD kortikal dan vBMD trabekular akan sentiasa sedikit lebih tinggi atau lebih rendah. Pada pesakit yang berada di sempadan rawatan, ini mungkin mempengaruhi doktor untuk memberikan ubat anti-osteoporosis di mana ini tidak akan ditunjukkan oleh aBMD sahaja.
Satu kajian mengenai Trabecular Bone Score (TBS) menunjukkan bahawa penilaian tambahan ini mempengaruhi keputusan rawatan secara signifikan dalam osteoporosis sekunder [67]. Dalam kajian itu, 21–25.5% pesakit dengan ukuran BMD yang tidak khusus mempunyai kualiti tulang yang rendah yang ditunjukkan oleh TBS, yang mengubah keputusan rawatan. Kesan yang sama mungkin berlaku dengan 3D-DXA, yang berpotensi membawa kepada akibat yang tidak diingini seperti preskripsi berlebihan. Jika jadual itu digunakan, ia juga mungkin mempengaruhi doktor untuk memilih satu ubat berbanding yang lain.
Ia juga dinyatakan oleh 3D-Shaper Medical bahawa pesakit boleh dipantau untuk menentukan sama ada rawatan yang dipilih memang mempunyai kesan yang diharapkan pada korteks dan ruang trabekular. Walau bagaimanapun, memandangkan ralat 3D-DXA adalah lebih besar daripada perubahan yang dijangkakan, dan kebolehulangan adalah rendah [36], tidak dapat dipastikan sama ada perubahan yang dilihat dalam penilaian 3D-DXA susulan adalah disebabkan oleh kesan sebenar atau sekadar ralat inheren 3D-DXA. Jika doktor mempercayai keputusan ini, mereka mungkin terpengaruh untuk menukar rawatan secara tidak perlu.
Walaupun versi klinikal 3D-DXA tidak menyediakan maklumat mengenai sBMD kortikal di pelbagai kawasan anatomi, ia memaparkan model 3D berkod warna sBMD merentasi permukaan tulang. 3D-Shaper Medical seterusnya mencadangkan ini boleh digunakan untuk mengesan kerapuhan tempatan [66]. Malangnya, 3D-DXA tidak dapat membina semula peta kortikal khusus pesakit. Saya akan merujuk lagi kepada Rajah 2 untuk penjelasan intuitif bagi perkara ini. Oleh itu, jika peta kortikal 3D-DXA mencadangkan kekurangan tempatan, ini mungkin output model yang munasabah secara statistik, tetapi tidak sepadan dengan anatomi sebenar pesakit. Ini sekali lagi boleh membawa kepada keputusan rawatan yang tidak perlu atau tidak sesuai.
Perisian 3D-Shaper kini juga telah menerima pelepasan FDA melalui proses pemberitahuan pra-pasaran 510(k) [68]. 3D-Shaper Medical memperoleh ini menggunakan kajian korelasi membandingkan luas keratan rentas (CSA), momen inersia keratan rentas (CSMI), modulus keratan (Z), Nisbah Buckling (BR), ketumpatan mineral tulang permukaan kortikal (sBMD), ketumpatan mineral tulang volumetrik trabekular (vBMD) dan vBMD integral dengan ukuran yang serupa daripada perisian Hip Structural Analysis (HSA) oleh Hologic Inc., yang sebelum ini telah menerima pelepasan FDA.
Terutamanya, panjang paksi leher dan sudut syaf leher tetap tidak ada dalam penilaian ini, dan oleh itu penggunaan parameter ini tidak dilepaskan oleh FDA. Perlu diingat bahawa garis panduan International Society for Clinical Densitometry (ISCD) mengesyorkan bahawa parameter HSA tidak boleh digunakan untuk menilai risiko patah tulang pinggul, kecuali panjang paksi pinggul [69]. Selain itu, kelulusan kawal selia ini tidak termasuk T-skor atau Z-skor untuk membandingkan ukuran dengan data rujukan. Ini menimbulkan kebimbangan mengenai kebolehgunaan klinikal 3D-Shaper di Amerika Syarikat.
Akhir sekali, parameter 3D-Shaper dianggap sebahagian besarnya setara dengan pilihan HSA untuk Hologic QDR X-ray Bone Densitometers. FDA tidak dapat mengesahkan sama ada 3D-Shaper boleh digunakan dengan pengimbas DXA lain, meninggalkan persoalan keserasian dengan peranti lain di Amerika Syarikat tidak dapat diselesaikan.
Perbincangan
Secara ringkasnya, 3D-DXA menghasilkan pelbagai parameter tulang yang kelihatan sangat terperinci, tetapi terutamanya mencerminkan keseluruhan BMD kawasan daripada mengukur sifat kortikal atau trabekular yang berbeza. Walaupun perisian mungkin menghasilkan keputusan yang berkorelasi dengan nilai sebenar dalam populasi di mana perubahan kortikal dan trabekular adalah berkadar dengan aBMD, ia kurang berjaya dalam menangkap ukuran khusus pesakit atau perubahan tempatan. Had ini amat ketara dalam senario seperti terapi anabolik, di mana parameter tulang kortikal dan trabekular mungkin berubah secara songsang dan 3D-DXA gagal mencerminkan perubahan sebenar ini yang diperhatikan oleh QCT. Ini menimbulkan kebimbangan ketara untuk penggunaannya dalam penjagaan klinikal rutin atau sebagai alat penyelidikan yang boleh dipercayai.3D-DXA pada asalnya dibangunkan untuk mendiagnosis osteoporosis dengan lebih baik dengan menyediakan anggaran vBMD integral [70, 71]. Dengan tidak cuba menilai secara berasingan ruang kortikal dan trabekular, vBMD integral yang dihasilkan oleh 3D-DXA mungkin masih mewakili anggaran yang sah. Metodologi ini kemudiannya diperluaskan untuk cuba memperbaiki anggaran risiko patah tulang dengan menganalisis parameter model secara langsung, memandangkan parameter ini menerangkan sepenuhnya morfologi model statistik [51, 72, 73, 74]. Walau bagaimanapun, had utama 3D-DXA, seperti yang diperincikan dalam ulasan ini, tetap ada dan menjejaskan ketepatan serta kebolehpercayaannya.
Kajian ini dihadkan oleh kekurangan ketelusan daripada syarikat yang mengkomersialkan 3D-DXA, termasuk 3D-Shaper Medical, DMS Imaging, dan Fujifilm. Akibatnya, ia bergantung pada maklumat yang tersedia secara umum dan pengalaman saya sendiri dalam membangunkan metodologi ini. Saya menggalakkan pembaca untuk mencari penjelasan daripada syarikat-syarikat ini atau wakil mereka mengenai aspek 3D-DXA dan 3D-Shaper yang belum didedahkan.
Penilaian daripada persatuan profesional boleh memberikan panduan berharga dengan menyediakan penilaian bebas terhadap kesahihan 3D-DXA dan menetapkan cadangan rasmi mengenai penggunaannya. Walaupun kemas kini pada garis panduan amalan untuk absorptiometri sinar-X tenaga ganda oleh International Working Group on DXA Best Practices menyatakan mengenai 3D-DXA bahawa "lebih banyak bukti diperlukan untuk membuat cadangan bagi aplikasi teknik pengimejan baharu ini dalam amalan klinikal" [75], saya percaya kini terdapat bukti yang mencukupi untuk mendasarkan cadangan padanya, dan saya berharap ulasan ini akan membantu dalam hal itu. Kesimpulannya, memandangkan had asas 3D-DXA, adalah penilaian profesional saya bahawa parameter kortikal dan trabekular yang disediakan oleh 3D-DXA tidak harus digunakan untuk tujuan penyelidikan, dan juga tidak sesuai untuk aplikasi klinikal seperti diagnosis, pemantauan, atau sokongan keputusan rawatan.
Sumbangan Penulis
TW menyumbang kepada konsep, kurasi data, analisis formal, penyiasatan, metodologi, sumber, visualisasi, dan penulisan manuskrip.Pembiayaan
Tiada pembiayaan diterima untuk kajian ini.Ketersediaan Data
Semua data yang dibentangkan dalam artikel ini boleh didapati daripada pengarang atas permintaan.Konflik Kepentingan
Pengarang adalah pencipta bersama paten yang berkaitan dengan metodologi yang mendasari perisian 3D-DXA. Pengarang tidak bergabung dengan 3D-Shaper Medical atau syarikat lain yang terlibat dalam eksploitasi komersial 3D-DXA.Rujukan
- Whitmarsh T (2012). 3D Reconstruction of the Proximal Femur and Lumbar Vertebrae from Dual-Energy X-Ray Absorptiometry for Osteoporotic Risk Assessment
- Humbert L, Martelli Y, Fonolla R, et al. (2017). 3D-DXA: Assessing the Femoral Shape, the Trabecular Macrostructure and the Cortex in 3D from DXA images. IEEE Transactions on Medical Imaging, 36(1), 27–39.
- Whitmarsh T, Humbert L, De Craene M, et al. (2011). Reconstructing the 3D Shape and Bone Mineral Density Distribution of the Proximal Femur From Dual-Energy X-Ray Absorptiometry. IEEE Transactions on Medical Imaging, 30(12), 2101–2114.
- Ahmad O, Ramamurthi K, Wilson KE, et al. (2010). Volumetric DXA (VXA): A new method to extract 3D information from multiple in vivo DXA images. Journal of Bone and Mineral Research, 25(12), 2744–2751.
- Väänänen SP, Grassi L, Flivik G, et al. (2015). Generation of 3D shape, density, cortical thickness and finite element mesh of proximal femur from a DXA image. Medical Image Analysis, 24(1), 125–134.
- Whitmarsh T, Humbert L, De Craene M, et al. 3D bone mineral density distribution and shape reconstruction of the proximal femur from a single simulated DXA image: an in vitro study. In: Dawant BM, Haynor DR, eds. Medical Imaging 2010: Image Processing. Vol. 7623. SPIE; 2010:76234U.
- Whitmarsh T. Concerns regarding the use of 3D-DXA. Bone. 2021;149:115939.
- Treece G, Gee A (2015). Independent measurement of femoral cortical thickness and cortical bone density using clinical CT. Medical Image Analysis, 20(1), 249–264.
- Freitas L, Amorim T, Humbert L, et al. (2018). Cortical and trabecular bone analysis of professional dancers using 3D-DXA: a case–control study. Journal of Sports Sciences, 37(1), 82–89.
- Gracia-Marco L, García-Fontana B, Ubago-Guisado E, et al. (2019). Analysis of Bone Impairment by 3D DXA Hip Measures in Patients With Primary Hyperparathyroidism: A Pilot Study. The Journal of Clinical Endocrinology \& Metabolism, 105(1), 175–184.
- Orduna G, Humbert L, Fonolla R, et al. (2018). Cortical and Trabecular Bone Analysis of Patients With High Bone Mass From the Barcelona Osteoporosis Cohort Using 3-Dimensional Dual-Energy X-ray Absorptiometry: A Case-Control Study. Journal of Clinical Densitometry, 21(4), 480–484.
- Gifre L, Humbert L, Muxi A, et al. (2017). Analysis of the evolution of cortical and trabecular bone compartments in the proximal femur after spinal cord injury by 3D-DXA. Osteoporosis International, 29(1), 201–209.
- García Hoyos M, Humbert L, Salmón Z, et al. (2019). Analysis of volumetric BMD in people with Down syndrome using DXA-based 3D modeling. Archives of Osteoporosis, 14(1).
- Beck B, Harding A, Weeks B, et al. (2021). Response to “Concerns regarding the use of 3D-DXA”. Bone, 149, 115936.
- Winzenrieth R, Humbert L, Di Gregorio S, Bonel E, García M, Del Rio L. Effects of osteoporosis drug treatments on cortical and trabecular bone in the femur using DXA-based 3D modeling. Osteoporos Int.2018;29(10):2323–2333.
- Cummings SR, Cauley JA, Palermo L, et al. Racial differences in hip axis lengths might explain racial differences in rates of hip fracture. Osteoporos Int.1994;4(4):226–229.
- Kim KM, Brown JK, Kim KJ, et al. Differences in femoral neck geometry associated with age and ethnicity. Osteoporos Int. 2010;22(7):2165–2174.
- Sone T, Humbert L, Lopez M, et al. (2022). Assessment of femoral shape, trabecular and cortical bone in Japanese subjects using DXA-based 3D modelling. JOURNAL OF BONE AND MINERAL RESEARCH, 37, 214--214.
- Varoquaux G, Cheplygina V (2022). Machine learning for medical imaging: methodological failures and recommendations for the future. npj Digital Medicine, 5(1).
- Hadjiiski L, Cha K, Chan H, et al. (2023). AAPM task group report 273: Recommendations on best practices for AI and machine learning for computer‐aided diagnosis in medical imaging. Medical Physics, 50(2).
- Huisman M (2024). When AUC-ROC and accuracy are not accurate: what everyone needs to know about evaluating artificial intelligence in radiology. European Radiology, 34(12), 7892–7894.
- Gallifant J, Bitterman DS, Celi LA, et al. (2024). Ethical debates amidst flawed healthcare artificial intelligence metrics. npj Digital Medicine, 7(1).
- Amani A, Bellver M, del Rio L, et al. (2022). Femur 3D-DXA Assessment in Female Football Players, Swimmers, and Sedentary Controls. International Journal of Sports Medicine, 44(06), 420–426.
- Maïmoun L, Renard E, Humbert L, et al. (2021). Modification of bone mineral density, bone geometry and volumetric BMD in young women with obesity. Bone, 150, 116005.
- Jain RK, López Picazo M, Humbert L, et al. (2025). Bone Structural Parameters as Measured by 3-Dimensional Dual-Energy X-Ray Absorptiometry Are Superior in Black Women and Demonstrate Unique Associations With Prior Fracture Versus White Women. Endocrine Practice, 31(2), 152–158.
- Gracia-Marco L, Gonzalez-Salvatierra S, Garcia-Martin A, et al. (2021). 3D DXA Hip Differences in Patients with Acromegaly or Adult Growth Hormone Deficiency. Journal of Clinical Medicine, 10(4), 657.
- Toussirot E, Winzenrieth R, Aubin F, et al. (2024). Areal bone mineral density, trabecular bone score and 3D-DXA analysis of proximal femur in psoriatic disease. Frontiers in Medicine, 11.
- Ubago-Guisado E, Moratalla-Aranda E, González-Salvatierra S, et al. (2023). Do patients with type 2 diabetes have impaired hip bone microstructure? A study using 3D modeling of hip dual-energy X-ray absorptiometry. Frontiers in Endocrinology, 13.
- Guerra FS, Palladino N, Winzenrieth R, et al. (2024). Advanced 3D-DXA insights into bone density changes in hyperparathyroidism. Journal of Diabetes \& Metabolic Disorders, 23(2), 2191–2199.
- Kužma M, Vaňuga P, Ságová I, et al. Non-invasive DXA derived bone structure assessment of acromegaly patients: a cross sectional study. Eur J Endocrinol. 2019;180(3):201–211.
- Maïmoun L, Aouinti S, Puech M, et al. Modification of bone architecture following sleeve gastrectomy: a five-year follow-up. J Bone Miner Res. 2024;40(2):251–261.
- Maïmoun L, Gelis A, Serrand C, et al. (2023). Alteration of Volumetric Bone Mineral Density Parameters in Men with Spinal Cord Injury. Calcified Tissue International, 113(3), 304–316.
- Harding AT, Weeks BK, Lambert C, et al. (2020). Effects of supervised high-intensity resistance and impact training or machine-based isometric training on regional bone geometry and strength in middle-aged and older men with low bone mass: The LIFTMOR-M semi-randomised controlled trial. Bone, 136, 115362.
- Gil-Cosano JJ, Ubago-Guisado E, Sánchez MJ, et al. (2020). The effect of an online exercise programme on bone health in paediatric cancer survivors (iBoneFIT): study protocol of a multi-centre randomized controlled trial. BMC Public Health, 20(1).
- Humbert L, Whitmarsh T, De Craene M, et al. (2010). 3D reconstruction of both shape and Bone Mineral Density distribution of the femur from DXA images. 2010 IEEE International Symposium on Biomedical Imaging: From Nano to Macro, 456–459.
- O’Rourke D, Beck BR, Harding AT, et al. (2021). Assessment of femoral neck strength and bone mineral density changes following exercise using 3D-DXA images. Journal of Biomechanics, 119, 110315.
- Dudle A, Gugler Y, Pretterklieber M, et al. (2023). 2D-3D reconstruction of the proximal femur from DXA scans: Evaluation of the 3D-Shaper software. Frontiers in Bioengineering and Biotechnology, 11.
- Clotet J, Martelli Y, Di Gregorio S, et al. (2018). Structural Parameters of the Proximal Femur by 3-Dimensional Dual-Energy X-ray Absorptiometry Software: Comparison With Quantitative Computed Tomography. Journal of Clinical Densitometry, 21(4), 550–562.
- Ramamurthi K, Ahmad O, Engelke K, et al. (2011). An in vivo comparison of hip structure analysis (HSA) with measurements obtained by QCT. Osteoporosis International, 23(2), 543–551.
- Whitmarsh T, Treece GM, Gee AH, et al. (2015). Mapping Bone Changes at the Proximal Femoral Cortex of Postmenopausal Women in Response to Alendronate and Teriparatide Alone, Combined or Sequentially. Journal of Bone and Mineral Research, 30(7), 1309–1318.
- Whitmarsh T, Treece GM, Gee AH, et al. (2016). The Effects on the Femoral Cortex of a 24 Month Treatment Compared to an 18 Month Treatment with Teriparatide: A Multi-Trial Retrospective Analysis. PLOS ONE, 11(2), e0147722.
- Huininga K, Koromani F, Zillikens M, et al. (2024). Use of 3D Shaper Analysis for the Assessment of Fracture Risk in a Population-Based Setting. JBMR Plus, 8(Supplement\_1), i1--i340.
- Huininga K, Koromani F, Zillikens MC, et al. (2024). Use of 3D Shaper Analysis for the Assessment of Fracture Risk in a Population-based Setting. ASBMR 2024 Annual Meeting Abstracts and Abstract Book.
- Qasim M, López Picazo M, Ruiz Wills C, et al. (2024). 3D-DXA Based Finite Element Modelling for Femur Strength Prediction: Evaluation Against QCT. Journal of Clinical Densitometry, 27(2), 101471.
- Iki M, Winzenrieth R, Tamaki J, et al. (2021). Predictive ability of novel volumetric and geometric indices derived from dual-energy X-ray absorptiometric images of the proximal femur for hip fracture compared with conventional areal bone mineral density: the Japanese Population-based Osteoporosis (JPOS) Cohort Study. Osteoporosis International, 32(11), 2289–2299.
- Grassi L, Väänänen SP, Ristinmaa M, et al. Prediction of femoral strength using 3D finite element models reconstructed from DXA images: validation against experiments. Biomechanics and Modeling in Mechanobiology, 16(3).
- Grassi L, Fleps I, Sahlstedt H, et al. (). Validation of 3D finite element models from simulated DXA images for biofidelic simulations of sideways fall impact to the hip. Bone, 142.
- Grassi L, Väänänen SP, Jehpsson L, et al. (). 3D Finite Element Models Reconstructed From 2D Dual‐Energy X‐Ray Absorptiometry (DXA) Images Improve Hip Fracture Prediction Compared to Areal BMD in Osteoporotic Fractures in Men (MrOS) Sweden Cohort. Journal of Bone and Mineral Research, 38(9).
- Grassi L, Väänänen SP, Voss A, et al. DXA-based 3D finite element models predict hip fractures better than areal BMD in elderly women. Bone. 2025;195:117457.
- Allison SJ, Poole KES, Treece GM, et al. (2015). The Influence of High-Impact Exercise on Cortical and Trabecular Bone Mineral Content and 3D Distribution Across the Proximal Femur in Older Men: A Randomized Controlled Unilateral Intervention. Journal of Bone and Mineral Research, 30(9), 1709–1716.
- Whitmarsh T, Fritscher KD, Humbert L, et al. (2011). Hip fracture discrimination using 3D reconstructions from Dual-energy X-ray Absorptiometry. 2011 IEEE International Symposium on Biomedical Imaging: From Nano to Macro, 1189–1192.
- Winzenrieth R, Ominsky M, Wang Y, et al. (2021). Differential effects of abaloparatide and teriparatide on hip cortical volumetric BMD by DXA-based 3D modeling. Osteoporosis International, 32(3), 575–583.
- England JR, Cheng PM (2019). Artificial Intelligence for Medical Image Analysis: A Guide for Authors and Reviewers. American Journal of Roentgenology, 212(3), 513–519.
- Lewiecki EM, Betah D, Humbert L, et al. (2024). 3D-modeling from hip DXA shows improved bone structure with romosozumab followed by denosumab or alendronate. Journal of Bone and Mineral Research, 39(4), 473–483.
- Winzenrieth R, Kostenuik P, Boxberger J, et al. (2022). Proximal Femur Responses to Sequential Therapy With Abaloparatide Followed by Alendronate in Postmenopausal Women With Osteoporosis by 3D Modeling of Hip Dual‐Energy X‐Ray Absorptiometry (DXA). JBMR Plus, 6(4).
- Winzenrieth R, Humbert L, Boxberger JI, et al. (2022). Abaloparatide Effects on Cortical Volumetric BMD and Estimated Strength Indices of Hip Subregions by 3D-DXA in Women With Postmenopausal Osteoporosis. Journal of Clinical Densitometry, 25(3), 392–400.
- Bennett C, Miller M, Wolford G (2009). Neural correlates of interspecies perspective taking in the post-mortem Atlantic Salmon: an argument for multiple comparisons correction. NeuroImage, 47, S125.
- Poole KE, Treece GM, Gee AH, et al. (2014). Denosumab Rapidly Increases Cortical Bone in Key Locations of the Femur: A 3D Bone Mapping Study in Women With Osteoporosis. Journal of Bone and Mineral Research, 30(1), 46–54.
- Sato M, Westmore M, Ma YL, et al. (2004). Teriparatide [PTH(1–34)] Strengthens the Proximal Femur of Ovariectomized Nonhuman Primates Despite Increasing Porosity. Journal of Bone and Mineral Research, 19(4), 623–629.
- Hadji P, Kamali L, Thomasius F, et al. (2024). Real-world efficacy of a teriparatide biosimilar (RGB-10) compared with reference teriparatide on bone mineral density, trabecular bone score, and bone parameters assessed using quantitative ultrasound, 3D-SHAPER® and high-resolution peripheral computer tomography in postmenopausal women with osteoporosis and very high fracture risk. Osteoporosis International, 35(12), 2107–2116.
- Sone T, Ohnaru K, Sugai T, et al. (2023). The effects of abaloparatide on hip geometry and biomechanical properties in Japanese osteoporotic patients assessed using DXA-based hip structural analysis: results of the Japanese phase 3 ACTIVE-J trial. Archives of Osteoporosis, 18(1).
- Genant HK, Engelke K, Bolognese MA, et al. (2016). Effects of Romosozumab Compared With Teriparatide on Bone Density and Mass at the Spine and Hip in Postmenopausal Women With Low Bone Mass. Journal of Bone and Mineral Research, 32(1), 181–187.
- MEDICAL 3S (2021). Webinar - Use of 3D-Shaper in clinical research: state of the art and potential applications
- Casado Burgos E, Di Gregorio S, González Macías J, et al. (2019). Datos de referencia de mediciones óseas en modelos 3D de fémur proximal en población española cn DXA: Proyecto SEIOMM 3D-SHAPPER. Congreso SEIOMM (24º : 2019 : Gerona).
- Brance ML, Saravi FD, Henr{\'i}quez MM, et al. (2020). Reference Values of Three-Dimensional Proximal Femur Parameters from Bone Densitometry Images in Healthy Subjects from Argentina. World Congress on Osteoporosis, Osteoarthritis and Musculoskeletal Diseases, 372--372.
- Jennings I (2023). 3D Shaper Technology: Revolutionizing Bone Health Analysis
- Al-Hashimi L, Klotsche J, Ohrndorf S, et al. (2023). Trabecular Bone Score Significantly Influences Treatment Decisions in Secondary Osteoporosis. Journal of Clinical Medicine, 12(12), 4147.
- Food {, Administration} D (2022). 510(k) Summary: K220822
- Broy SB, Cauley JA, Lewiecki ME, et al. (2015). Fracture Risk Prediction by Non-BMD DXA Measures: the 2015 ISCD Official Positions Part 1: Hip Geometry. Journal of Clinical Densitometry, 18(3), 287–308.
- Whitmarsh T, Humbert L, Craene MD, et al. (2009). Reconstrucción de la forma del fémur y densidad mineral ósea en 3D para el diagnóstico de osteoporosis a partir de DXA
- Whitmarsh T, Humbert L, Del Río Barquero LM, et al. (2011). Volumetric Bone Mineral Density Estimation using a 3D Reconstruction Method from Dual-energy X-ray Absorptiometry. ASBMR 2011 Annual Meeting Abstracts and Abstract Book.
- Whitmarsh T, Fritscher KD, Humbert L, et al. (2011). A Statistical Model of Shape and Bone Mineral Density Distribution of the Proximal Femur for Fracture Risk Assessment. Medical Image Computing and Computer-Assisted Intervention – MICCAI 2011, 393–400.
- Whitmarsh T, Fritscher KD, Humbert L, et al. (2012). Hip fracture discrimination from dual-energy X-ray absorptiometry by statistical model registration. Bone, 51(5), 896–901.
- Martelli Y, Whitmarsh T, Humbert L, et al. (2012). A software framework for 3D reconstruction and fracture risk assessment of the proximal femur from dual-energy x-ray absorptiometry. Proceedings of VPH 2012: Virtual Physiological Human - Integrative approaches to computational biomedicine.
- Slart RHJA, Punda M, Ali DS, et al. (2024). Updated practice guideline for dual-energy X-ray absorptiometry (DXA). European Journal of Nuclear Medicine and Molecular Imaging, 52(2), 539–563.