초록
소프트웨어 도구인 3D-Shaper에 구현된 3D-DXA는 통계 모델을 정합하여 단일 2D DXA 영상으로부터 근위 대퇴골의 3D 재구성을 생성하는 소프트웨어 방법입니다. 3D-DXA의 구현은 정량적 컴퓨터 단층촬영(QCT)에서 파생된 것과 유사한 해면골, 피질골 및 구조적 매개변수의 추정치를 제공하는 것을 목표로 합니다. 3D-DXA의 기반이 되는 소프트웨어 방법의 발명자이자 개발자로서, 저는 이 기술의 채택과 광범위한 사용을 점점 더 우려 섞인 시선으로 지켜봐 왔습니다. 이 기사는 3D-DXA에 내재된 방법론적 한계에 대한 비판적 평가를 제공하고 연구 및 환자 진료에 대한 시사점을 논의합니다. 핵심적인 문제는 DXA 영상에서 피질골의 가시성이 제한되어 있어 3D-DXA가 피질골 매개변수를 정확하게 도출하는 것을 방해한다는 점입니다. 대신, 소프트웨어는 직접적인 피질골 측정보다는 전체 골밀도(BMD)를 기반으로 한 예측에 의존합니다. 이는 실제 피질골 측정을 반영하지 않는 결과로 이어질 수 있습니다. 추가적인 우려 사항으로는 통계 모델이 특정 인구 집단에서 파생됨에 따라 발생하는 인구 편향(population bias)과 단일 뷰 DXA 영상을 사용함에 따른 제한된 재구성 정확도가 있습니다. 이러한 한계는 잘못된 측정 및 연구 결과로 이어졌을 가능성이 높으며, 이는 부적절한 성능 평가 지표 사용과 3D-DXA 관련 연구에서의 다중 비교 보정(multiple comparison correction) 부재로 인해 대체로 인식되지 않은 채 남아 있습니다. 이러한 한계에도 불구하고 3D-DXA는 여러 국가에서 규제 승인을 받았으며, 이는 잠재적으로 임상 진단 및 치료 결정의 정확성을 손상시킬 수 있습니다. 이 기사는 이러한 문제를 강조함으로써 임상의, 연구원 및 규제 기관에 3D-DXA의 중대한 한계에 대해 알리는 것을 목표로 합니다. 또한 결과의 오해를 방지하고 환자의 안전을 보장하기 위해 연구 및 임상 환경에서의 사용에 대한 재평가가 시급함을 강조합니다.주요 단어
3D-DXA, 3D-Shaper, 정량적 컴퓨터 단층촬영(QCT), 골밀도(BMD), 이중 에너지 X선 흡수 계측법(DXA), 피질골 매개변수 매핑, 고관절 구조 분석(HSA).일반 요약
이 리뷰는 단일 DXA 영상으로부터 근위 대퇴골의 해면골, 피질골 및 구조적 매개변수를 추정하는 것을 목표로 하는 3D-DXA 소프트웨어(일명 3D-Shaper)를 비판적으로 검토합니다. 3D-DXA에는 부정확한 측정으로 이어질 수 있는 몇 가지 고유한 한계가 있으며, 이는 잠재적으로 연구 결과와 환자 치료 결정에 영향을 미칠 수 있습니다. 이러한 문제를 이해하는 것은 골 생리학, 약물 치료 효과 및 환자 안전에 대한 지식에 영향을 미칠 수 있는 오해를 피하기 위해 연구자와 임상의에게 매우 중요합니다.서론
3D-DXA는 단일 2D DXA 영상에 3D 통계 변형 모델(statistical deformable model)을 정합하여 근위 대퇴골의 3D 모델을 생성하는 소프트웨어 방법입니다 [1]. 이 모델은 평균 연령 56.2 ± 12.1세(30~84세)인 스페인 코카서스 인구 여성 81명과 남성 30명의 정량적 컴퓨터 단층촬영(QCT) 스캔 세트로부터 구축되었습니다 [2]. 통계 모델의 매개변수는 이후 이 인구 집단의 형태 및 밀도 분포의 주요 변화를 설명합니다. 반복적인 과정에서 모델의 매개변수와 위치, 방향 및 크기를 검색하여 모델의 투영 결과가 DXA 이미지와 유사하게 만듭니다 (그림 1). 결과적으로 생성된 3D 모델로부터 뼈 표면 전체의 피질골 매개변수를 측정하고 내부의 해면골 체적 BMD 값을 측정합니다. 3D-DXA를 QCT와 비교했을 때 피질골 두께의 평균 절대 오차는 0.33mm, 피질골 밀도는 72mg/cm³로 보고되었으며, 상관 계수는 0.86 이상이었습니다 [2].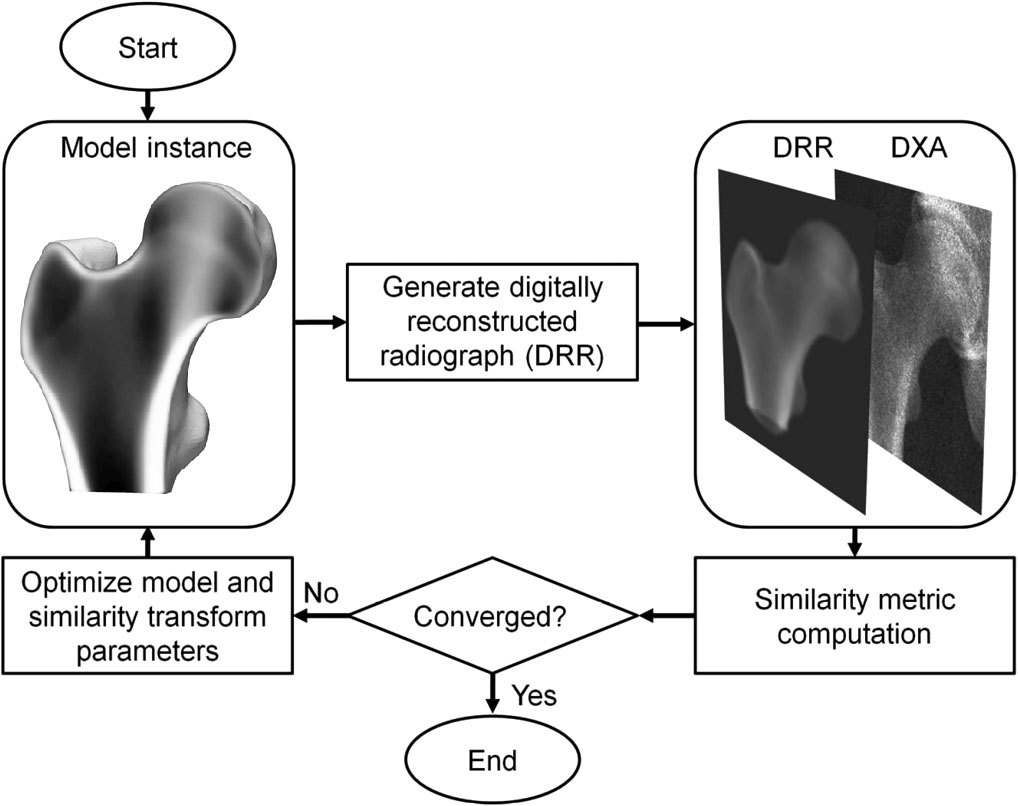
Although other methods have been proposed for the 3D reconstruction of bone structures from DXA images using a statistical model [4, 5], it is the software method first published in 2010 [6] that was later commercialised as 3D-DXA by Galgo Medical SL (Barcelona, Spain), a spin-off company of the Pompeu Fabra University (Barcelona, Spain). This software was later extended to measure the cortical thickness and cortical bone mineral density (BMD) from the volumetric reconstructions [2], which is now commercialised as 3D-Shaper by 3D-Shaper Medical SL (Barcelona, Spain), a further spin-off company of Galgo Medical SL, providing both a service and a software. The software is licensed to DMS Imaging (Mauguio, France) to be sold as 3D-DXA with their Stratos/Medix DXA devices. Fujifilm (Tokyo, Japan) is selling the same DXA devices by DMS under the Fujifilm brand name FDX Visionary DXA. Also Imex Medical (São José, Brazil) sells these devices as the Elipse series and Radiología SA (Madrid, Spain) sells them as Radioscore - DR. These all include the option of adding 3D-DXA.
Having developed the original software method [1], I possess a deep understanding of its inherent limitations that may not be apparent to other users and researchers. Although I have explained the main limitation with this software in a letter to the editor of Bone [7], 3D-DXA continues to be sold and used throughout the world. 3D-Shaper has received approval from regulatory authorities in the EU, Japan, Thailand, Argentina, and a 510(k) clearance from the FDA, authorizing its use for diagnosing and making treatment decisions in patients. Given these endorsements, it is critical and urgent to address and clarify some of the misconceptions about this software, thereby enhancing understanding of its limitations.
방법론적 한계
이 섹션에서는 3D-DXA의 기반이 되는 방법론의 몇 가지 한계와 추가적인 부정확성을 초래할 수 있는 구체적인 구현 세부 사항에 대해 설명하겠습니다.피질골 매개변수는 측정되지 않습니다
주요 문제는 3D-DXA가 피질골 매개변수를 도출하기 위한 DXA 영상에서의 피질골 가시성이 부족하다는 점입니다. 이를 설명하기 위해 Bone지의 편집자에게 보낸 서신의 그림을 다시 살펴보겠습니다 (그림 2). DXA 영상은 뼈 표면의 대부분의 위치에서 피질골 매개변수를 도출할 수 있는 뚜렷한 피질골이 보이지 않음을 분명히 보여줍니다. 이는 뼈 투영의 윤곽(A)에 적용되며, 특히 두 개의 대향하는 피질골이 X선 검출기에 수직인 경우(B)에 더욱 그렇습니다. 이는 픽셀 크기가 0.3 x 0.25mm인 GE iDXA 스캐너의 영상에서 명백하지만, 훨씬 낮은 해상도(픽셀 크기 0.6 x 1.05mm)의 영상을 생성하는 구형 GE Prodigy DXA 장치를 사용한 영상에서 더욱 두드러지며, 이들 역시 3D-Shaper 소프트웨어에서 지원됩니다.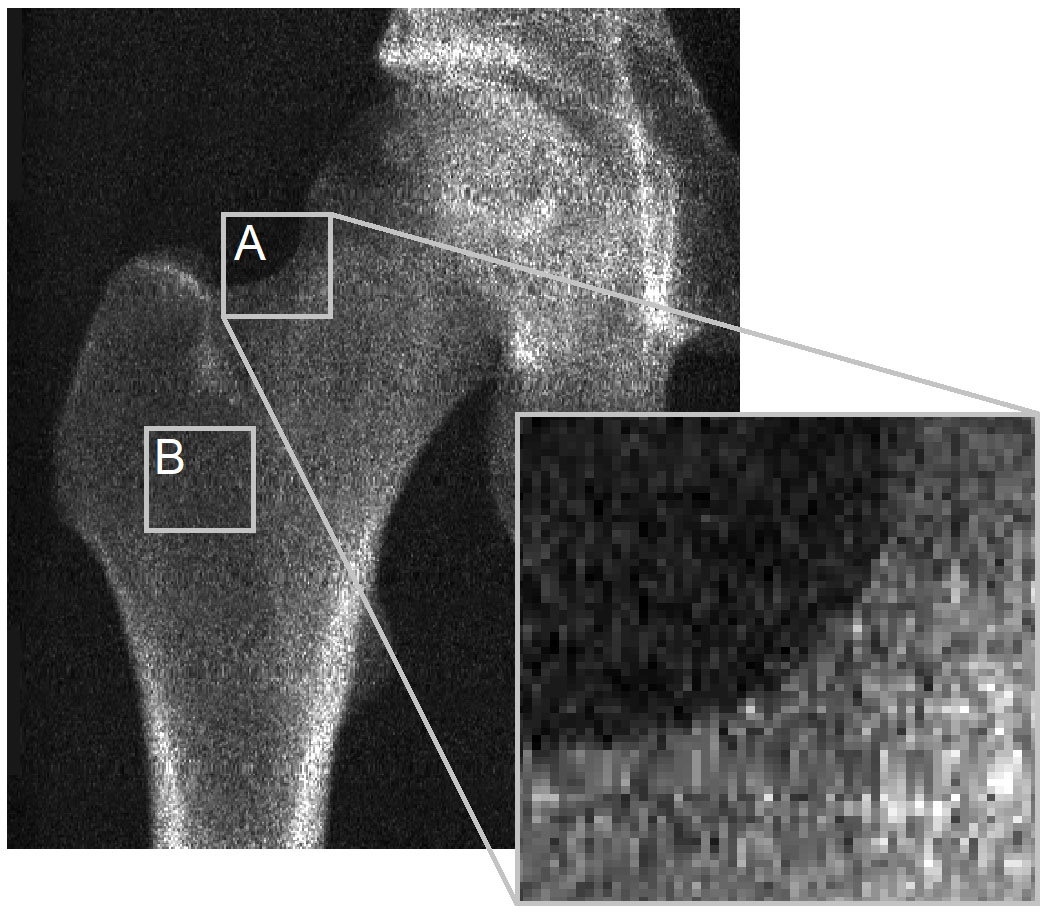
DXA 영상에서 직접 피질골 매개변수를 측정하는 대신, 3D-DXA는 형태 및 밀도 분포의 통계 모델을 DXA 영상에 정합하고 [7], 이 모델로부터 피질골 매개변수를 추출합니다 [2]. 이 모델은 보정된 QCT 스캔 세트로부터 구축되며, 표준 CT 스캔의 복셀(voxel) 하운스필드 단위(Hounsfield unit)는 보정 팬텀(calibration phantom)을 사용하여 BMD 값으로 변환됩니다.
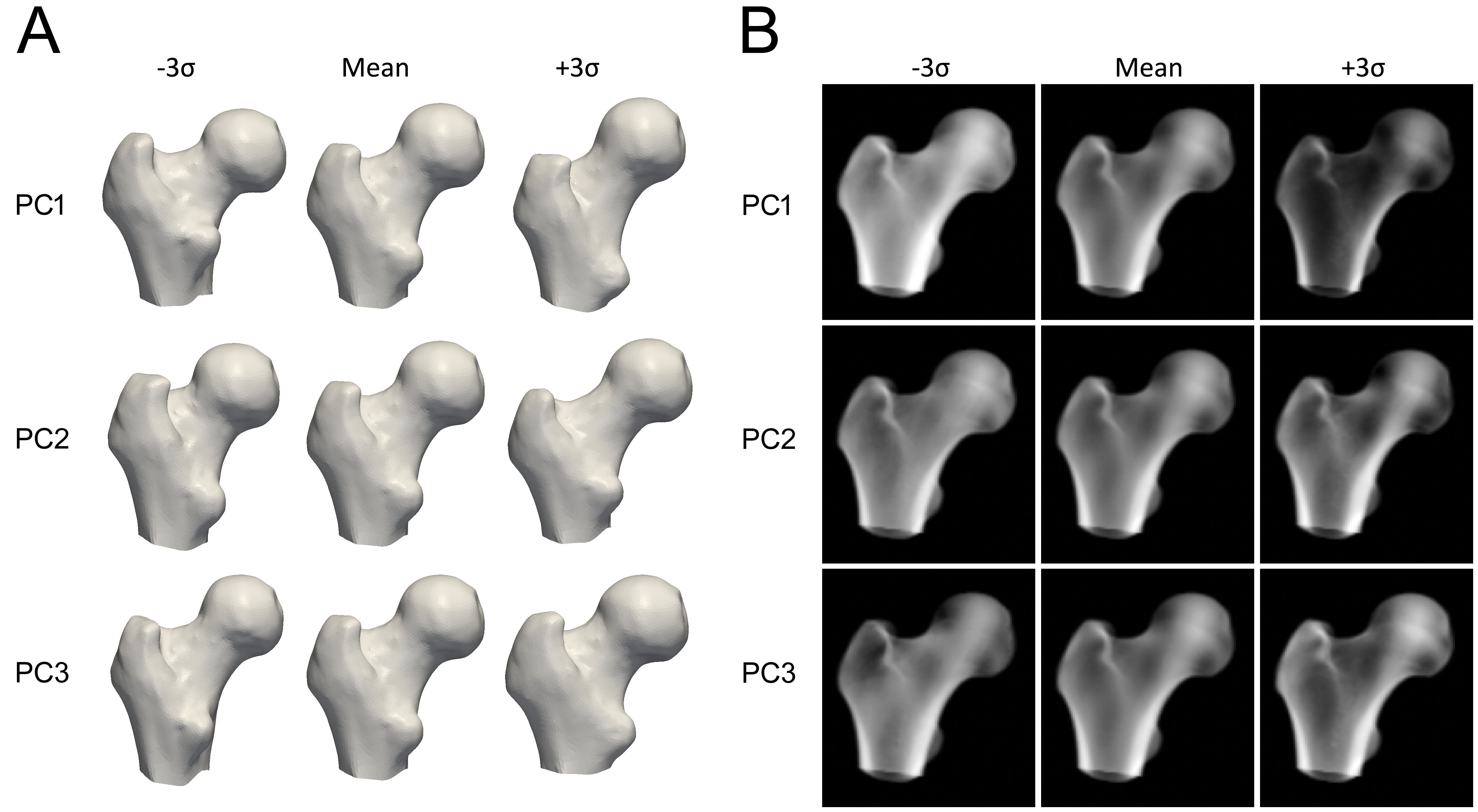
모델을 구축하기 위해 먼저 각 QCT 스캔에서 근위 대퇴골을 분할(segmentation)합니다. 즉, 근위 대퇴골의 표면 메시(surface mesh)가 구축됩니다. 그런 다음 정렬된 대퇴골 표면의 점들에 주성분 분석(Principal Component Analysis)과 같은 수학적 기법을 적용하여 평균 형태와 중요도에 따라 순서가 정해진 형태 변화를 설명하는 일련의 주성분(PC)을 얻습니다.
밀도 분포의 통계 모델을 구축하기 위해 QCT 볼륨을 평균 형태로 변형하고, 볼륨 내의 BMD 값에 동일한 통계적 방법을 적용하여 부피 전체의 골밀도 변화를 설명하는 평균 볼륨과 PC 세트를 생성합니다.
각 주성분은 뼈의 형태나 밀도가 변할 수 있는 방식을 나타냅니다 (그림 3). 모델 매개변수는 평균 모델에 각 주성분이 얼마나 추가되는지를 결정하는 수치적 계수입니다. 이러한 매개변수를 조정하면 형태나 밀도 분포가 수정되어 새로운 모델 인스턴스가 생성됩니다. 매개변수는 일반적으로 변동의 2.5~3 표준 편차로 제한되어 뼈 모델이 항상 구축된 QCT 스캔 세트에 따라 사실적으로 보이도록 보장합니다. 모델의 새로운 인스턴스를 생성하기 위해 형태 점들의 하위 집합으로 계산된 얇은 판 스플라인(TPS) 변환을 사용하여 밀도 볼륨을 새로운 형태에 맞춰 변형합니다.
3D-DXA는 이후 모델 매개변수를 반복적으로 변경하고 그에 해당하는 모델 인스턴스를 생성할 뿐만 아니라 모델을 회전 및 이동시켜 모델의 투영 결과가 미리 정해진 유사성 지표 임계값에 따라 DXA 영상과 일치할 때까지 3D 재구성을 생성합니다 (그림 1).
그런 다음 QCT를 위해 제안된 디콘볼루션(deconvolution) 접근 방식과 동등한 방법을 사용하여 모델 인스턴스로부터 피질골 두께와 피질골 밀도를 측정합니다 [8]. 따라서 피질골 매개변수는 DXA 영상에서 측정되는 것이 아니라 이 영상에 정합된 파라메트릭 모델(parametric model)로부터 측정됩니다.
결과적으로 3D-DXA에서 피질골 매개변수 지도가 제시될 때, 피질골이 측정될 수 없는 위치의 값들 [9, 10, 11, 12, 13]은 단순히 모델 인스턴스에서 도출된 것입니다. 3D-Shaper Medical은 Bone지의 편집자에게 보내는 서신에 대한 답변 [14]에서 이러한 매개변수가 측정된 것이 아니라 추정된 것임을 명시하고 있지만, 더 정확한 설명은 3D-DXA가 복잡하고 잠재적으로 오류가 발생하기 쉬운 통계적 방법을 사용하여 이러한 값을 예측한다는 것입니다. DXA 영상에서 피질골의 가시성이 제한되어 있기 때문에 소프트웨어는 주로 전체 골밀도에 의존하며 모델의 기반이 된 스페인 인구의 통계적 특성에 의해 제약을 받습니다. 이러한 한계의 광범위한 시사점은 리뷰 뒷부분에서 더 자세히 살펴봅니다.
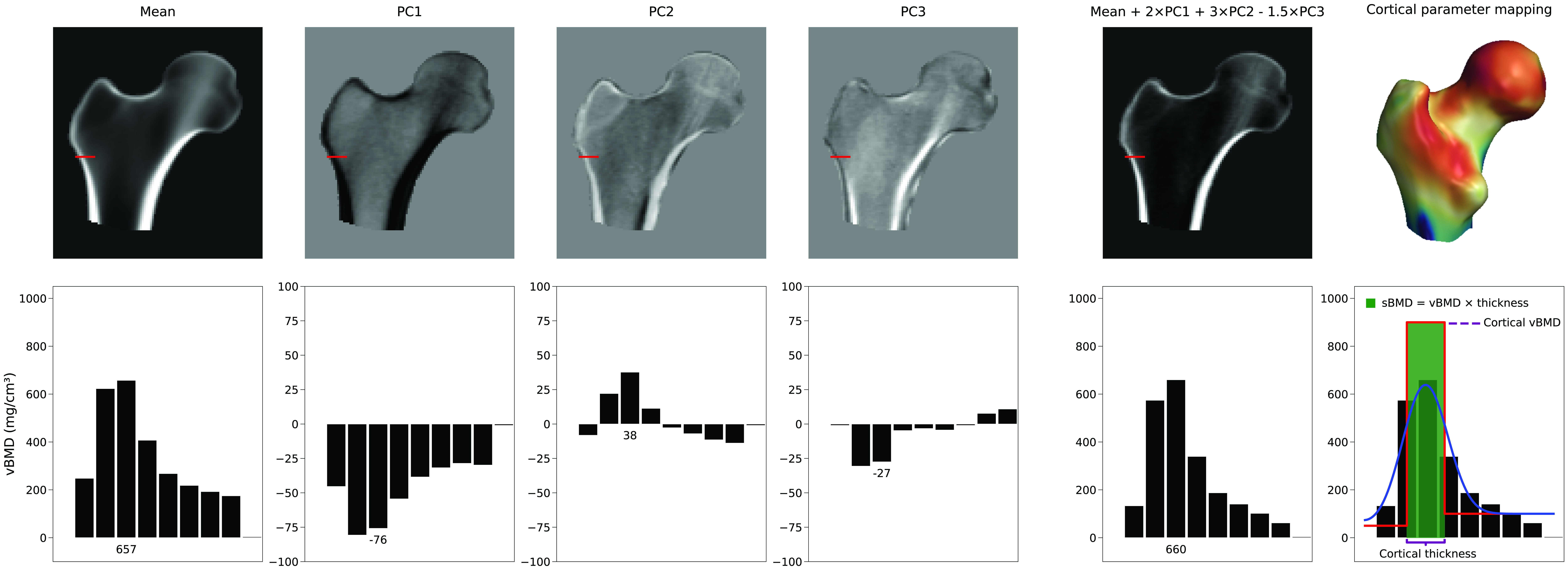
사용된 모델 매개변수의 수
피질골 두께를 증가시키는 단일 매개변수는 없습니다. 대신 피질골의 표현은 평균 3D 볼륨과 밀도 모델의 PC의 선형 조합에 달려 있습니다. 그림 4에서 평균과 처음 세 개의 PC가 어떻게 새로운 모델 인스턴스를 생성하는지에 대한 예시를 볼 수 있습니다. 이 예에서 PC의 가중치 요인인 모델 매개변수는 각각 2, 3, -1.5의 값을 가집니다. PC1은 모든 곳의 밀도를 증가시키거나 감소시키지만, 다른 PC들은 설명하기 어려운 방식으로 밀도 분포를 변경합니다. 이 수치는 또한 부드럽게 처리된 계단형 모델을 피팅하여 이 새로운 볼륨으로부터 피질골 매개변수가 어떻게 추정되는지를 보여줍니다. 피질골 두께, 피질골 밀도 또는 해면골 밀도를 선택적이고 독립적으로 조정하려면 불가능하지는 않더라도 다수의 주성분과 그에 따른 많은 모델 매개변수의 복잡한 조합이 필요합니다.일반적으로 주된 변화 모드를 설명하는 주성분들의 하위 집합이 유지됩니다. 이는 BMD 분포와 표면 점들의 변화를 축소된 매개변수 세트로 줄여줍니다. 얼마나 많은 모델 매개변수가 필요한지는 일반적으로 인구 집단 내 변화의 95%를 설명하는 형태 및 밀도 모델 매개변수의 수를 계산하거나 누적 분산 그래프에서 "엘보우(elbow)" 지점을 결정하여 결정됩니다. 그러나 어떤 PC를 노이즈로 간주하고 폐기할 수 있는지 수학적으로 평가하는 혼의 평행 분석(Horn's parallel analysis) [6]을 사용하는 것이 더 정확합니다.
모델링에 사용되는 매개변수의 수는 통계적 모델링 접근 방식에서 중요한 요소이지만, 제 지식으로는 3D-Shaper Medical에서 이 숫자나 이를 도출하기 위한 방법을 공개한 적이 없습니다. 혼의 평행 분석을 통해 결정된 것처럼 매개변수의 수가 적절하게 크지 않다면 입력 인구 집단의 대퇴골 형태 변화를 전체적으로 정확하게 나타내지 못할 수 있습니다. 또한 연구와 임상 적용 시 이 매개변수의 수가 동일하지 않다면 보고된 정확도와 3D-DXA의 임상적 정확도 사이에 차이가 발생할 것입니다.
Potential population bias
잠재적인 인구 편향
3D-DXA에서 생성된 모든 3D 뼈 모델은 입력 인구 집단의 변화에 대한 통계를 기반으로 합니다. 3D-Shaper의 경우, 통계 모델은 뼈 대사에 영향을 미치는 질환이나 치료를 받지 않은 [15] 평균 연령 56.2 ± 12.1세[30세~84세]의 스페인 인구 여성 81명과 남성 30명을 대상으로 구축되었습니다 [2]. 대퇴골 형태는 남녀 간에 차이가 있음은 분명하지만 인구 통계학적 특성 또한 중요한 역할을 합니다. 예를 들어 코카서스 인구의 대퇴골은 이전 연구 [16]에서 입증된 바와 같이 아시아 인구의 대퇴골과 크게 다릅니다.코카서스 인구를 기반으로 한 모델로는 아시아 인구의 모든 대상자에게 맞는 재구성을 생성할 수 없습니다. 이는 통계 모델의 매개변수가 스페인 인구의 평균 대퇴골 모델을 기준으로 3 표준 편차 이내로 제한되기 때문입니다. 예를 들어, 한 연구에 따르면 백인 여성의 대퇴 경부 피질골 두께는 1.84±0.03mm인 반면, 한국 여성의 경우 QCT 스캔으로 측정했을 때 2.41±0.71mm라고 보고되었습니다 [17]. 결과적으로 평균 피질골 두께가 2.41mm인 한국 여성은 3 표준 편차(1.75~1.93mm)로 제한될 때 백인 인구의 변동 범위를 벗어나게 됩니다. 이 예시는 모델이 대상 인구 집단을 대표하는 것이 얼마나 중요한지 보여줍니다.
일본인 인구 집단에서 3D-DXA에 의한 측정값이 QCT와 상관관계가 있음에도 불구하고 [18], 이는 단지 모든 매개변수가 에어리얼(areal) BMD와 상관관계가 있기 때문입니다. 이것이 환자별 재구성 결과가 얻어졌음을 의미하지는 않습니다. 특히 추정된 피질골 매개변수는 특히 공간적 분포에 있어 실제 값과 크게 다를 수 있습니다. 예측된 대퇴골 형태가 잘못되었더라도, 통계 모델의 투영 결과가 DXA 영상의 뼈와 대체로 겹치는 한 피질골 두께와 피질골 BMD를 포함한 밀도 값은 여전히 aBMD와 유사하게 나타날 것입니다. aBMD가 낮은 사람은 어떤 인구 집단에서든 aBMD가 높은 환자에 비해 vBMD와 피질골 BMD가 낮고 피질골이 얇을 것입니다. 더욱이 [18]은 상관관계만을 보고했을 뿐이며, 스페인 인구에서 개발된 모델을 일본인 인구에 적용할 때 임상적인 결과를 초래할 수 있는 상당한 편향이 있을 수 있습니다. 이러한 근본적인 한계에도 불구하고 3D-DXA는 현재 일본, 태국, 인도 등 아시아 국가에서 마케팅되고 있습니다.
통계 모델은 적용 대상 인구 집단에 따라 훈련되어야 합니다. 이는 가변성의 전체 범위를 포착할 수 있을 만큼 충분한 매개변수가 유지된다는 전제하에 각 성별, 인종 및 잠재적으로 치료 유형별로 별도의 모델을 구축하거나 이러한 모든 하위 그룹을 하나의 모델에 포함시키는 것을 의미할 수 있습니다. 이러한 원칙은 머신 러닝 및 인공 지능 도구에 대해 확립되어 있지만 [19, 20, 21, 22], 모델이 입력 인구 집단에 의해 능동적으로 제약되는 통계적 모델링 접근 방식에서는 훨씬 더 중요합니다. 그럼에도 불구하고 3D-DXA는 다음과 같은 대상 인구와 명백히 다른 인구 집단을 대상으로 한 연구에서 사용되었습니다. 전문 무용수 [9], 축구 선수 및 수영 선수 [23], 비만인 젊은 여성 [24], 흑인 여성 [25], 높은 골량을 가진 환자 [11], 성인 성장 호르몬 결핍증 환자 [26], 건선 질환 환자 [27], 제2형 당뇨병 환자 [28], 일차성 부갑상선 기능 항진증 환자 [10, 29], 말단 비대증 환자 [30], 다운 증후군 환자 [13], 위 소매 절제술 후 환자 [31], 척수 손상을 입은 남성 [32], 낮은 골량을 가진 호주의 중년 및 고령 남성 [33], 그리고 아마도 가장 우려스러운 것은 소아암 생존자들입니다 [34].
Limited reconstruction accuracy
3D-DXA is a highly complex method prone to errors at multiple stages. These include inaccuracies from QCT calibration, deformable registration for building statistical models, deformation of the density model to the shape instance, discrepancies in BMD and resolution between QCT and DXA, and simplification of the model projection by an isometric projection instead of the fan beam projection. Each of these factors can introduce biases in unpredictable ways, potentially skewing the results. In addition, specific implementation details, such as building the statistical model from a very small set of 111 adult Spanish subjects (which limits the variance in shape, density, and cortical thickness), further restrict the applicability of this software tool.Furthermore, it is not clear whether 3D-Shaper can accurately read the proprietary data files from GE and Hologic devices, particularly with respect to correctly applying the calibration and correction factors for varying body compositions. These potential inaccuracies may influence 3D-Shaper results when applied to different populations or as population characteristics drift over time.
It stands to reason that, if the proximal femur shape and orientation is not perfectly matched with the DXA image, within a sub-millimetre accuracy, it should not be possible to extract the cortical thickness within a sub-millimetre accuracy, nor the cortical density. Unfortunately it is not possible to generate a perfect reconstruction from just a single 2D DXA image as an early study with 3D-DXA already showed [35]. Here it was shown that adding a second view reduces the shape error from 1.3mm to 0.9mm, and the BMD error from 4.4% to 3.2%, indicating a clear sub-optimal reconstruction from a single view. In contrast, computed tomography reconstructs a volume using hundreds of projections acquired from all angles around the femur. Thereby QCT does allow for the independent measurement of cortical and trabecular parameters.
3D-DXA can produce femur models with a completely different morphology depending on where the model parameter search converged, in particular if the correct rotation was not recovered. This can vary greatly, as evidenced by a study using 3D-DXA involving same-day repeated DXA scans, which revealed differences in predicted strength of up to 62% [36]. This study also reported element-by-element BMD differences reaching 30 ± 50%, which will likely reflect in a low repeatability accuracy for the cortical parameters as well, although these numbers were not provided. In a separate study, the correlation between 3D-Shaper and QCT density values was also reported to be low (r2 = 0.48) [37], further indicating a limited subject-specific reconstruction accuracy.
In a study on measuring the structural parameters of the femur using 3D-DXA, a correlation coefficient of r = 0.86 was reported for the femoral neck axis length [38] when correlating the measurements derived from the 3D-DXA volume with the ground truth measurements from CT. This is worse than when measured directly in the DXA image (r = 0.90, [39]). Also, the femoral neck shaft angles produced by 3D-DXA are of limited accuracy (r = 0.71, [38]). An obvious reason for the lack of this accuracy is because the femoral head is excluded from the reconstruction process using a mask to prevent the overlap of the hemipelvis from interfering with the reconstruction, although this could be resolved by adding a second model of the hemipelvis such as in [5].
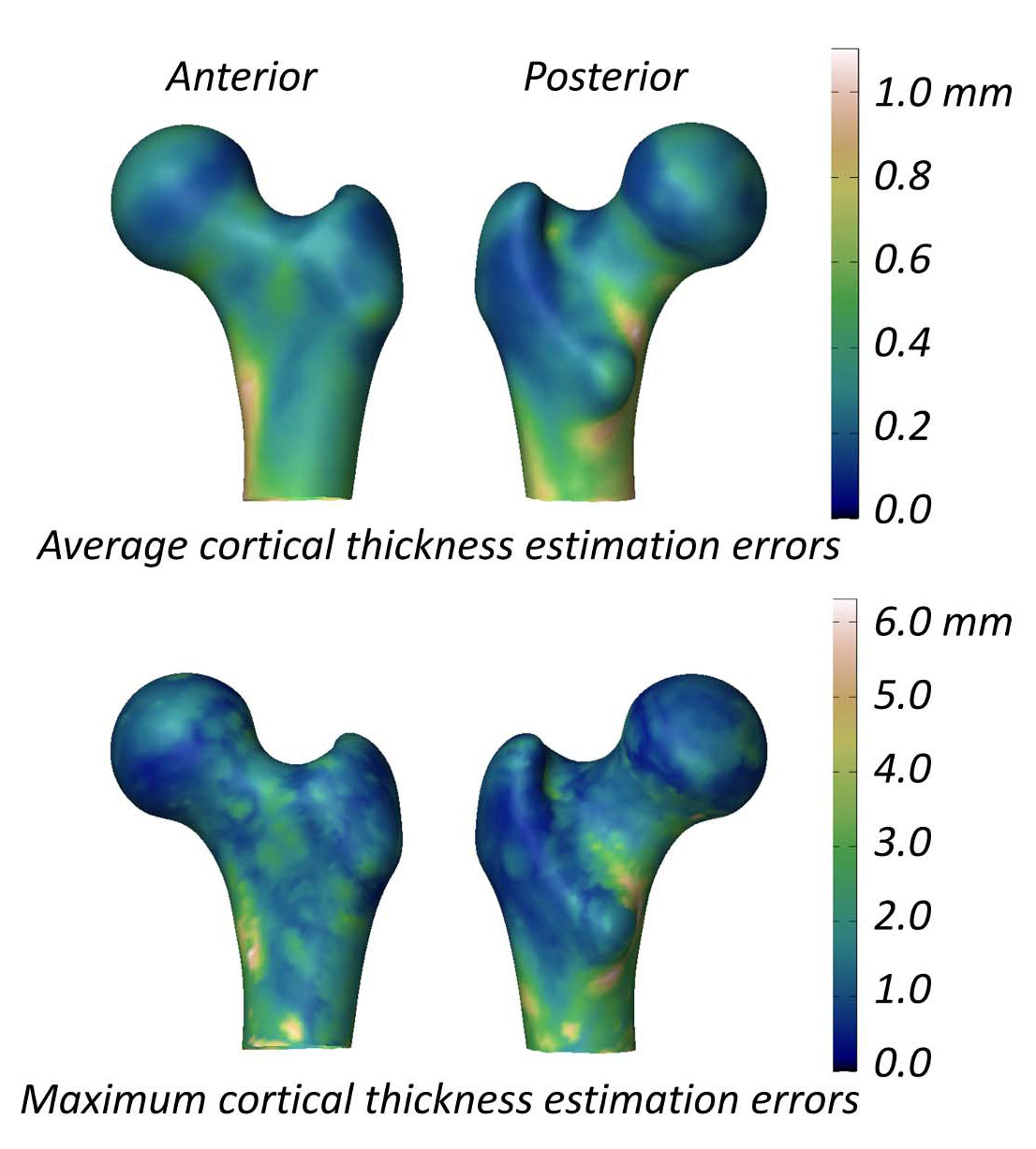
The study evaluating the ability of 3D-DXA to measure the cortical parameters reports a mean (± standard deviation) cortical thickness difference between 3D-DXA and QCT of 0.04 ± 0.21mm at the femoral neck and -0.07 ± 0.15 mm at the trochanter [2]. This study also presented a figure showing the mean and maximum absolute
제한된 재구성 정확도
3D-DXA는 여러 단계에서 오류가 발생하기 쉬운 매우 복잡한 방법입니다. 여기에는 QCT 보정, 통계 모델 구축을 위한 변형 가능한 정합(deformable registration), 형태 인스턴스에 대한 밀도 모델의 변형, QCT와 DXA 간의 BMD 및 해상도 불일치, 팬 빔 투영(fan beam projection) 대신 등각 투영(isometric projection)에 의한 모델 투영의 단순화 등이 포함됩니다. 이러한 각 요인은 예측할 수 없는 방식으로 편향을 유발하여 결과가 왜곡될 잠재력이 있습니다. 또한 111명의 스페인 성인 피험자로 구성된 매우 작은 세트(형태, 밀도 및 피질골 두께의 분산을 제한함)로부터 통계 모델을 구축하는 것과 같은 구체적인 구현 세부 사항은 이 소프트웨어 도구의 적용 가능성을 더욱 제한합니다.또한 3D-Shaper가 GE 및 Hologic 장치의 독점 데이터 파일을 정확하게 읽을 수 있는지, 특히 다양한 신체 구성에 대한 보정 및 수정 계수를 올바르게 적용하는지 여부도 명확하지 않습니다. 이러한 잠재적 부정확성은 다른 인구 집단에 적용되거나 시간이 지남에 따라 인구 특성이 변화할 때 3D-Shaper 결과에 영향을 줄 수 있습니다.
근위 대퇴골 형태와 방향이 DXA 영상과 1밀리미터 미만의 정밀도로 완벽하게 일치하지 않는다면 피질골 두께나 피질골 밀도를 그 정도의 정밀도로 추출하는 것은 불가능합니다. 불행하게도 3D-DXA를 사용한 초기 연구 [35]에서 이미 보여주었듯이 단일 2D DXA 영상만으로는 완벽한 재구성을 생성하는 것이 불가능합니다. 여기서는 두 번째 뷰를 추가하면 형태 오차는 1.3mm에서 0.9mm로, BMD 오차는 4.4%에서 3.2%로 감소한다는 것을 보여주었는데, 이는 단일 뷰로부터의 재구성이 차선책임을 분명히 나타냅니다. 반면 컴퓨터 단층촬영은 대퇴골 주변의 모든 각도에서 획득한 수백 개의 투영 영상을 사용하여 볼륨을 재구성합니다. 따라서 QCT는 피질골과 해면골 매개변수를 독립적으로 측정할 수 있게 해줍니다.
3D-DXA는 모델 매개변수 검색이 수렴된 위치에 따라, 특히 올바른 회전이 복원되지 않은 경우 완전히 다른 형태의 대퇴골 모델을 생성할 수 있습니다. 이는 같은 날 반복된 DXA 스캔을 사용하여 3D-DXA를 적용한 연구 [36]에서 입증되었는데, 예측된 강도에서 최대 62%의 차이가 나타났습니다. 이 연구는 또한 요소별 BMD 차이가 30 ± 50%에 이른다고 보고했는데, 이는 비록 수치는 제공되지 않았지만 피질골 매개변수에 대해서도 낮은 재현성 정확도를 반영할 가능성이 높습니다. 별도의 연구에서 3D-Shaper와 QCT 밀도 값 사이의 상관관계 또한 낮은 것(r2 = 0.48)으로 보고되어 [37], 피험자별 재구성 정확도가 제한적임을 더욱 시사합니다.
3D-DXA를 사용한 대퇴골 구조 매개변수 측정 연구에서 3D-DXA 볼륨에서 파생된 측정값과 CT의 실측값(ground truth)을 상관시킨 결과, 대퇴 경부 축 길이(femoral neck axis length)에 대해 r = 0.86의 상관 계수가 보고되었습니다 [38]. 이는 DXA 영상에서 직접 측정했을 때(r = 0.90, [39])보다 나쁜 결과입니다. 또한 3D-DXA가 생성한 대퇴 경부 샤프트 각도(femoral neck shaft angles)는 정확도가 제한적입니다(r = 0.71, [38]). 이러한 정확도 부족의 명백한 이유는 반골반(hemipelvis)과의 중첩이 재구성을 방해하는 것을 막기 위해 마스크를 사용하여 재구성 과정에서 대퇴골두를 제외하기 때문입니다. 비록 이는 [5]에서와 같이 반골반의 두 번째 모델을 추가함으로써 해결될 수 있지만 말입니다.
피질골 매개변수 측정 능력을 평가한 연구에 따르면 3D-DXA와 QCT 간의 평균(± 표준 편차) 피질골 두께 차이는 대퇴 경부에서 0.04 ± 0.21 mm, 전자부(trochanter)에서 -0.07 ± 0.15 mm로 보고되었습니다 [2]. 이 연구는 또한 대퇴골 모델 표면 전체에 걸친 피질골 두께 추정 오차의 평균 및 최대 절대값을 보여주는 그림(그림 5)을 제시했는데, 대퇴골 표면의 많은 부분에서 평균 오차는 0.2mm 이상, 최대 오차는 1mm 이상이었습니다. 이에 비해 18개월간의 알렌드로네이트(alendronate) 치료 후 피질골 두께 변화를 측정한 QCT 연구에서는 1.4% 증가를 보고했는데, 이는 피질골 두께가 약 0.018mm 증가한 것에 해당합니다 [40]. 테리파라타이드(teriparatide)에 대한 세 가지 임상 시험 데이터를 종합한 결과, 피질골 두께는 0.035mm 증가한 것으로 나타났습니다 [41]. 3D-DXA의 오차가 이러한 일반적인 치료 유도 변화를 초과한다는 점을 고려할 때, 3D-DXA 측정값이 실제 치료 효과와 방법론적 노이즈를 신뢰성 있게 구별할 가능성은 낮습니다. 다시 말해, 개인의 피질골이 변하는 것처럼 보이더라도 이것이 진정한 생리학적 변화인지 아니면 3D-DXA 고유의 측정 오차 때문인지 불분명합니다.
에어리얼(areal) BMD 대비 제한된 이점
3D-DXA가 사용하는 통계 밀도 모델에서 첫 번째 모델 매개변수는 대부분의 변화를 설명하며, 그 값을 높이면 전체 밀도와 모든 피질골 매개변수가 모두 증가합니다 [7]. DXA 영상에서 피질골에 대한 정보가 거의 없다는 점을 고려할 때, 3D-DXA는 주로 전체 밀도, 즉 첫 번째 모델 매개변수에 의존합니다. 결과적으로 피질골과 해면골 매개변수는 본질적으로 상관관계가 있습니다. DXA 영상에 보이는 골간부(shaft)의 하부 내측 및 외측 피질골의 영향이 일부 있을 수 있지만, 3D-DXA가 반환하는 매개변수는 주로 전체 에어리얼 BMD(aBMD)를 반영합니다. 즉, aBMD가 증가하면 3D-DXA 분석에서는 해면골 BMD, 피질골 BMD 및 피질골 두께가 동시에 증가하는 것으로 나타납니다. 실제로 2024년 유럽 석회화 조직 학회(European Calcified Tissue Society) 학술대회 [42]와 2024년 미국 골대사 학회(American Society for Bone and Mineral Research) 연례 회의 [43]에서 발표된 최근 연구에 따르면 3D-Shaper 매개변수는 aBMD와 높은 상관관계를 보이며 추가적인 골절 예측 정보를 제공하지 않음을 확인해 줍니다.또한 3D-DXA 재구성이 DXA 영상에 보이는 전체적인 대퇴골 실루엣을 포착하기는 하지만, 경부 축 길이와 경부 샤프트 각도를 복원하는 능력은 제한적입니다. 결과적으로 재구성된 형태는 주로 일반적인 뼈 크기를 반영하는데, 이는 이미 aBMD에 의해 제공되며 골절 강도 예측에 큰 도움이 되지 않습니다. 이를 잘 보여주는 결과로 3D-DXA의 강도 예측이 QCT와 상관관계(r2 = 0.88)를 보였지만, DXA 영상의 대퇴 경부 aBMD로만 예측했을 때(r2 = 0.87)보다 통계적으로 우수하지 않았다는 점이 있습니다 [37]. 3D-Shaper Medical의 연구에서도 유사한 상관관계(r2=0.86)를 보였으나 aBMD와의 비교는 제외되었습니다 [44]. 일본인 인구 대상의 다른 연구에서도 3D-Shaper의 측정값은 고관절 골절을 예측하는 데 있어 전체 고관절 aBMD보다 통계적으로 우수하지 않았습니다 [45].
2D DXA 영상에 3D 통계 모델을 정합하고 대퇴골 강도를 예측하는 유사한 방법에 관한 다른 논문들도 발표되었는데 [46, 47], 한 연구에서는 골절 위험 예측에서 aBMD보다 개선된 결과를 보여주었습니다 [48]. 이 방법은 근위 대퇴골 형태 전체를 복원하는 데 도움이 되도록 추가적인 골반 모델을 사용하는 것과 같이 3D-DXA에 비해 몇 가지 장점을 제공할 수 있습니다. 그럼에도 불구하고 여전히 많은 동일한 방법론적 한계가 있습니다.
3D-DXA가 aBMD 단독보다 우수한 성능을 내지 못한다면, DXA 영상에서 직접 측정되는 aBMD와 HSA 매개변수의 조합을 결코 능가할 수 없습니다. 이는 3D-DXA의 근본적인 한계를 강조하며 임상 또는 연구 환경에서의 사용 정당성에 의문을 제기합니다. 그럼에도 불구하고 3D-Shaper Medical은 현재 3D-DXA 기반의 유한 요소 분석(finite element analysis) 서비스를 제공하고 있습니다.
검증 방법
3D-DXA의 고유한 한계에도 불구하고 많은 논문들이 그 정확성에 대해 긍정적인 결과를 보고하고 있습니다. 이러한 불일치는 소프트웨어의 진정한 한계를 가리는 경향이 있는 부적절한 검증 방법 [21, 22] 때문일 수 있습니다. 다음 섹션에서는 이러한 검증의 문제점과 그것이 어떻게 3D-DXA의 신뢰성과 임상적 유용성에 대한 인식을 형성하는지 논의하겠습니다.잘못된 성능 평가 지표
3D-Shaper Medical은 DXA 영상으로부터 3D-DXA에 의해 생성된 표면 메시와 동일 피험자의 QCT 스캔에서 수동으로 생성된 표면 메시를 비교하여 0.93 mm의 평균 점-대-표면 거리(point-to-surface distance)를 얻었습니다 [2]. 또한 피질골 매개변수를 비교하여 피질골 두께의 평균 절대 오차가 0.33mm, 피질골 밀도는 72mg/cm³임을 발견했습니다. 그러나 이러한 보고된 오류가 허용 가능한 수준인지 판단할 기준이 없으며, 이는 이러한 지표들이 반드시 소프트웨어의 효과를 검증하는 것은 아님을 의미합니다.3D-DXA를 평가하는 또 다른 방법은 상관관계를 이용하는 것이었습니다. 해면골, 피질골 및 통합 vBMD, 그리고 피질골 두께에 대해 각각 0.86, 0.93, 0.95 및 0.91의 상관 계수가 보고되었습니다. 그러나 이러한 강력한 상관관계는 주로 3D-DXA 모델과 QCT 스캔의 모든 피질골 매개변수가 전체 밀도와 강하게 상관하기 때문입니다. DXA 스캔에서 평균보다 높은 aBMD를 가진 환자는 평균적으로 해면골, 피질골 및 통합 vBMD가 증가하고 피질골이 더 두껍게 나타납니다. 이러한 상관관계 결과는 소프트웨어가 피험자별 재구성 결과를 생성하는 데 있어 정확하다는 결정적인 증거를 제공하지 못하며, 사실 성능에 대한 오해를 불러일으킬 수 있습니다.
상관관계는 3D-DXA를 사용한 인구 기반 연구를 평가하는 데에도 사용됩니다. 3D-DXA 분석에서 매개변수와 테스트된 인자 사이 또는 서로 다른 인구 집단 간에 유의미한 상관관계가 나타날 때 유사한 효과를 볼 수 있습니다. 이는 다시 이러한 매개변수가 본질적으로 전체 BMD와 상관관계가 있어 aBMD의 변화나 차이를 직접적으로 반영하기 때문입니다. 연구 결과는 이치에 맞는 것처럼 보일 수 있으며 실제 변화를 밀접하게 반영할 수 있습니다. 예를 들어, 운동은 전체 밀도와 피질골 광물 함량을 모두 증가시키므로 [49], 운동으로 인해 aBMD가 증가할 때 3D-DXA 분석에서 이치에 맞는 결과가 나올 수 있습니다. 그러나 이는 실제 피질골 매개변수 자체를 반영하는 것이 아니라 그 이면에 있는 aBMD의 변화나 차이를 반영할 뿐입니다. 결과적으로 이러한 연구들은 3D-DXA의 효과에 대한 오해를 불러일으키고 피질골 매개변수를 정확하게 측정할 수 있다는 잘못된 인식을 심어줄 수 있습니다.
더 적절한 평가는 피질골 매개변수를 블라인드 추정기(blind estimator)와 같은 기본 베이스라인 모델과 비교하는 것입니다. 여기서 블라인드 추정기란 개인의 가변성을 고려하지 않고 대신 전체 인구의 평균값을 모든 대상자에게 적용하는 단순하고 미숙한 추정 방법을 말합니다. 예를 들어 피질골 두께에 대한 블라인드 추정기는 한 그룹의 개인들로부터 얻은 평균 피질골 두께 지도를 사용하고, 특정 특성에 관계없이 모든 사례에 이를 일률적으로 적용합니다. 이 접근 방식은 더 발전된 방법들을 평가해야 할 베이스라인 또는 최소 기준으로 작용합니다. 모든 정교한 방법은 적어도 이 기본적인 추정보다는 성능이 우수해야 합니다. 제가 아는 한 그러한 평가는 아직 발표된 적이 없습니다.
3D-DXA 소프트웨어에 관한 대부분의 간행물은 성공적인 재구성 사례만을 보여주며, 이는 소프트웨어의 신뢰성에 대한 잘못된 확신을 줄 수 있습니다. 3D-DXA의 신뢰성을 정량적으로 평가하기 위해 실패율에 대한 평가를 수행할 수 있습니다. 이전 연구 [51]에서는 명시적으로 언급되지는 않았지만, 모델 투영 결과와 DXA 영상을 비교하여 부정확한 것으로 판명된 재구성 결과를 제외한 후 173명의 피험자 중 80명만이 유지되어 50%가 넘는 실패율을 보였습니다. 이러한 평가를 가능하게 하려면 3D-Shaper가 모델 투영 결과와 DXA 영상을 나란히 표시해 주어야 합니다. 그러나 더 확실한 평가는 결과 볼륨의 렌더링 및 단면 뷰를 실측 데이터인 QCT 스캔과 비교하고 독립적인 평가를 통해 실패율을 산정하는 것입니다.
어떤 경우에는 단순히 유의미한 변화나 차이를 관찰하는 것이 3D-DXA가 작동한다는 증거로 제시되기도 하며, 실제 효과가 정확한지 여부는 무시됩니다. 제 편집자 서신에 대한 답변에서 치료 그룹 간의 유의미한 차이가 3D-DXA 효과의 증거로 제시되었습니다. 그러나 이 평가에서 저자들은 TPTD 치료 후 피질골 BMD 변화에 대해 두 가지 서로 다른 결과, 즉 하나는 유의미한 증가 [52]를, 다른 하나는 유의미하지 않은 감소 [15]를 보여주는 결과를 제공했습니다. "약물 효능 연구에서의 오해의 소지가 있는 결과" 섹션에서 설명하듯이 그 어느 것도 TPTD 치료에서 기대할 수 있는 실제 변화를 반영하지 않습니다.
다중 비교 보정의 부재
이 섹션에서의 우려는 주로 3D-DXA 소프트웨어 자체보다는 3D-Shaper Medical에서 제공하는 서비스와 그에 따른 간행물에 관한 것입니다. 결정적인 문제는 3D-DXA 매개변수, 특히 피질골 매개변수 지도에서 변화나 차이를 보고할 때 다중 비교 보정(multiple comparison corrections)이 부족하다는 점입니다.다중 비교 보정을 적용하는 것은 여러 개의 별도 측정값을 가진 데이터를 분석할 때 매우 중요합니다. 3D-Shaper의 경우 소프트웨어는 71개의 뼈 매개변수를 생성하며 각 매개변수는 별도의 통계 테스트를 나타냅니다. 본페로니 보정(Bonferroni correction)과 같이 이러한 다중 비교를 조정하지 않으면 우연히 유의미한 결과를 얻을 가능성이 높아져 잘못된 결론에 도달하게 됩니다. 그럼에도 불구하고 3D-Shaper를 사용한 연구들은 어떠한 형태의 다중 비교 보정도 적용하지 않은 채 유의미한 변화나 차이를 보고하는 경우가 많아 [10, 24, 27, 28], 결과에 대한 보장되지 않은 확신을 심어줍니다. 이는 특정 매개변수는 측정되지만 보고되지 않는 경우, 즉 수많은 테스트가 수행됨에 따라 발생하는 허위 양성(false positive)의 위험 증가를 무시한 채 유의미한 결과만을 강조하는 p-해킹(p-hacking) 편향 [53]의 형태일 때 오해를 불러일으킬 수 있습니다.
3D-Shaper를 사용한 연구에서 뼈 표면의 피질골 매개변수나 볼륨 내 BMD 값의 변화나 차이를 보여주는 색상 코딩 지도를 제시할 때도 유사한 문제가 발생합니다. 이러한 경우 각 정점(vertex)이나 복셀은 개별 통계 테스트를 나타내며, 유의성은 각 지점에서의 간단한 t-테스트로 결정되는 경우가 많습니다 [9, 10, 11, 12, 13, 28, 52, 54, 55]. 이 접근 방식은 색상 코딩 지도에서 유의미해 보이는 영역을 강조하여 국소적인 변화나 차이가 없는 곳에 있는 것처럼 착각을 불러일으킵니다. 색상 코딩된 단면 뷰를 통해 볼륨 내 변화나 차이를 제시할 때 복셀 수준에서의 통계적 유의성은 일반적으로 전혀 제공되지 않습니다 [9, 11, 30, 52, 54, 55, 56]. 이는 실제 변화가 실제로는 단순한 무작위 변동의 결과임에도 불구하고 실제 변화를 시사하는 것과 같습니다. 결과적으로 이러한 색상 코딩 지도들은 치료나 개입의 영향에 대해 지나치게 낙관적인 인상을 줄 수 있으며, 실제로는 효능이 없는 곳에서도 효능이 있는 것처럼 잘못 암시할 수 있습니다.
부적절한 다중 비교 보정으로 인한 허위 양성 문제는 신경 영상(neuroimaging) 분야에서 지속적인 과제였습니다 [57]. 이를 해결하기 위해 신경 영상 커뮤니티에서는 뼈 표면의 피질골 변화와 QCT 스캔 복셀의 밀도 변화를 조사하는 연구에도 적용할 수 있는 솔루션을 개발했습니다. Poole 등 [58]은 다중 비교 보정을 위해 랜덤 필드 이론(random field theory)을 적용하여 뼈 표면의 각 지점에서 피질골 매개변수의 차이가 통계적으로 유의미한지 테스트하는 데 SurfStat(http://math.mccgill.ca/keith/surfstat/)을 어떻게 사용할 수 있는지 설명합니다. 복셀 기반 분석을 위한 유사한 패키지로는 Statistical Parametric Mapping 라이브러리(https://www.fil.ion.ucl.ac.uk/spm/)와 FMRIB Software Library(https://fsl.fmrib.ox.ac.uk)가 있습니다. 이러한 도구를 사용하면 3D-DXA를 사용한 연구의 통계적 엄격성을 높일 수 있지만, 관찰된 변화나 차이는 여전히 모든 매개변수와 aBMD의 상관관계를 주로 반영할 것입니다.
시사점
3D-DXA의 사용은 연구와 임상 실무 모두에서 광범위한 시사점을 갖습니다. 다음 섹션에서는 이러한 과제들에 대해 자세히 알아보겠습니다.약물 효능 연구에서의 오해의 소지가 있는 결과
대부분의 연구에서 3D-DXA의 결과는 건강한 개인의 피질골 매개변수가 일반적으로 aBMD와 상관관계가 있기 때문에 기대되는 것과 일치합니다. 이는 종종 이치에 맞는 것처럼 보이는 결과로 이어집니다. 그러나 이러한 접근 방식은 변화가 전통적인 패턴을 따르지 않을 때 결함이 드러납니다. 이 방법은 정상적인 골 모델링 및 리모델링이 변경되고 모든 매개변수에서 통상적인 비례적인 증가나 감소가 발생하지 않을 수 있는 약물 시험에서 특히 문제가 됩니다.An illustrative example is a study on teriparatide, where 3D-DXA indicated an increase in all cortical parameters, including a significant increase in cortical vBMD compared to placebo [52]. In contrast, using an equivalent cortical measurement technique applied to QCT, cortical BMD was shown to significantly decrease following the same 18-month teriparatide treatment, which was seen consistently in data from three different clinical trials [41]. This decrease is attributed to an increased rate of remodeling, which results in greater cortical porosity, as also observed using micro-CT [59].
In an earlier study, 3D-Shaper Medical did report a decrease in cortical BMD in response to teriparatide [15]. Although this was noted by the authors as a decrease, the change was not statistically significant. A more recent independent study also found no significant changes in cortical BMD in response to teriparatide treatment using a 3D-DXA analysis [60]. It may be possible that there is some influence from the cortex of the shaft, which is partly visible in the DXA image. Due to the nature of 3D-DXA, an aBMD decrease in this region, might have been projected across the entire femur model, including areas where no cortex is visible, since the model parameters influence the density distribution globally. However, this did not lead to the correct significant decrease in cortical BMD observed in QCT studies.
테리파라타이드(TPTD)에서 모든 피질골 매개변수의 증가를 보고한 연구는 아발로파라타이드(abaloparatide)도 병행하여 평가하였으며, 후자에서 모든 매개변수의 증가가 더 크게 나타났습니다 [52]. 3D-DXA 분석을 사용한 후속 연구에서도 아발로파라타이드 치료 후 피질골 BMD가 유의하게 증가했다고 보고했습니다 [55, 56]. 아발로파라타이드가 TPTD와 유사하게 뼈 리모델링 속도를 증가시키는 작용 기전을 공유한다는 점을 고려할 때, 아발로파라타이드 역시 피질골 BMD의 감소를 초래할 것으로 기대하는 것이 타당합니다. 실제로 QCT를 사용한 연구에서는 35명의 환자를 대상으로 한 유사한 기간의 아발로파라타이드 치료 후 피질골 BMD의 감소가 관찰되었습니다 [61]. 비록 그 감소가 통계적으로 유의하지는 않았지만 말입니다. 이는 3D-DXA 연구가 부정확한 변화를 생성했을 뿐만 아니라 아발로파라타이드의 효과에 대해 지나치게 호의적인 평가를 내렸을 가능성이 높음을 시사합니다.
Lewiecki 등의 연구 [54]는 일치하지 않는 피질골 변화를 측정하는 데 있어 3D-DXA의 한계를 더욱 잘 보여줍니다. 그들의 3D-DXA 분석은 로모소주맙(romosozumab)에 반응하여 모든 피질골 매개변수가 증가했다고 보고했습니다. 반면 이전의 QCT 분석에서는 동일한 치료 후에 피질골 BMD의 증가가 나타나지 않았습니다 [62]. 저자들은 다음과 같이 언급했습니다: “로모소주맙 치료가 고관절의 통합 및 해면골 vBMD에 미치는 영향에 대해 QCT와 DXA 기반 3D-SHAPER로 얻은 데이터는 연구 전반에 걸쳐 유사했지만, 왜 피질골 vBMD에서는 차이가 났는지 불분명합니다.” 동일한 저자들 중 일부가 이미 이 불일치에 대해 설명하고 예측했던 Bone지의 편집자 서신을 보았다는 점을 고려할 때 [7], 3D-DXA의 능력과 한계에 대한 오해가 여전히 지속되고 있는 것으로 보입니다. 결과적으로 이러한 오해는 다시 한번 해당 약물의 효능에 대한 지나치게 낙관적인 평가로 이어졌을 가능성이 큽니다.
이러한 연구들은 피질골 및 해면골 변화의 색상 지도를 제시함으로써 잠재적으로 잘못된 결과를 더욱 확산시킵니다. 3D-DXA는 국소적인 변화를 측정할 수 없는데, 이는 각 모델 매개변수가 전역적으로 밀도 분포에 영향을 미치기 때문이기도 하고, 이러한 변화가 DXA 영상에서 보이지 않기 때문이기도 합니다. 이러한 연구에서 다중 비교 보정을 적용하지 않은 것은 결과를 더욱 약화시킵니다. 지도에서 유의미해 보이는 영역은 사실 훨씬 덜 유의미하며, 이는 다양한 약물에 대한 지나치게 낙관적인 평가로 이어집니다.
환자 관리
3D-Shaper 소프트웨어는 71가지의 측정값을 생성할 수 있지만, 임상적으로 승인된 버전은 전역 해면골 vBMD와 피질골 sBMD, 그리고 그와 관련된 T-점수와 Z-점수만을 생성합니다. T-점수와 Z-점수가 어떤 인구 집단에서 도출되었는지는 명확하지 않지만, 3D-Shaper Medical의 웨비나에서는 코카서스 인구 참조 데이터가 언급되었습니다 [63]. 일찍이 스페인 [64] 및 아르헨티나 [65] 인구를 대상으로 한 참조 도표가 작성되었으며, 두 가지 모두 그림 6에 재현되어 있습니다. 그러나 이 도표들은 서로 다르며 3D-Shaper 소프트웨어에서 생성된 그림과도 별개인 것으로 보입니다. 3D-Shaper Medical, DMS Imaging 및 그 유통업체들은 이 인구 집단이나 이러한 데이터가 어떻게 도출되었는지 공개하지 않습니다. 그러나 일본의 3D-Shaper 유통업체인 Toyo Medic Co., Ltd.(일본 도쿄)는 일본 시장용으로 승인된 3D-Shaper 소프트웨어가 일본인 인구의 참조 데이터를 사용하지 않는다는 점을 확인해주었습니다. 코카서스 인구와 아시아 인구 간의 피질골 및 해면골 매개변수의 큰 차이 [68]를 고려할 때, 추가적인 검증 없이 이러한 T-점수와 Z-점수를 일본에 적용하는 것은 신중해 보이지 않습니다. 그 타당성은 그것이 적용되는 모든 인구 집단에 대해 확인되어야 합니다.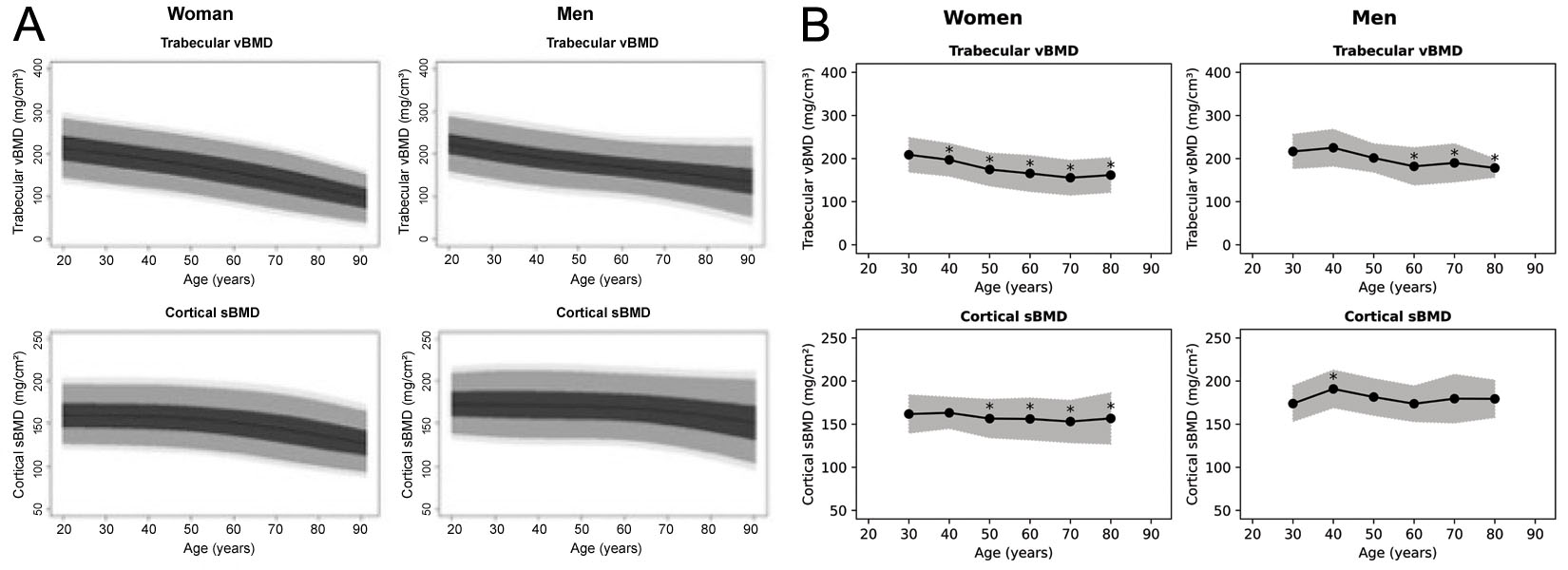
웨비나 [66]에서 3D-Shaper Medical은 3D-Shaper 결과 피질골 sBMD가 낮고 해면골 vBMD가 매우 낮게 나타난 잠재적인 임상 사례를 제안했습니다. 표에 따르면 테리파라타이드가 피질골보다 해면골을 더 많이 개선하기 때문에 테리파라타이드가 최선의 치료법이라고 언급되었습니다. 그러나 이 표를 바탕으로 한다면 추체(vertebral) aBMD를 무시할 경우 임상의가 테리파라타이드보다 데노수맙(denosumab)이나 아발로파라타이드를 선택하는 것이 자연스러울 것입니다.
3D-DXA는 정규 DXA T-점수 및 Z-점수 평가와 병행하여 사용될 가능성이 높습니다. 따라서 위험도가 높은 개인을 놓칠 위험은 최소화될 것입니다. 그러나 3D-DXA와 관련된 오류로 인해 피질골 sBMD 및 해면골 vBMD는 항상 실제보다 약간 높거나 낮게 측정될 것입니다. 치료 경계선에 있는 환자의 경우, 임상의가 aBMD 단독으로는 지시되지 않았을 항골다공증 약물을 처방하도록 유도될 수 있습니다.
섬유주 골 점수(TBS)에 관한 연구에 따르면 이러한 추가적인 평가가 이차성 골다공증의 치료 결정에 유의미한 영향을 미칩니다 [67]. 해당 연구에서 정상적인 BMD 측정값을 가진 환자의 21~25.5%가 TBS에 의해 불량한 골질을 가진 것으로 나타나 치료 결정이 바뀌었습니다. 3D-DXA에서도 유사한 효과가 발생할 수 있으며, 잠재적으로 과잉 처방과 같은 의도하지 않은 결과를 초래할 수 있습니다. 표가 사용된다면 임상의가 다른 약물보다 특정 약물을 선택하도록 유도할 수도 있습니다.
3D-Shaper Medical은 또한 선택된 치료법이 실제로 피질골과 해면골 부위에 기대된 효과를 나타내는지 확인하기 위해 환자를 모니터링할 수 있다고 명시하고 있습니다. 그러나 3D-DXA의 오차가 예상되는 변화보다 크고 재현성이 낮다는 점을 고려하면 [36], 추적 관찰 3D-DXA 평가에서 보이는 변화가 실제 효과에 의한 것인지 아니면 단순히 3D-DXA 고유의 오류에 의한 것인지 확인할 수 없습니다. 임상의가 이러한 결과를 신뢰한다면 불필요하게 치료법을 변경하도록 유도될 수 있습니다.
(A)
| 2D DXA (전체 고관절) aBMD | 3D-DXA (3D-Shaper) 해면골 vBMD | 3D-DXA (3D-Shaper) 피질골 sBMD | |
|---|---|---|---|
| Alendronate | + | + | + |
| Denosumab | ++ | ++ | ++ |
| Zoledronic acid | + | + | ++ |
| Teriparatide [15, 52, 55*, 56] | + | ++ | = |
| Abaloparatide | ++ | ++ | ++ |
| Romosozumab | +++ | +++ | +++ |
(B)
| aBMD | vBMD | sBMD | |
|---|---|---|---|
| Teriparatide [52, 56] (18개월) | ++ (3.3%) | ++/+++ (9%) | + (1.8%) |
| Teriparatide [15] (24개월) | = (p > 0.05) | ++/+++ (5.9%) | = (p > 0.05) |
| Teriparatide [60] (24개월) | = (p > 0.05) | ++/+++ (>14%) | = (p > 0.05) |
(C)
| 기호 | (전체 고관절) aBMD | 해면골 vBMD | 피질골 sBMD |
|---|---|---|---|
| +++ | Δ > n/a % | Δ > n/a % | Δ > n/a % |
| ++ | 2 < Δ ≤ n/a % | 4 < Δ ≤ n/a % | 2 < Δ ≤ n/a % |
| + | 0.5 < Δ ≤ 2 % | 0.5 < Δ ≤ 4 % | 0.5 < Δ ≤ 2 % |
| = | -0.5 ≤ Δ ≤ 0.5 % | -0.5 ≤ Δ ≤ 0.5 % | -0.5 ≤ Δ ≤ 0.5 % |
| - | -2 ≤ Δ < -0.5 % | -4 ≤ Δ < -0.5 % | -2 ≤ Δ < -0.5 % |
| -- | Δ < -2 % | Δ < -4 % | Δ < -2 % |
임상용 버전의 3D-DXA는 다양한 해부학적 부위의 피질골 sBMD에 대한 정보를 제공하지 않지만, 뼈 표면 전체의 sBMD를 보여주는 색상 코딩된 3D 모델을 표시합니다. 3D-Shaper Medical은 이를 국소적인 취약성을 감지하는 데 사용할 수 있다고 제안합니다 [66]. 안타깝게도 3D-DXA는 환자 고유의 피질골 지도를 재구성할 수 없습니다. 이에 대한 직관적인 설명은 다시 그림 2를 참조해 주십시오. 따라서 3D-DXA 피질골 지도에서 국소적인 결손이 제안된다면, 이는 모델의 통계적으로 그럴듯한 산출물일 뿐 환자의 실제 해부학적 구조와 일치하는 것은 아닙니다. 이는 다시 불필요하거나 부적절한 치료 결정을 초래할 수 있습니다.
3D-Shaper 소프트웨어는 현재 510(k) 시판 전 신고 절차를 통해 FDA 승인을 받았습니다 [68]. 3D-Shaper Medical은 단면적(CSA), 단면 이차 모멘트(CSMI), 단면 계수(Z), 좌굴 비율(BR), 피질골 표면 광물 밀도(sBMD), 해면골 체적 골밀도(vBMD) 및 통합 vBMD를 이전에 FDA 승인을 받은 Hologic Inc.의 고관절 구조 분석(HSA) 소프트웨어의 유사한 측정값과 비교하는 상관관계 연구를 사용하여 이를 획득했습니다.
특히 경부 축 길이와 경부 샤프트 각도는 이 평가에서 제외되었으며, 따라서 이 매개변수들의 사용은 FDA의 승인을 받지 않았습니다. 국제 임상 골밀도 측정 학회(ISCD) 가이드라인에 따르면 고관절 축 길이를 제외하고는 HSA 매개변수를 고관절 골절 위험을 평가하는 데 사용해서는 안 됩니다 [69]. 또한 이 규제 승인에는 참조 데이터와 측정치를 비교하기 위한 T-점수나 Z-점수가 포함되어 있지 않습니다. 이는 미국 내 3D-Shaper의 임상적 적용 가능성에 대한 우려를 불러일으킵니다.
마지막으로 3D-Shaper 매개변수는 Hologic QDR X선 골밀도 측정기의 HSA 옵션과 실질적으로 동등한 것으로 간주되었습니다. FDA는 3D-Shaper가 다른 DXA 스캐너와 함께 사용될 수 있는지 확인할 수 없으므로 미국 내 다른 장치와의 호환성 문제는 해결되지 않은 채 남아 있습니다.
고찰
요약하자면, 3D-DXA는 매우 정밀해 보이는 다양한 골 매개변수를 생성하지만, 이는 뚜렷한 피질골이나 해면골 특성을 측정하는 것이 아니라 주로 전체적인 에어리얼 BMD(aBMD)를 반영합니다. 소프트웨어가 피질골 및 해면골 변화가 aBMD에 비례하는 인구 집단에서 실제 값과 상관관계가 있는 결과를 낼 수 있지만, 피험자별 측정이나 국소적 변화를 포착하는 데는 미흡합니다. 이러한 한계는 피질골과 해면골 매개변수가 반대로 변할 수 있고 3D-DXA가 QCT에서 관찰되는 이러한 진정한 변화를 반영하지 못하는 동화 작용 치료(anabolic therapy)와 같은 시나리오에서 특히 두드러집니다. 이는 일상적인 임상 진료나 신뢰할 수 있는 연구 도구로서의 사용에 대해 중대한 우려를 불러일으킵니다.3D-DXA는 원래 통합 vBMD 추정치를 제공하여 골다공증을 더 잘 진단하기 위해 개발되었습니다 [70, 71]. 피질골과 해면골 부위를 분리하여 평가하려 하지 않음으로써, 3D-DXA가 산출하는 통합 vBMD는 여전히 유효한 추정치일 수 있습니다. 이후 이러한 매개변수가 통계 모델의 형태를 완벽하게 설명하므로 모델 매개변수를 직접 분석하여 골절 위험 추정을 개선하려는 시도로 방법론이 확장되었습니다 [51, 72, 73, 74]. 그러나 이 리뷰에서 자세히 설명한 3D-DXA의 주요 한계는 여전히 남아 있으며 그 정확성과 신뢰성을 약화시킵니다.
이 연구는 3D-Shaper Medical, DMS Imaging, 및 Fujifilm을 포함하여 3D-DXA를 상용화하는 회사들의 투명성 부족으로 인해 한계가 있었습니다. 결과적으로 공개된 정보와 이 방법론을 개발한 제 자신의 경험에 의존하고 있습니다. 독자들께서는 공개되지 않은 3D-DXA 및 3D-Shaper의 측면에 대해 이러한 회사나 그 대표자들에게 설명을 요청하시길 권장합니다.
전문 학회에서의 평가는 3D-DXA의 타당성에 대한 독립적인 평가를 제공하고 그 사용에 관한 공식적인 권고안을 확립함으로써 귀중한 지침을 제공할 수 있습니다. DXA 베스트 프랙티스에 관한 국제 워킹 그룹(International Working Group on DXA Best Practices)의 이중 에너지 X선 흡수 계측법에 대한 실제 가이드라인 업데이트에서 3D-DXA에 대해 "이러한 새로운 영상 기술을 임상 실무에 적용하기 위한 권고를 내리기 위해서는 더 많은 증거가 필요하다"고 언급하고 있지만 [75], 저는 이제 권고의 근거가 될 증거가 충분하다고 믿으며, 이 리뷰가 그러한 측면에서 도움이 되기를 바랍니다.
결론적으로 3D-DXA의 근본적인 한계를 고려할 때, 3D-DXA가 제공하는 피질골 및 해면골 매개변수는 연구 목적으로 사용되어서는 안 되며, 진단, 모니터링 또는 치료 결정 지원과 같은 임상적 응용에도 적합하지 않다는 것이 저의 전문가적 평가입니다.
저자 기여
TW는 원고의 개념화, 데이터 큐레이션, 공식 분석, 조사, 방법론, 자원, 시각화 및 집필에 기여했습니다.연구 자금
이 연구를 위해 받은 자금은 없습니다.데이터 가용한성
이 기사에 제시된 모든 데이터는 저자의 요청에 따라 제공될 수 있습니다.이해 상충
저자는 3D-DXA 소프트웨어의 기초가 되는 방법론과 관련된 특허의 공동 발명자입니다. 저자는 상업용 3D-DXA 소프트웨어 코드, 통계 모델 및 홍보 자료의 지적 재산권 및 기원에 관한 논의에 참여해 왔습니다. 저자는 3D-Shaper Medical 또는 3D-DXA의 상업적 활용에 관여하는 다른 회사와 제휴 관계가 없으며 주식, 로열티 또는 기타 재정적 보상을 받은 적이 없습니다. 저자는 교육 포럼에서 UCB를 상대로 강의를 한 적이 있으며 Amgen Inc.와 Lilly로부터 연구 보조금을 지원받았습니다. 이 기사에서 표명된 견해는 전적으로 저자 개인의 생각이며 방법론 및 가용한 과학적 증거에 대한 비판적 평가를 근거로 합니다.References
- Whitmarsh T (2012). 3D Reconstruction of the Proximal Femur and Lumbar Vertebrae from Dual-Energy X-Ray Absorptiometry for Osteoporotic Risk Assessment
- Humbert L, Martelli Y, Fonolla R, et al. (2017). 3D-DXA: Assessing the Femoral Shape, the Trabecular Macrostructure and the Cortex in 3D from DXA images. IEEE Transactions on Medical Imaging, 36(1), 27–39.
- Whitmarsh T, Humbert L, De Craene M, et al. (2011). Reconstructing the 3D Shape and Bone Mineral Density Distribution of the Proximal Femur From Dual-Energy X-Ray Absorptiometry. IEEE Transactions on Medical Imaging, 30(12), 2101–2114.
- Ahmad O, Ramamurthi K, Wilson KE, et al. (2010). Volumetric DXA (VXA): A new method to extract 3D information from multiple in vivo DXA images. Journal of Bone and Mineral Research, 25(12), 2744–2751.
- Väänänen SP, Grassi L, Flivik G, et al. (). Generation of 3D shape, density, cortical thickness and finite element mesh of proximal femur from a DXA image. Medical Image Analysis, 24(1).
- Whitmarsh T, Humbert L, De Craene M, et al. 3D bone mineral density distribution and shape reconstruction of the proximal femur from a single simulated DXA image: an in vitro study. In: Dawant BM, Haynor DR, eds. Medical Imaging 2010: Image Processing. Vol. 7623. SPIE; 2010:76234U.
- Whitmarsh T. Concerns regarding the use of 3D-DXA. Bone. 2021;149:115939.
- Treece G, Gee A (2015). Independent measurement of femoral cortical thickness and cortical bone density using clinical CT. Medical Image Analysis, 20(1), 249–264.
- Freitas L, Amorim T, Humbert L, et al. (2018). Cortical and trabecular bone analysis of professional dancers using 3D-DXA: a case–control study. Journal of Sports Sciences, 37(1), 82–89.
- Gracia-Marco L, García-Fontana B, Ubago-Guisado E, et al. (2019). Analysis of Bone Impairment by 3D DXA Hip Measures in Patients With Primary Hyperparathyroidism: A Pilot Study. The Journal of Clinical Endocrinology \& Metabolism, 105(1), 175–184.
- Orduna G, Humbert L, Fonolla R, et al. (2018). Cortical and Trabecular Bone Analysis of Patients With High Bone Mass From the Barcelona Osteoporosis Cohort Using 3-Dimensional Dual-Energy X-ray Absorptiometry: A Case-Control Study. Journal of Clinical Densitometry, 21(4), 480–484.
- Gifre L, Humbert L, Muxi A, et al. (2017). Analysis of the evolution of cortical and trabecular bone compartments in the proximal femur after spinal cord injury by 3D-DXA. Osteoporosis International, 29(1), 201–209.
- García Hoyos M, Humbert L, Salmón Z, et al. (2019). Analysis of volumetric BMD in people with Down syndrome using DXA-based 3D modeling. Archives of Osteoporosis, 14(1).
- Beck B, Harding A, Weeks B, et al. (2021). Response to “Concerns regarding the use of 3D-DXA”. Bone, 149, 115936.
- Winzenrieth R, Humbert L, Di Gregorio S, Bonel E, García M, Del Rio L. Effects of osteoporosis drug treatments on cortical and trabecular bone in the femur using DXA-based 3D modeling. Osteoporos Int.2018;29(10):2323–2333.
- Cummings SR, Cauley JA, Palermo L, et al. Racial differences in hip axis lengths might explain racial differences in rates of hip fracture. Osteoporos Int.1994;4(4):226–229.
- Kim KM, Brown JK, Kim KJ, et al. Differences in femoral neck geometry associated with age and ethnicity. Osteoporos Int. 2010;22(7):2165–2174.
- Sone T, Humbert L, Lopez M, et al. (2022). Assessment of femoral shape, trabecular and cortical bone in Japanese subjects using DXA-based 3D modelling. JOURNAL OF BONE AND MINERAL RESEARCH, 37, 214--214.
- Varoquaux G, Cheplygina V (2022). Machine learning for medical imaging: methodological failures and recommendations for the future. npj Digital Medicine, 5(1).
- Hadjiiski L, Cha K, Chan H, et al. (). AAPM task group report 273: Recommendations on best practices for AI and machine learning for computer‐aided diagnosis in medical imaging. Medical Physics, 50(2).
- Huisman M (2024). When AUC-ROC and accuracy are not accurate: what everyone needs to know about evaluating artificial intelligence in radiology. European Radiology, 34(12), 7892–7894.
- Gallifant J, Bitterman DS, Celi LA, et al. (2024). Ethical debates amidst flawed healthcare artificial intelligence metrics. npj Digital Medicine, 7(1).
- Amani A, Bellver M, del Rio L, et al. (2022). Femur 3D-DXA Assessment in Female Football Players, Swimmers, and Sedentary Controls. International Journal of Sports Medicine, 44(06), 420–426.
- Maïmoun L, Renard E, Humbert L, et al. (2021). Modification of bone mineral density, bone geometry and volumetric BMD in young women with obesity. Bone, 150, 116005.
- Jain RK, López Picazo M, Humbert L, et al. (2025). Bone Structural Parameters as Measured by 3-Dimensional Dual-Energy X-Ray Absorptiometry Are Superior in Black Women and Demonstrate Unique Associations With Prior Fracture Versus White Women. Endocrine Practice, 31(2), 152–158.
- Gracia-Marco L, Gonzalez-Salvatierra S, Garcia-Martin A, et al. (2021). 3D DXA Hip Differences in Patients with Acromegaly or Adult Growth Hormone Deficiency. Journal of Clinical Medicine, 10(4), 657.
- Toussirot E, Winzenrieth R, Aubin F, et al. (2024). Areal bone mineral density, trabecular bone score and 3D-DXA analysis of proximal femur in psoriatic disease. Frontiers in Medicine, 11.
- Ubago-Guisado E, Moratalla-Aranda E, González-Salvatierra S, et al. (2023). Do patients with type 2 diabetes have impaired hip bone microstructure? A study using 3D modeling of hip dual-energy X-ray absorptiometry. Frontiers in Endocrinology, 13.
- Guerra FS, Palladino N, Winzenrieth R, et al. (2024). Advanced 3D-DXA insights into bone density changes in hyperparathyroidism. Journal of Diabetes \& Metabolic Disorders, 23(2), 2191–2199.
- Kužma M, Vaňuga P, Ságová I, et al. Non-invasive DXA derived bone structure assessment of acromegaly patients: a cross sectional study. Eur J Endocrinol. 2019;180(3):201–211.
- Maïmoun L, Aouinti S, Puech M, et al. Modification of bone architecture following sleeve gastrectomy: a five-year follow-up. J Bone Miner Res. 2024;40(2):251–261.
- Maïmoun L, Gelis A, Serrand C, et al. (2023). Alteration of Volumetric Bone Mineral Density Parameters in Men with Spinal Cord Injury. Calcified Tissue International, 113(3), 304–316.
- Harding AT, Weeks BK, Lambert C, et al. (2020). Effects of supervised high-intensity resistance and impact training or machine-based isometric training on regional bone geometry and strength in middle-aged and older men with low bone mass: The LIFTMOR-M semi-randomised controlled trial. Bone, 136, 115362.
- Gil-Cosano JJ, Ubago-Guisado E, Sánchez MJ, et al. (2020). The effect of an online exercise programme on bone health in paediatric cancer survivors (iBoneFIT): study protocol of a multi-centre randomized controlled trial. BMC Public Health, 20(1).
- Humbert L, Whitmarsh T, De Craene M, et al. (2010). 3D reconstruction of both shape and Bone Mineral Density distribution of the femur from DXA images. 2010 IEEE International Symposium on Biomedical Imaging: From Nano to Macro, 456–459.
- O’Rourke D, Beck BR, Harding AT, et al. (2021). Assessment of femoral neck strength and bone mineral density changes following exercise using 3D-DXA images. Journal of Biomechanics, 119, 110315.
- Dudle A, Gugler Y, Pretterklieber M, et al. (2023). 2D-3D reconstruction of the proximal femur from DXA scans: Evaluation of the 3D-Shaper software. Frontiers in Bioengineering and Biotechnology, 11.
- Clotet J, Martelli Y, Di Gregorio S, et al. (2018). Structural Parameters of the Proximal Femur by 3-Dimensional Dual-Energy X-ray Absorptiometry Software: Comparison With Quantitative Computed Tomography. Journal of Clinical Densitometry, 21(4), 550–562.
- Ramamurthi K, Ahmad O, Engelke K, et al. (2011). An in vivo comparison of hip structure analysis (HSA) with measurements obtained by QCT. Osteoporosis International, 23(2), 543–551.
- Whitmarsh T, Treece GM, Gee AH, et al. (2015). Mapping Bone Changes at the Proximal Femoral Cortex of Postmenopausal Women in Response to Alendronate and Teriparatide Alone, Combined or Sequentially. Journal of Bone and Mineral Research, 30(7), 1309–1318.
- Whitmarsh T, Treece GM, Gee AH, et al. (2016). The Effects on the Femoral Cortex of a 24 Month Treatment Compared to an 18 Month Treatment with Teriparatide: A Multi-Trial Retrospective Analysis. PLOS ONE, 11(2), e0147722.
- Huininga K, Koromani F, Zillikens M, et al. (2024). Use of 3D Shaper Analysis for the Assessment of Fracture Risk in a Population-Based Setting. JBMR Plus, 8(Supplement\_1), i1--i340.
- Huininga K, Koromani F, Zillikens MC, et al. (2024). Use of 3D Shaper Analysis for the Assessment of Fracture Risk in a Population-based Setting. ASBMR 2024 Annual Meeting Abstracts and Abstract Book.
- Qasim M, López Picazo M, Ruiz Wills C, et al. (2024). 3D-DXA Based Finite Element Modelling for Femur Strength Prediction: Evaluation Against QCT. Journal of Clinical Densitometry, 27(2), 101471.
- Iki M, Winzenrieth R, Tamaki J, et al. (2021). Predictive ability of novel volumetric and geometric indices derived from dual-energy X-ray absorptiometric images of the proximal femur for hip fracture compared with conventional areal bone mineral density: the Japanese Population-based Osteoporosis (JPOS) Cohort Study. Osteoporosis International, 32(11), 2289–2299.
- Grassi L, Väänänen SP, Ristinmaa M, et al. Prediction of femoral strength using 3D finite element models reconstructed from DXA images: validation against experiments. Biomechanics and Modeling in Mechanobiology, 16(3).
- Grassi L, Fleps I, Sahlstedt H, et al. (). Validation of 3D finite element models from simulated DXA images for biofidelic simulations of sideways fall impact to the hip. Bone, 142.
- Grassi L, Väänänen SP, Jehpsson L, et al. (). 3D Finite Element Models Reconstructed From 2D Dual‐Energy X‐Ray Absorptiometry (DXA) Images Improve Hip Fracture Prediction Compared to Areal BMD in Osteoporotic Fractures in Men (MrOS) Sweden Cohort. Journal of Bone and Mineral Research, 38(9).
- Grassi L, Väänänen SP, Voss A, et al. DXA-based 3D finite element models predict hip fractures better than areal BMD in elderly women. Bone. 2025;195:117457.
- Allison SJ, Poole KES, Treece GM, et al. (2015). The Influence of High-Impact Exercise on Cortical and Trabecular Bone Mineral Content and 3D Distribution Across the Proximal Femur in Older Men: A Randomized Controlled Unilateral Intervention. Journal of Bone and Mineral Research, 30(9), 1709–1716.
- Whitmarsh T, Fritscher KD, Humbert L, et al. (2011). Hip fracture discrimination using 3D reconstructions from Dual-energy X-ray Absorptiometry. 2011 IEEE International Symposium on Biomedical Imaging: From Nano to Macro, 1189–1192.
- Winzenrieth R, Ominsky M, Wang Y, et al. (2021). Differential effects of abaloparatide and teriparatide on hip cortical volumetric BMD by DXA-based 3D modeling. Osteoporosis International, 32(3), 575–583.
- England JR, Cheng PM (2019). Artificial Intelligence for Medical Image Analysis: A Guide for Authors and Reviewers. American Journal of Roentgenology, 212(3), 513–519.
- Lewiecki EM, Betah D, Humbert L, et al. (2024). 3D-modeling from hip DXA shows improved bone structure with romosozumab followed by denosumab or alendronate. Journal of Bone and Mineral Research, 39(4), 473–483.
- Winzenrieth R, Kostenuik P, Boxberger J, et al. (2022). Proximal Femur Responses to Sequential Therapy With Abaloparatide Followed by Alendronate in Postmenopausal Women With Osteoporosis by 3D Modeling of Hip Dual‐Energy X‐Ray Absorptiometry (DXA). JBMR Plus, 6(4).
- Winzenrieth R, Humbert L, Boxberger JI, et al. (2022). Abaloparatide Effects on Cortical Volumetric BMD and Estimated Strength Indices of Hip Subregions by 3D-DXA in Women With Postmenopausal Osteoporosis. Journal of Clinical Densitometry, 25(3), 392–400.
- Bennett C, Miller M, Wolford G (2009). Neural correlates of interspecies perspective taking in the post-mortem Atlantic Salmon: an argument for multiple comparisons correction. NeuroImage, 47, S125.
- Poole KE, Treece GM, Gee AH, et al. (2014). Denosumab Rapidly Increases Cortical Bone in Key Locations of the Femur: A 3D Bone Mapping Study in Women With Osteoporosis. Journal of Bone and Mineral Research, 30(1), 46–54.
- Sato M, Westmore M, Ma YL, et al. (2004). Teriparatide [PTH(1–34)] Strengthens the Proximal Femur of Ovariectomized Nonhuman Primates Despite Increasing Porosity. Journal of Bone and Mineral Research, 19(4), 623–629.
- Hadji P, Kamali L, Thomasius F, et al. (2024). Real-world efficacy of a teriparatide biosimilar (RGB-10) compared with reference teriparatide on bone mineral density, trabecular bone score, and bone parameters assessed using quantitative ultrasound, 3D-SHAPER® and high-resolution peripheral computer tomography in postmenopausal women with osteoporosis and very high fracture risk. Osteoporosis International, 35(12), 2107–2116.
- Sone T, Ohnaru K, Sugai T, et al. (2023). The effects of abaloparatide on hip geometry and biomechanical properties in Japanese osteoporotic patients assessed using DXA-based hip structural analysis: results of the Japanese phase 3 ACTIVE-J trial. Archives of Osteoporosis, 18(1).
- Genant HK, Engelke K, Bolognese MA, et al. (2016). Effects of Romosozumab Compared With Teriparatide on Bone Density and Mass at the Spine and Hip in Postmenopausal Women With Low Bone Mass. Journal of Bone and Mineral Research, 32(1), 181–187.
- MEDICAL 3S (2021). Webinar - Use of 3D-Shaper in clinical research: state of the art and potential applications
- Casado Burgos E, Di Gregorio S, González Macías J, et al. (2019). Datos de referencia de mediciones óseas en modelos 3D de fémur proximal en población española cn DXA: Proyecto SEIOMM 3D-SHAPPER. Congreso SEIOMM (24º : 2019 : Gerona).
- Brance ML, Saravi FD, Henr{\'i}quez MM, et al. (2020). Reference Values of Three-Dimensional Proximal Femur Parameters from Bone Densitometry Images in Healthy Subjects from Argentina. World Congress on Osteoporosis, Osteoarthritis and Musculoskeletal Diseases, 372--372.
- Jennings I (). 3D Shaper Technology: Revolutionizing Bone Health Analysis
- Al-Hashimi L, Klotsche J, Ohrndorf S, et al. (2023). Trabecular Bone Score Significantly Influences Treatment Decisions in Secondary Osteoporosis. Journal of Clinical Medicine, 12(12), 4147.
- Food {, Administration} D (2022). 510(k) Summary: K220822
- Broy SB, Cauley JA, Lewiecki ME, et al. (2015). Fracture Risk Prediction by Non-BMD DXA Measures: the 2015 ISCD Official Positions Part 1: Hip Geometry. Journal of Clinical Densitometry, 18(3), 287–308.
- Whitmarsh T, Humbert L, Craene MD, et al. (2009). Reconstrucción de la forma del fémur y densidad mineral ósea en 3D para el diagnóstico de osteoporosis a partir de DXA
- Whitmarsh T, Humbert L, Del Río Barquero LM, et al. (2011). Volumetric Bone Mineral Density Estimation using a 3D Reconstruction Method from Dual-energy X-ray Absorptiometry. ASBMR 2011 Annual Meeting Abstracts and Abstract Book.
- Whitmarsh T, Fritscher KD, Humbert L, et al. (2011). A Statistical Model of Shape and Bone Mineral Density Distribution of the Proximal Femur for Fracture Risk Assessment. Medical Image Computing and Computer-Assisted Intervention – MICCAI 2011, 393–400.
- Whitmarsh T, Fritscher KD, Humbert L, et al. (2012). Hip fracture discrimination from dual-energy X-ray absorptiometry by statistical model registration. Bone, 51(5), 896–901.
- Martelli Y, Whitmarsh T, Humbert L, et al. (2012). A software framework for 3D reconstruction and fracture risk assessment of the proximal femur from dual-energy x-ray absorptiometry. Proceedings of VPH 2012: Virtual Physiological Human - Integrative approaches to computational biomedicine.
- Slart RHJA, Punda M, Ali DS, et al. (2024). Updated practice guideline for dual-energy X-ray absorptiometry (DXA). European Journal of Nuclear Medicine and Molecular Imaging, 52(2), 539–563.