要旨
3D-Shaperというソフトウェアツールに実装されている3D-DXAは、統計モデルの位置合わせ(レジストレーション)により、単一の2D DXA画像から近位大腿骨の3D再構成を生成するソフトウェア手法です。3D-DXAの実装は、定量的コンピュータ断層撮影(QCT)から得られるものと同様の海綿骨、皮質骨、および構造パラメータの推定値を提供することを目的としています。3D-DXAの基盤となるソフトウェア手法の考案者および開発者として、私はその採用と広範な普及をますます強い懸念を持って見守ってきました。本記事では、3D-DXAに内在する方法論的な限界を批判的に評価し、研究および患者ケアへの影響について論じます。
主な問題は、DXA画像における皮質骨の視認性が限られているため、3D-DXAが皮質パラメータを正確に導出できないことです。その代わりに、ソフトウェアは直接的な皮質測定ではなく、全体の骨密度(BMD)に基づく予測に依存しています。これにより、実際の皮質測定値を反映しない結果が生じる可能性があります。
その他の懸念事項には、統計モデルが特定の人口統計学的集団から派生していることによる集団バイアスや、単一ビューのDXA画像を使用することによる再構成精度の限界などがあります。
これらの限界は、不適切な性能評価指標の使用や、3D-DXAに関連する研究における多重比較補正の欠如により、誤った測定や研究成果を招いた可能性が高いものの、その多くは認識されないままとなっています。
これらの限界にもかかわらず、3D-DXAは様々な国で規制当局の承認を受けており、臨床診断や治療方針決定の精度を損なう可能性があります。これらの問題を強調することで、本記事は臨床医、研究者、および規制当局に対し、3D-DXAの重大な限界について情報を提供することを目的としています。また、結果の誤解を防ぎ、患者の安全を確保するために、研究および臨床現場におけるその使用を再評価する緊急の必要性を強調しています。
キーワード
3D-DXA, 3D-Shaper, 定量的コンピュータ断層撮影(Quantitative Computed Tomography), 骨密度(Bone Mineral Density), 二重エネルギーX線吸収法(Dual-energy X-ray Absorptiometry), 皮質パラメータマッピング(Cortical Parameter Mapping), 股関節構造解析(Hip Structure Analysis).
一般向け要旨
本レビューは、単一のDXA画像から近位大腿骨の海綿骨、皮質骨、および構造パラメータを推定することを目的とした、3D-Shaperとしても知られる3D-DXAソフトウェアを批判的に検討するものです。3D-DXAにはいくつかの固有の限界があり、それが不正確な測定につながり、研究成果や患者の治療方針の決定に影響を及ぼす可能性があります。これらの問題を理解することは、骨の生理学、薬物治療の効果、および患者の安全性に関する知識に影響を与える可能性のある誤解を避けるために、研究者や臨床医にとって極めて重要です。
はじめに
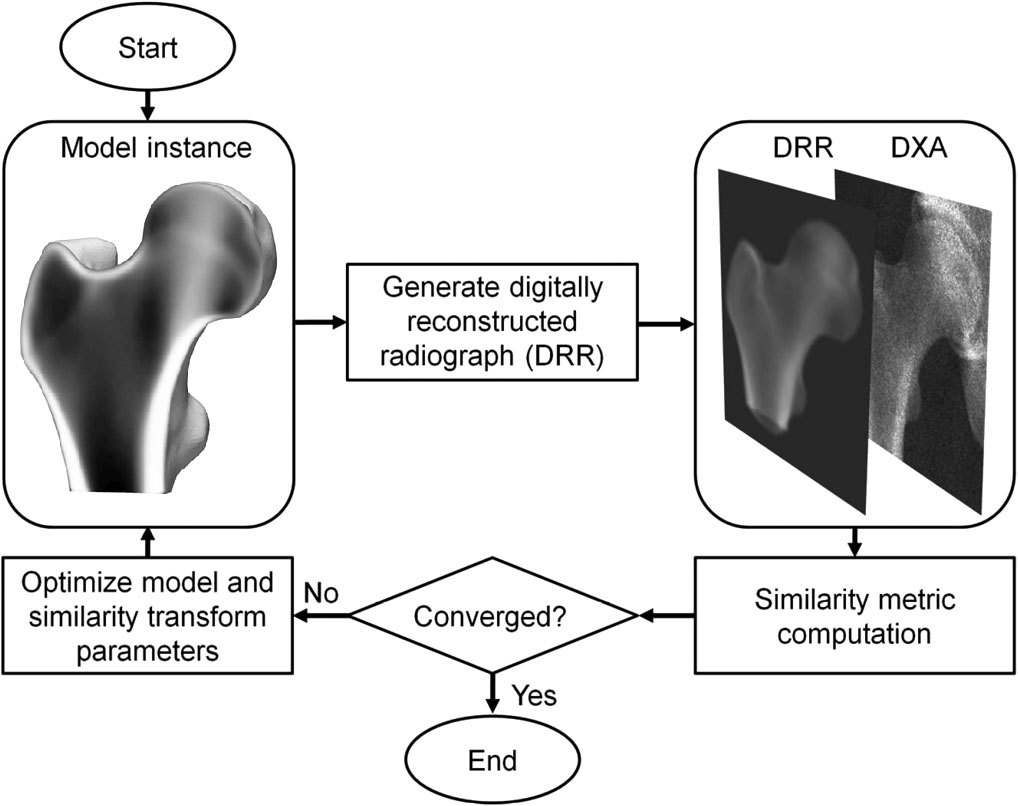
3D-DXAは、3D統計的変形モデルを単一の2D DXA画像上に位置合わせ(レジストレーション)し、近位大腿骨の3Dモデルを生成するソフトウェア手法です [1]。このモデルは、平均年齢56.2 ± 12.1歳(30歳から84歳まで)のスペイン人コーカソイド集団(女性81名、男性30名)から得られた一連の定量的コンピュータ断層撮影(QCT)スキャンに基づいて構築されています [2]。統計モデルのパラメータは、この集団における形状と密度分布の主な変動を記述します。反復的なプロセスの中で、モデルの投影がDXA画像に類似するよう、モデルのパラメータならびに位置、向き、サイズ(pose)が探索されます(図1)。得られた3Dモデルから、骨表面全体にわたる皮質パラメータが測定され、併せて内部の海綿骨体積骨密度(vBMD)値も算出されます。3D-DXAとQCTを比較した際、皮質厚については0.33 mm、皮質密度については72 mg/cm³の平均絶対誤差が報告されており、相関係数は0.86以上でした [2]。
統計モデルを用いてDXA画像から骨構造の3D再構成を行う他の方法も提案されていますが [4, 5]、2010年に初めて公開されたソフトウェア手法 [6] が、後にポンペウ・ファブラ大学(スペイン、バルセロナ)のスピンオフ企業であるGalgo Medical SL(スペイン、バルセロナ)によって「3D-DXA」として商用化されました。このソフトウェアはその後、体積再構成から皮質厚および皮質骨密度(BMD)を測定できるように拡張され [2]、現在はGalgo Medical SLのさらなるスピンオフ企業である3D-Shaper Medical SL(スペイン、バルセロナ)から「3D-Shaper」としてサービスおよびソフトウェアの両形態で商用化されています。このソフトウェアはDMS Imaging(フランス、モギオ)にライセンス供与され、同社のStratos/Medix DXA装置とともに3D-DXAとして販売されています。富士フイルム(日本、東京)は、DMS社の同じDXA装置を富士フイルムブランドの「FDX Visionary DXA」として販売しています。また、Imex Medical(ブラジル、サン・ジョゼ)はこれらの装置を「Elipse」シリーズとして販売し、Radiología SA(スペイン、マドリード)は「Radioscore - DR」として販売しています。これらすべてに3D-DXAを追加するオプションが含まれています。
オリジナルのソフトウェア手法 [1] を開発した当事者として、私は他の利用者や研究者には必ずしも明らかではない、その固有の限界について深い理解を有しています。私はBone誌の編集者への書簡 [7] でこのソフトウェアの主な限界について説明しましたが、3D-DXAは世界中で販売され、使用され続けています。3D-ShaperはEU、日本、タイ、アルゼンチンの規制当局から承認を受けており、FDAからも510(k)クリアランスを取得しており、患者の診断および治療方針決定のための使用が許可されています。これらの承認を踏まえると、このソフトウェアに関するいくつかの誤解に対処し、明確にすることで、その限界についての理解を深めることが極めて重要かつ急務です。
方法論上の限界
このセクションでは、3D-DXAの基盤となる手法の限界のいくつかと、さらに不正確さを招く可能性のある具体的な実装上の詳細について説明します。
皮質パラメータは測定されていない
主な問題は、3D-DXAが皮質パラメータを導出するための皮質骨が、DXA画像において十分に視認できないことにあります。これを説明するために、Bone誌の編集者への書簡に掲載された図を再確認したいと思います(図2)。DXA画像は、骨表面のほとんどの場所において、皮質パラメータを導出できるような識別可能な皮質が存在しないことを明確に示しています。これは、骨投影の輪郭(A)に当てはまりますし、2つの対向する皮質層がX線検出器に対して垂直である場所(B)では特に顕著です。これはピクセルサイズ0.3 x 0.25mmのGE iDXAスキャナーによる画像でも明らかですが、より低解像度(ピクセルサイズ0.6 x 1.05mm)の古いGE Prodigy DXA装置を使用した画像ではさらに顕著になりますが、3D-Shaperソフトウェアではこれらの装置もサポートされています。
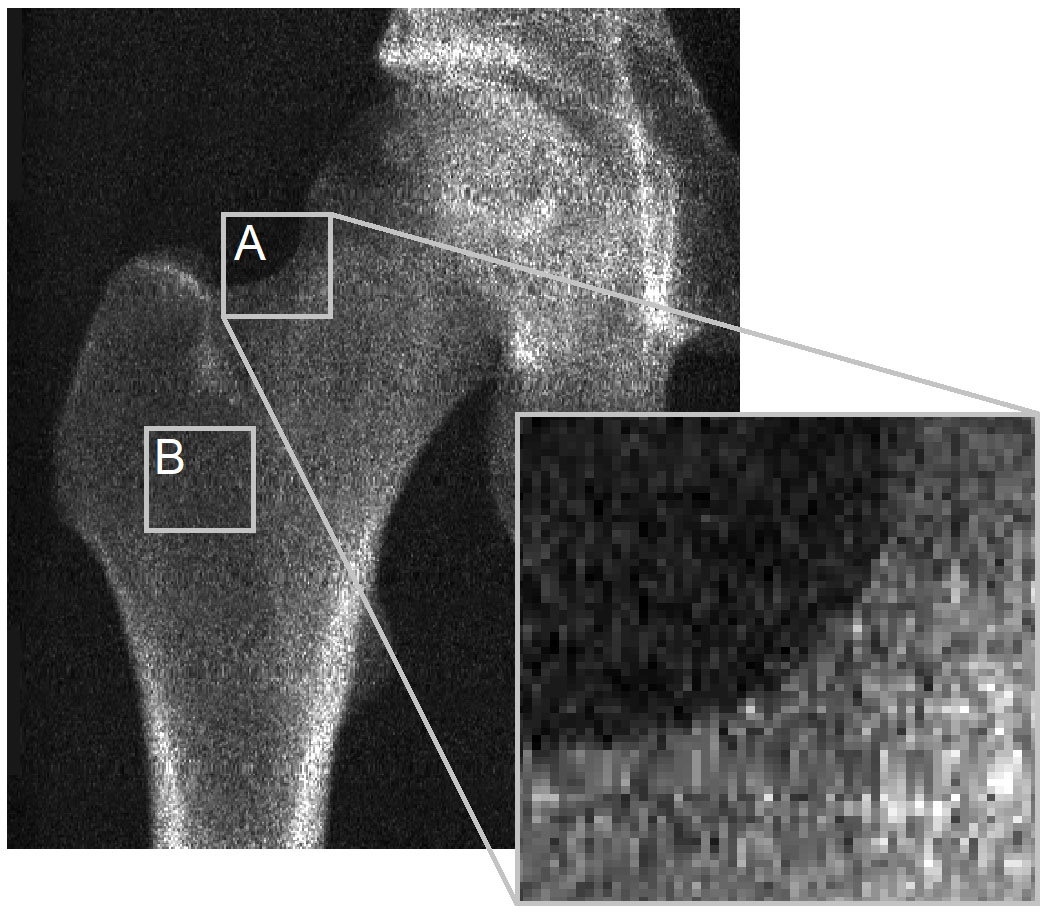
3D-DXAは、DXA画像から直接皮質パラメータを測定するのではなく、形状と密度分布の統計モデルをDXA画像上に位置合わせし [7]、このモデルから皮質パラメータを抽出します [2]。このモデルは校正された一連のQCTスキャンから構築されており、標準的なCTスキャンのボクセルのハンスフィールド単位(HU)が、校正用ファントムを使用してBMD値に変換されています。
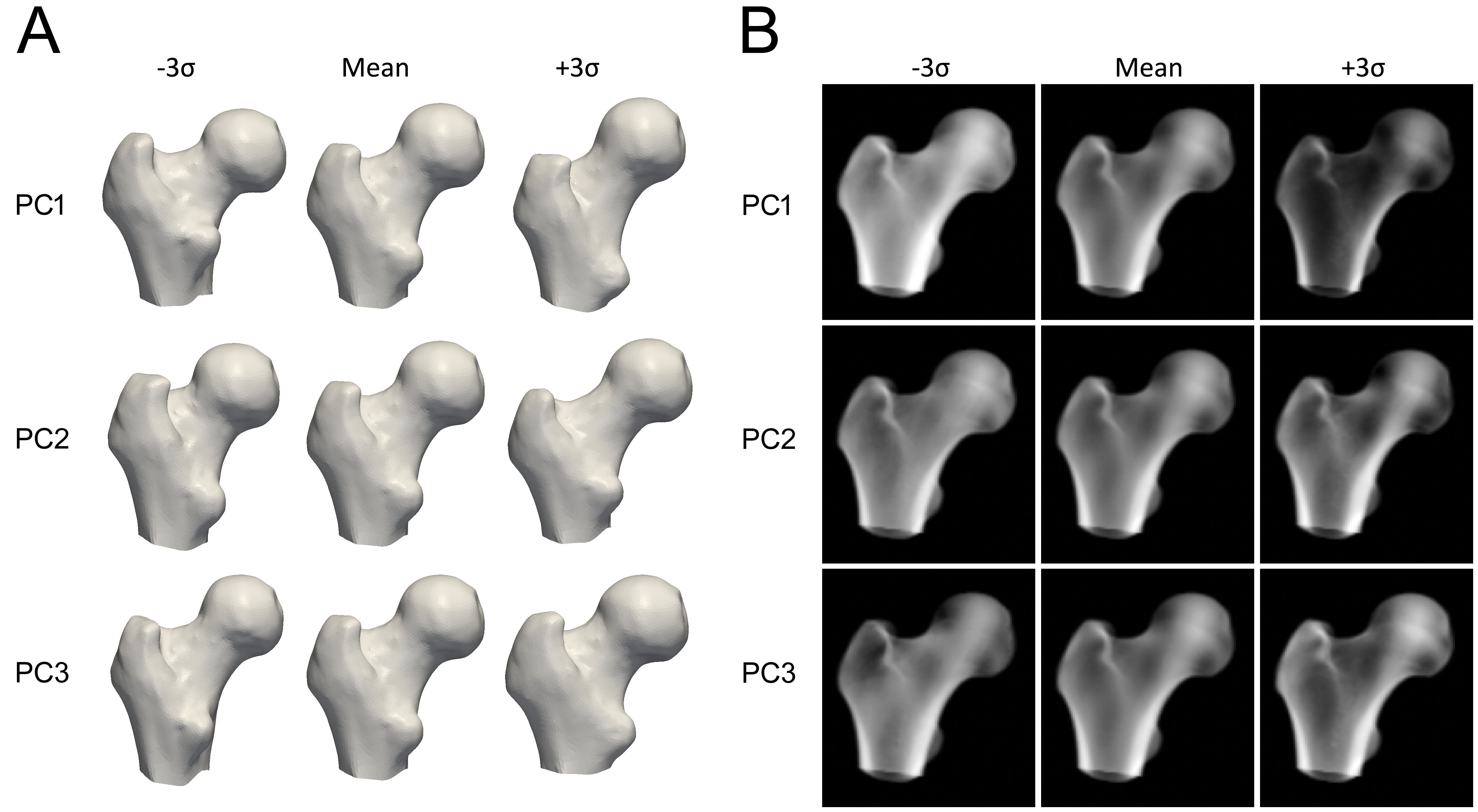
モデルを構築するために、まず各QCTスキャンにおける近位大腿骨がセグメンテーション(領域分割)され、近位大腿骨の表面メッシュが作成されます。次に、主成分分析(PCA)などの数学的手法が、整列された大腿骨表面の点群に適用され、平均的な形状と、その重要度順に並べられた形状のバリエーションを記述する一連の主成分(PC)が得られます。
密度分布モデルを構築するために、各QCTボリュームは平均形状へと変形され、ボクセルのBMD値に対して同様の統計的手法が適用されます。その結果、平均的なボリュームと、密度のバリエーションを記述する一連の密度PCが得られます。
各PCは、形状または密度が変化し得る特定の様態を表しています(図3)。モデルのパラメータ(重み)は、各バリエーションを平均にどの程度加えるかを決定します。得られるモデルのインスタンスが現実的な範囲に収まるよう、これらのパラメータは通常、標準偏差(SD)の2.5倍から3倍以内に制限されます。新しい密度モデルのインスタンスを作成するために、密度ボリュームはThin Plate Splinesなどの手法を用いて、新しいモデル形状へと変形されます。
3D-DXAは、モデルインスタンスの投影がDXA画像に十分に一致するまで、モデルパラメータならびにモデルの向き、位置、サイズを反復的に探索します(図1)。
その後、QCTスキャンからの測定用に提案されたデコンボリューション法 [8] と同等の手法を用いて、得られたモデルインスタンス上で皮質厚と皮質BMDが測定されます。したがって、皮質パラメータはDXA画像そのもので測定されているのではなく、画像上に位置合わせされたパラメータモデルから導出されているのです。
3D-DXAが、DXA画像自体には皮質が写っていない場所の値を含む皮質マップを表示する場合 [9〜13]、これらのマップは位置合わせされたモデルに由来するものです。3D-Shaper Medical SLによる回答では、これらは「推定値」であると説明されていますが [14]、より正確には、3D-DXAが複雑でエラーが発生しやすい統計的手法を用いてこれらの値を「予測」していると言うべきです。DXA画像から得られる皮質情報は限られているため、ソフトウェアは主に全体のBMDに依存することになり、モデル構築に使用されたスペイン人集団の統計的特性によって制約を受けます。
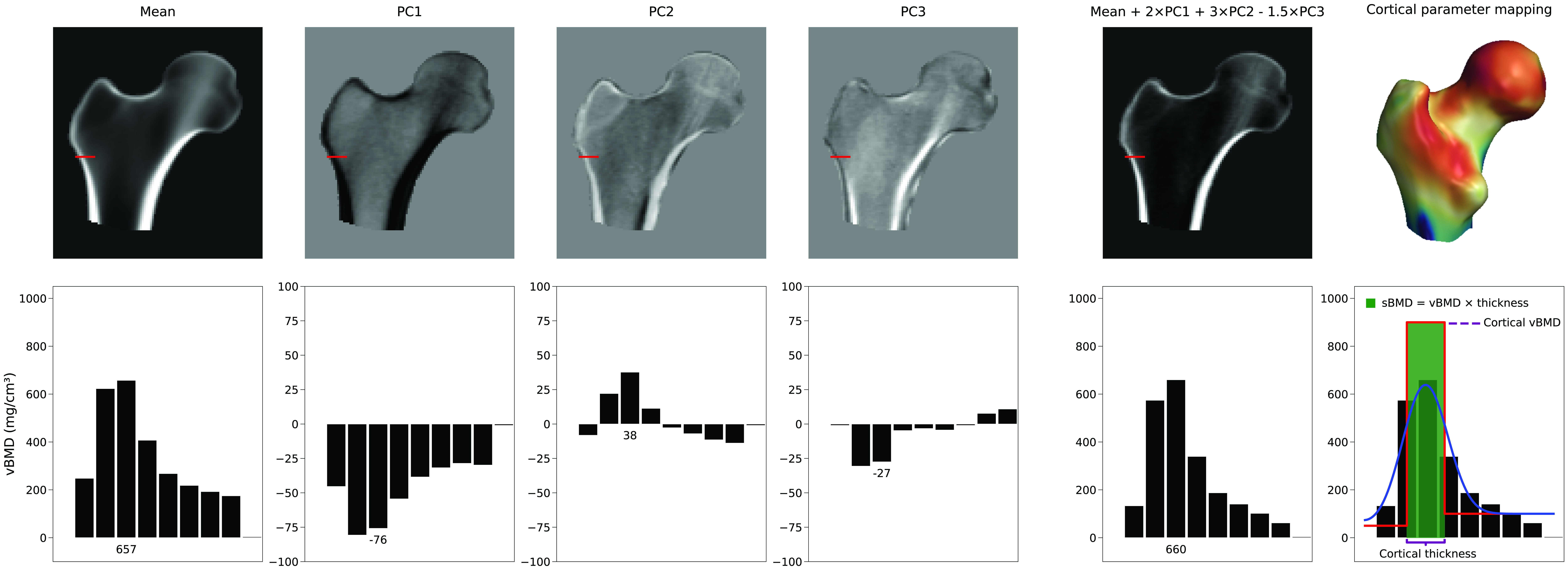
使用されるモデルパラメータの数
皮質厚のみを増加させる単一のモデルパラメータは存在しない、ということを認識しておくことが重要です。その代わりに、密度モデルにおける皮質の表現は、平均密度ボリュームと密度モデルのPCの線形結合によって決定されます。図4は、平均と最初の3つのPCによって新しいモデルインスタンスがどのように形成されるかを示しています。皮質厚、皮質密度、または海綿骨密度を選択的かつ独立に調整するには、多くのコンポーネントの複雑な組み合わせが必要であり、結果として多くのパラメータが必要となります。
通常、変動の大部分を説明できるコンポーネントのサブセットのみが保持されます。使用されるパラメータの数は、累積分散の一定量(例えば95%)を説明するものを選択するか、スクリープロットを使用して曲線の「エルボー(肘)」を探すことによって決定されることが多いです。より厳密な手法はHornのパラレル分析 [6] であり、変動がランダムデータから予想されるものと同様であるノイズを表すコンポーネントを破棄するために使用できます。
パラメータの数は極めて重要ですが、私の知る限り、3D-Shaper Medical SLは使用されているパラメータの数や、その数を導き出した手法を公開していません。もしパラメータの数がHornのパラレル分析に照らして十分でない場合、モデルは対象集団内の完全な変動範囲を表現できない可能性があります。さらに、研究論文で使用されているパラメータの数と臨床ソフトウェアで使用されている数が異なる場合、報告された精度と臨床結果の間に乖離が生じることになります。
潜在的な集団バイアス
3D-DXAによって生成される3D骨モデルは、トレーニングに使用された集団で観察された変動に基づいています。3D-Shaperでは、平均年齢56.2 ± 12.1歳のスペイン人集団(女性81名、男性30名)を使用してモデルが構築されています [2, 15]。性別による骨構造の明らかな違いに加えて、人口統計学的な違いも存在し、コーカソイドとアジア人の近位大腿骨の形態が互いに異なることはよく知られています [16]。
コーカソイド集団から構築された統計モデルを3D再構成に使用する場合、パラメータをスペイン人の平均形状の±3 SD以内に制限すると、アジア人集団のすべての個人に対して正確な再構成を生成できない可能性があります。例えば、大腿骨頸部の皮質厚は白人女性で1.84 ± 0.03 mmであるのに対し、韓国人女性では2.41 ± 0.71 mmであると報告されています [17]。韓国人女性の皮質厚の平均2.41 mmは、コーカソイド集団の±3 SD範囲(1.75〜1.93 mm)から外れてしまいます。これは、統計モデルを対象集団に合わせることがいかに重要であるかを浮き彫りにしています。
日本人集団における3D-DXA測定値がQCTスキャンと相関したという報告がありますが [18]、その理由は、3D-DXAモデルとQCTスキャンのすべてのパラメータが面積骨密度(aBMD)と相関しているためです。これは患者固有の再構成を意味するものではありません。たとえ推定された形状が正しくなかったとしても、モデルの投影がDXA画像の骨と重なっている限り、密度値(皮質厚や皮質BMDを含む)はaBMDに従います。こうした限界があるにもかかわらず、3D-DXAはアジア(日本、タイ、インドを含む)で販売されています。
統計モデルは、それが適用されるのと同じ集団でトレーニングされるべきです。これは、性別、民族、そしておそらく治療タイプごとに別々のモデルを構築するか、これらすべてのグループから十分な数の個人を単一のモデルに含め、十分な数のパラメータを確保することによって達成できます。この原則は機械学習において標準的であり [19〜22]、トレーニング集団によってモデルが能動的に制約を受ける統計モデリングでは特に重要です。それにもかかわらず、3D-DXAは以下のような広範で多様な集団に適用されてきました:プロのダンサー [9]、女子サッカー選手および水泳選手 [23]、肥満の若年女性 [24]、黒人女性 [25]、高骨量患者 [11]、成長ホルモン欠乏症の成人 [26]、乾癬性疾患 [27]、2型糖尿病 [28]、原発性副甲状腺機能亢進症 [10, 29]、先端巨大症 [30]、ダウン症 [13]、スリーブ胃切除後 [31]、脊髄損傷の男性 [32]、低骨量の中高年オーストラリア人男性 [33]、小児がんサバイバー [34]。
限られた再構成精度
3D-DXAは複雑なソフトウェア手法であり、QCT校正、モデル構築のための変形レジストレーション、形状への密度ボリューム変形、QCTとDXA間のBMDおよび解像度の違い、投影の簡略化(ファンビームではなく等角投影)など、複数の段階でエラーの影響を受けやすいものです。これらの要因の各々が、予測不可能なバイアスを導入する可能性があります。さらに、わずか111名のスペイン人成人という小さなトレーニングセットなどの具体的な実装の詳細が、形状、密度、皮質厚の変動を制限し、その適用範囲を狭めています。
また、3D-ShaperがGEやHologicのDXA装置の専有データを正しく読み取り、必要な校正や体組成補正を適切に適用しているかどうかも不明確です。これらのプロセスにおける不正確さは、異なる集団に適用された場合や、時間の経過とともにそれらの集団に変化が生じた場合に、結果に影響を及ぼす可能性があります。
近位大腿骨の形状と向きをサブミリメートルの精度で調整できないのであれば、皮質厚や皮質密度もサブミリメートルの精度で推定することはできないと考えるのが妥当でしょう。初期の研究では、2つ目のビューを追加することで形状誤差が1.3mmから0.9mmに、BMD誤差が4.4%から3.2%に減少することが示されており、単一のビューが最適ではないことを示唆しています [35]。対照的に、CTは何百もの投影から3Dボリュームを再構成するため、皮質パラメータと海綿骨パラメータを独立して測定することが可能です。
3D-DXAは、パラメータ探索がどこで最小値に収束するかによって、根本的に異なる大腿骨形態を生成する可能性があります。特に回転が正しくない場合にその傾向が顕著です。同日に繰り返しDXAスキャンを行った研究では、推定された強度の差が62%にも達し [36]、要素ごとのBMDの差は平均30 ± 50%であり、皮質パラメータについても再現性が低いことが示唆されました。別の研究では、3D-ShaperとQCTの骨密度の相関は低い(r2 = 0.48)ことが示されています [37]。
構造パラメータについては、3D-DXAとCTを比較した場合、大腿骨頸部軸長についてr = 0.86の相関が報告されていますが [38]、これはDXAスキャンで直接測定した場合(r = 0.90 [39])よりも悪い結果でした。3D-DXAにおける頸部体部角(neck-shaft angle)も限定的な精度(r = 0.71 [38])であり、その理由の一つは、半骨盤との重なりを避けるために大腿骨頭がマスクによって除外されているためです。骨盤の追加モデルがあれば、この問題は軽減される可能性があります [5]。
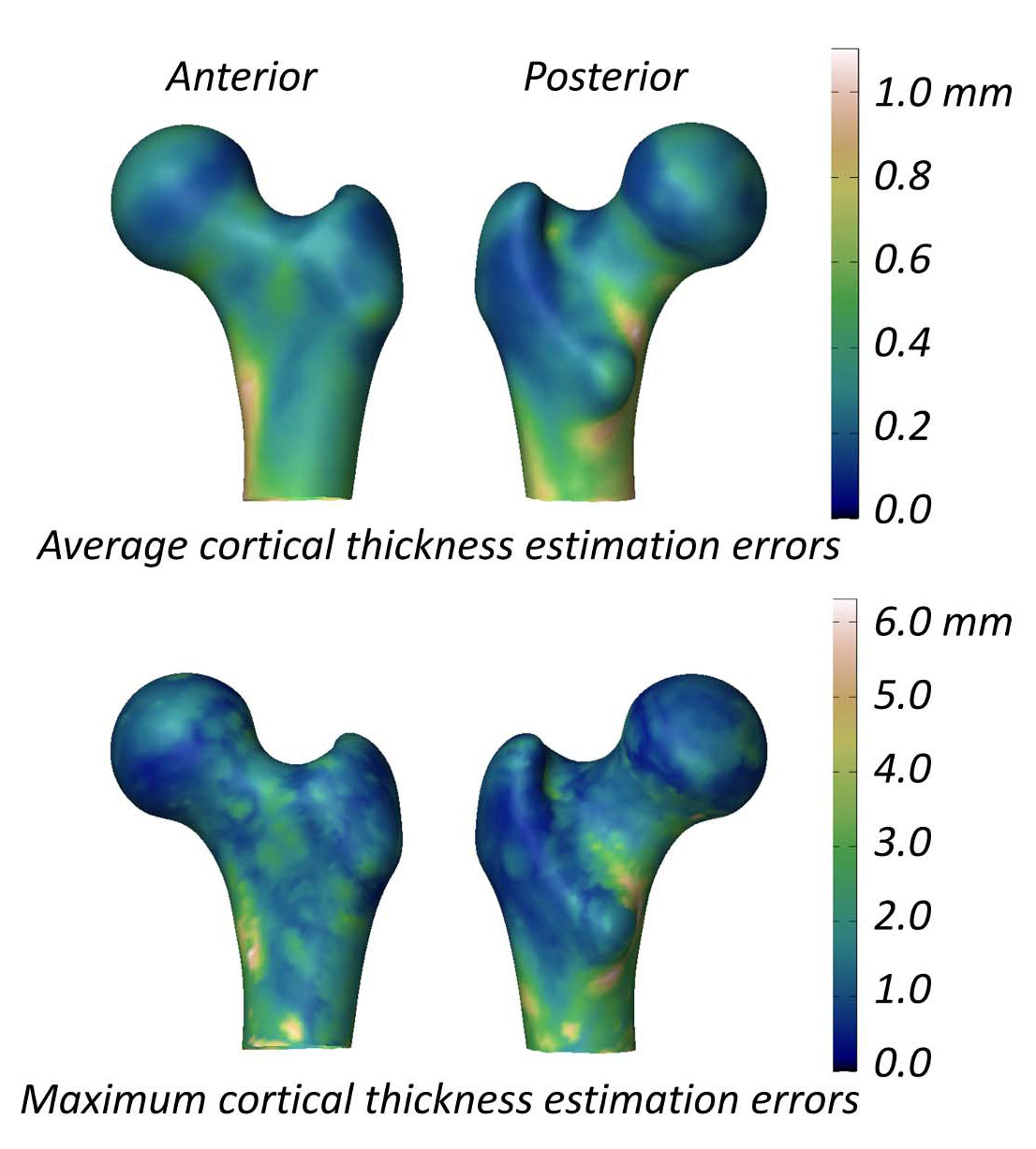
皮質パラメータの研究において、3D-DXAとQCTの平均(± SD)差は、頸部で0.04 ± 0.21 mm、転子部で-0.07 ± 0.15 mmでした [2]。図5は表面全体の平均および最大絶対誤差を示しており、平均誤差は0.2 mmを超え、最大誤差は1 mm以上に達しています。比較のために挙げると、18ヶ月間のアレンドロネート服用後のQCT研究では1.4%(約0.018 mm)の増加が報告されており [40]、テリパラチドの3つの試験データでは約0.035 mmの変化が示されています [41]。3D-DXAの誤差はこれらの変化を上回っているため、真の治療効果と方法論的なノイズを確実に区別できる可能性は低いです。
面積骨密度に対する限定的な利点
統計的密度モデルでは、第1成分が分散の大部分を説明しており、これを増加させると全体の密度と皮質パラメータが上昇します [7]。DXAには視認可能な皮質情報がほとんどないため、3D-DXAは主にこの成分に依存することになり、海綿骨パラメータと皮質パラメータは面積骨密度(aBMD)と本質的に相関することになります。aBMDが増加すると、3D-DXA解析では海綿骨vBMD、皮質BMD、および皮質厚が同時に増加を示します。近年の研究(ECTS 2024およびASBMR 2024)では、3D-ShaperのパラメータがaBMDと強く相関し、骨折予測に関する追加情報を提供しないことが確認されています [42, 43]。
さらに、再構成によってDXAで視認可能な大腿骨の輪郭を捉えることはできますが、頸部軸長や頸部体部角の復元精度は限られています。したがって、再構成された形状は主に全体の骨サイズを反映しており、それはすでにaBMDに含まれているため、強度予測への寄与はわずかです。例えば、3D-DXAから予測された強度はQCTと相関しましたが(r2 = 0.88)、大腿骨頸部aBMDのみによる予測(r2 = 0.87)を有意に上回ることはありませんでした [37]。3D-Shaper Medical SLの研究でも同様の相関(r2 = 0.86)が示されていますが、aBMDとの比較は行われていません [44]。日本人コホートにおいても、3D-Shaperの測定値は統計的に大腿骨全体のaBMDより優れているわけではありませんでした [45]。
DXAへの3Dレジストレーションという同様のアプローチを用いた他の研究では、おそらく追加の骨盤モデルを使用しているために、aBMDを上回る改善が報告されているケースもありますが [46〜48]、同じ根本的な限界は依然として存在します。
3D-DXAがそれ自体の情報でaBMDを上回ることができないのであれば、DXAスキャンで直接測定される股関節構造解析(HSA)パラメータとaBMDの組み合わせを上回ることは困難でしょう。それにもかかわらず、3D-Shaper Medical SLは現在、3D-DXAに基づく有限要素解析サービスを提供しています。
検証方法
限界があるにもかかわらず、多くの出版物が3D-DXAの精度に関して肯定的な結果を報告しています。これは、実際の限界を覆い隠してしまう傾向のある不適切な検証方法 [21, 22] を使用していることが一因として挙げられます。これらの点について以下に論じます。
不適切な性能指標
3D-Shaper Medical SLは、DXA由来の表面メッシュとQCTから手動で作成された表面メッシュとの間の平均点-表面距離が0.93 mmであると報告しました [2]。皮質パラメータについては、皮質厚の平均絶対誤差(MAE)が0.33 mm、皮質密度が72 mg/cm³であると報告されています。これらの値は3D-DXAの精度を説明するために提示されましたが、これらの誤差が臨床目的や研究目的において許容範囲内であるかどうかを判断するための基準は提供されていません。
精度は相関係数を用いても報告されています。海綿骨、皮質、および全体のvBMD、ならびに皮質厚に対して、0.86、0.93、0.95、0.91という高い相関が報告されました。しかし、前述の通り、これらの高い相関は患者固有の再構成精度を反映しているというよりも、主にこれらのパラメータすべてが全体のBMDに依存していることによるものです。
同様に、3D-DXAを用いた集団研究において、報告される結果はしばしば3D-DXAパラメータと様々な要因との相関を示します。しかし、それらの結果は単にaBMDの変化を反映しているだけかもしれません。より適切な検証は、単純なベースラインなどの「ブラインド推定器(blind estimator)」と結果を比較することでしょう。ブラインド推定器の例としては、ある集団の平均皮質厚マップをすべての患者に適用するという単純な推定が考えられます。洗練された手法であれば、少なくともこうしたベースラインを上回ることができるはずですが、通常、このような評価は公開されていません。
多くの出版物は成功したケースのみを提示する傾向があり、ソフトウェアの信頼性が過大評価される可能性があります。失敗率を定量化する方法としては、モデルの投影とDXA画像を並べて視覚化したり、再構成されたボリュームのスライスをQCTスキャンと比較したりすることなどが考えられます。以前の研究では、明示的には述べられていませんが、合計173例のうち80例のみが保持されており、50%以上の失敗率が示唆されています [51]。
統計的に有意であるという事実のみに基づいて、3D-DXAの知見が正しいと述べることも誤りです。私の編集者への書簡に対する回答の中で、テリパラチドに関する2つの3D-DXA研究が引用されました。一方は皮質BMDの増加を報告しており [52]、もう一方は有意な変化なしと報告しています [15]。しかし、QCT研究で観察される実際の変化は、リモデリングの亢進による皮質密度の「低下」です(詳細は後述)。
多重比較補正の欠如
この問題は、特に3D-Shaperサービスを使用した研究において重要です。このソフトウェアは71個ものパラメータを提供しており、そのそれぞれが個別の仮説検定となります。結果に対して多重比較の補正(例:ボンフェローニ補正)が行われない場合、純粋に偶然によって統計的に有意な結果が見つかる確率が高まってしまいます。多くの3D-DXA研究では、これらの補正が適用されていません [10, 24, 27, 28]。
これは、骨表面やボリューム内の色分けされたマップにも当てはまります。各頂点やボクセルは通常、個別の統計検定を表します。一般的なアプローチは、点ごとのt検定(point-wise t-test)を実行し、変化が有意である領域を表示することです [9〜12, 13, 28, 52, 54, 55]。ボリュームマップについては、統計情報がまったく提供されていないケースもあります [9, 11, 30, 52, 54, 55, 56]。これにより、実際には偶然によるものである可能性があるにもかかわらず、パターンが局所的な変化を反映しているかのように見える「誤解を招く視覚化」が生じる恐れがあります。これは介入の効果の過大評価につながる可能性があります。
例えば、神経画像(neuroimaging)の分野では、多重比較を補正する必要性が広く認識されており [57]、表面データに対するSurfStat(ランダムフィールド理論を使用)や、ボリュームデータに対するSPMやFSLといった手法が標準的な実務となっています [58]。これらの手法を適用すれば統計的な厳密さは向上しますが、3D-DXAパラメータが面積骨密度(aBMD)に大きく依存しているという根本的な問題は解決されません。
影響
薬物有効性研究における誤解を招く結果
多くの研究において、3D-DXAによって提供される結果はもっともらしく見え、健康な個人では皮質パラメータが面積骨密度(aBMD)と相関するという一般的な規則とも一致しています。しかし、骨形成やリモデリングが乱され、異なる骨パラメータがもはや比例した速度で変化しなくなる状況(アナボリック治療の場合など)では、この関係は崩れてしまいます。
テリパラチドの場合、3D-DXA研究では皮質vBMDの統計的に有意な増加を含む、すべての皮質パラメータの増加が報告されました [52]。対照的に、QCT研究による同等の測定では、18〜24ヶ月後に皮質BMDの有意な「低下」が観察されており、これはリモデリングの亢進による皮質多孔性の増大に起因するとされています [41, 59]。他のテリパラチドに関する3D-DXA研究では、有意な変化は報告されていません [15, 60]。考えられる一つの説明は、DXA画像である程度視認可能な骨幹(mid-shaft)の皮質の変化が統計モデル全体に波及し、皮質BMDの局所的な低下を再現できていないというものです。
アバロパラチドについても同様の傾向が見られ、3D-DXA研究では皮質パラメータの増加が報告されていますが [52, 55, 56]、QCT研究では皮質密度の低下傾向が観察されています [61]。ロモソズマブについては、3D-DXAは皮質厚と皮質BMDの広範な増加を報告しましたが [54]、QCTでは皮質密度の増加は見られませんでした [62]。こうした不一致は、前述の限界を考えれば予見可能なものです [7]。
さらに、色分けされたマップを通じて「局所的な」変化を示すことは、誤解を招く印象を与える可能性があります。3D-DXAは主に密度分布にグローバルな影響を与える少数のモデルパラメータに依存しているため、個々の患者に特有の局所的なパターンを測定することはできません。適切な多重比較の補正がなければ、これらのマップは治療効果に対する過度に楽観的な評価につながる可能性があります。
Patient management
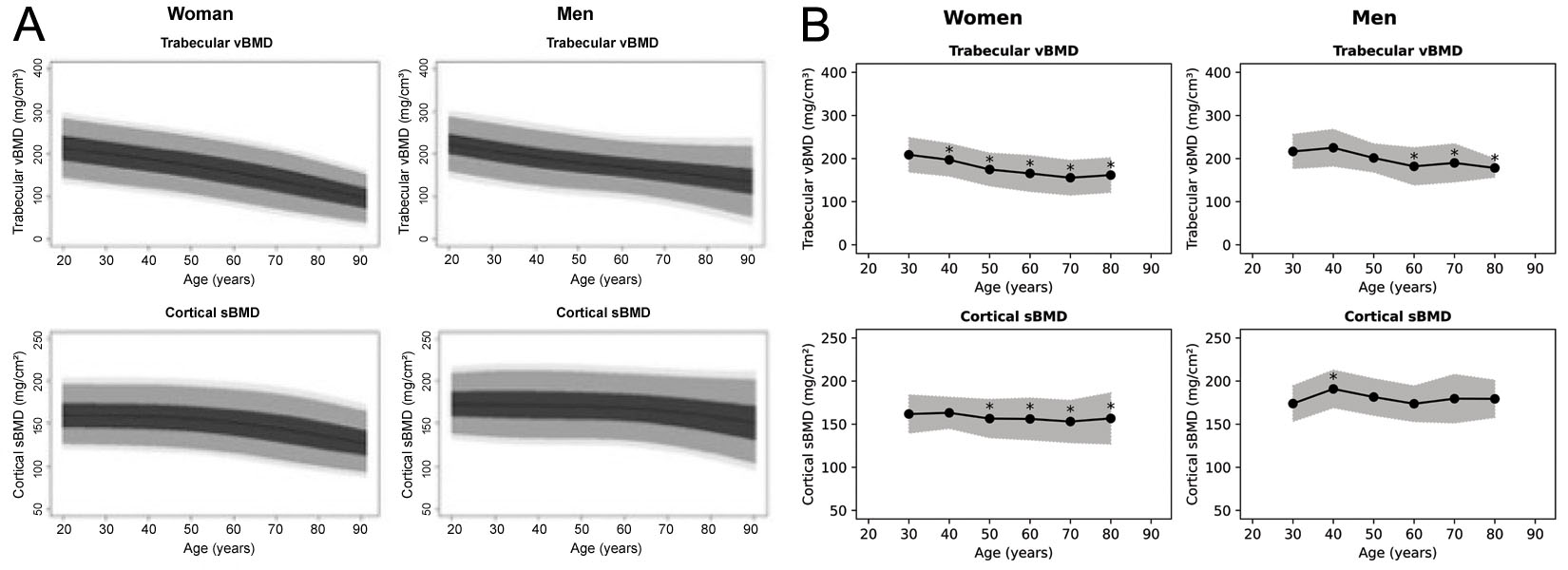
3D-Shaperは71個ものパラメータを算出できますが、臨床承認されたバージョンのソフトウェアでは、主に海綿骨vBMDと皮質表面BMD(sBMD)、およびそれらに対応するTスコアとZスコアの測定値を提供します。しかし、参照データがどの集団に基づいているのかは明確ではありません。トレーニングセミナーでは、コーカソイドの参照データであると主張されていました [63]。スペイン人集団およびアルゼンチン人集団の参照曲線が公開されていますが(図6) [64, 65]、これらは互いに一致しておらず、ソフトウェアのドキュメントに記載されている図とも一致しません。また、日本で販売されているバージョンが日本人参照データを使用していないことも確認されています。コーカソイド集団とアジア人集団の違い [68] を踏まえると、臨床現場でのこれらのパラメータの使用には慎重さが必要です。
啓発資料では、治療選択を補助するために設計された表が提供されています(下の表A〜C)。これらの表に示されているしきい値は恣意的であるか文書化されておらず、表内の個々の研究の要約も表中の記号と一致していません。したがって、これらの表に基づいて臨床的な決定を下すことの妥当性には疑問があります。
あるウェビナー [66] では、sBMDは低いが海綿骨vBMDが非常に低い患者に対しては、海綿骨への効果が大きいためテリパラチドが最も適切な治療法であると主張されていました。しかし、臨床医が脊椎aBMDなど、3D-DXA解析に含まれていないパラメータを考慮していれば、別の決定(デノスマブやアバロパラチドの選択など)に至る可能性があります。
臨床現場では、3D-DXAは通常、標準的なDXAのTスコアやZスコアと併用されます。したがって、高リスク患者を見逃すリスクはおそらく最小限でしょう。しかし、境界線上のケースでは、sBMDや海綿骨vBMDの測定値に含まれる「ノイズ」が、治療の決定に影響を及ぼす可能性があります。以前、海綿骨スコア(TBS)の使用が臨床的な治療決定に大きな影響を与えたことが示されましたが [77]、3D-DXA測定についても同様の可能性があります。
もう一つの問題は、フォローアップスキャンにおける3D-DXAの使用です。3D-DXAの誤差が期待される変化を上回る可能性があることや、その再現性の低さ [36] を考えると、観察された変化が真の生理学的変化なのか、それとも単なるノイズなのかを臨床医が判断できなくなる恐れがあります。こうしたデータに頼ることは、不必要な患者管理の変更につながる可能性があります。
| 2D DXA (大腿骨全体) aBMD | 3D-DXA (3D-Shaper) 海綿骨 vBMD | 3D-DXA (3D-Shaper) 皮質骨 sBMD | |
|---|---|---|---|
| アレンドロネート | + | + | + |
| デノスマブ | ++ | ++ | ++ |
| ゾレドロン酸 | + | + | ++ |
| テリパラチド [3, 4, 5, 6]* | + | ++ | = |
| アバロパラチド | ++ | ++ | ++ |
| ロモソズマブ | +++ | +++ | +++ |
| aBMD | vBMD | sBMD | |
|---|---|---|---|
| テリパラチド [4, 5] (18ヶ月) | ++ (3.3%) | ++/+++ (9%) | + (1.8%) |
| テリパラチド [6] (24ヶ月) | = (p > 0.05) | ++/+++ (5.9%) | = (p > 0.05) |
| テリパラチド [7] (24ヶ月) | = (p > 0.05) | ++/+++ (>14%) | = (p > 0.05) |
| 記号 | (大腿骨全体) aBMD | 海綿骨 vBMD | 皮質骨 sBMD |
|---|---|---|---|
| +++ | Δ > n/a % | Δ > n/a % | Δ > n/a % |
| ++ | 2 < Δ ≤ n/a % | 4 < Δ ≤ n/a % | 2 < Δ ≤ n/a % |
| + | 0.5 < Δ ≤ 2 % | 0.5 < Δ ≤ 4 % | 0.5 < Δ ≤ 2 % |
| = | -0.5 ≤ Δ ≤ 0.5 % | -0.5 ≤ Δ ≤ 0.5 % | -0.5 ≤ Δ ≤ 0.5 % |
| - | -2 ≤ Δ < -0.5 % | -4 ≤ Δ < -0.5 % | -2 ≤ Δ < -0.5 % |
| -- | Δ < -2 % | Δ < -4 % | Δ < -2 % |
考察
まとめると、3D-DXAは非常に詳細に見える多様な骨パラメータを生成しますが、それらは皮質や海綿骨の個別の特性を測定しているというよりも、主に全体の面積骨密度(aBMD)を反映しています。皮質と海綿骨の変化がaBMDに比例するような集団においては、ソフトウェアは真の値と相関する結果を出すかもしれませんが、患者固有の測定値や局所的な変化を捉える点では不十分です。この限界は、特におのおのの指標が反比例して変化しうるアナボリック治療のようなシナリオで顕著であり、3D-DXAはQCTで観察されるこうした真の変化を反映することができません。このことは、日常的な臨床現場での使用や、信頼できる研究ツールとしての使用に重大な懸念を抱かせます。
3D-DXAはもともと、全体(integral)vBMDの推定値を提供することで、骨粗鬆症の診断を改善するために開発されました [70, 71]。皮質と海綿骨のコンパートメントを個別に評価しようとしないのであれば、3D-DXAによって生成される全体vBMDは依然として有効な推定値である可能性があります。その後、統計モデルの形態を完全に記述するモデルパラメータを直接分析することで、骨折リスクの推定を改善する試みへと手法が拡張されました [51, 72, 73, 74]。しかし、本レビューで詳述した3D-DXAの主要な限界は依然として存在し、その精度と信頼性を損なっています。
本研究は、3D-Shaper Medical、DMS Imaging、富士フイルムなど、3D-DXAを製品化している企業の透明性の欠如による制約を受けています。その結果、本稿は公開されている情報と、私自身のこの手法の開発経験に依拠しています。3D-DXAおよび3D-Shaperの未公開の側面については、これらの企業またはその代表者に説明を求めることを読者に推奨します。
専門学会による評価は、3D-DXAの妥当性に関する独立した評価を提供し、その使用に関する公式な勧告を確立することで、貴重なガイドラインとなり得ます。DXAのベストプラクティスに関する国際ワーキンググループによる二重エネルギーX線吸収測定法の実践ガイドラインの更新では、3D-DXAに関して「これらの新しい画像技術の臨床現場への適用に関する勧告を行うには、さらなるエビデンスが必要である」と述べられていますが [75]、私は現在、勧告の根拠となる十分なエビデンスが存在すると信じており、本レビューがその一助となることを願っています。
結論として、3D-DXAの根本的な限界を考慮すると、3D-DXAによって提供される皮質および海綿骨のパラメータは、研究目的で使用されるべきではなく、診断、モニタリング、または治療決定のサポートといった臨床応用にも適していないというのが、私の専門家としての評価です。
利益相反
著者は、3D-DXAソフトウェアの基礎となる手法に関連する特許の共同発明者です。著者は、商用3D-DXAソフトウェアコード、統計モデル、およびプロモーション資料の知的財産および起源に関する議論に関与してきました。著者は、3D-Shaper Medical社や3D-DXAの商業的利用に関与するその他の企業とは提携しておらず、株式、ロイヤリティ、またはその他の金銭的報酬も受け取っていません。著者はUCBの教育フォーラムで講演を行い、Amgen Inc.およびLillyから研究助成金の支援を受けました。本稿に記載されている見解は著者個人のものであり、手法の批判的評価および利用可能な科学的根拠に基づいています。
参考文献
- Whitmarsh T (2012). 3D Reconstruction of the Proximal Femur and Lumbar Vertebrae from Dual-Energy X-Ray Absorptiometry for Osteoporotic Risk Assessment
- Humbert L, Martelli Y, Fonolla R, et al. (2017). 3D-DXA: Assessing the Femoral Shape, the Trabecular Macrostructure and the Cortex in 3D from DXA images. IEEE Transactions on Medical Imaging, 36(1), 27–39.
- Whitmarsh T, Humbert L, De Craene M, et al. (2011). Reconstructing the 3D Shape and Bone Mineral Density distribution of the Proximal Femur From Dual-Energy X-Ray Absorptiometry. IEEE Transactions on Medical Imaging, 30(12), 2101–2114.
- Ahmad O, Ramamurthi K, Wilson KE, et al. (2010). Volumetric DXA (VXA): A new method to extract 3D information from multiple in vivo DXA images. Journal of Bone and Mineral Research, 25(12), 2744–2751.
- Väänänen SP, Grassi L, Flivik G, et al. (). Generation of 3D shape, density, cortical thickness and finite element mesh of proximal femur from a DXA image. Medical Image Analysis, 24(1).
- Whitmarsh T, Humbert L, De Craene M, et al. 3D bone mineral density distribution and shape reconstruction of the proximal femur from a single simulated DXA image: an in vitro study. In: Dawant BM, Haynor DR, eds. Medical Imaging 2010: Image Processing. Vol. 7623. SPIE; 2010:76234U.
- Whitmarsh T. Concerns regarding the use of 3D-DXA. Bone. 2021;149:115939.
- Treece G, Gee A (2015). Independent measurement of femoral cortical thickness and cortical bone density using clinical CT. Medical Image Analysis, 20(1), 249–264.
- Freitas L, Amorim T, Humbert L, et al. (2018). Cortical and trabecular bone analysis of professional dancers using 3D-DXA: a case–control study. Journal of Sports Sciences, 37(1), 82–89.
- Gracia-Marco L, García-Fontana B, Ubago-Guisado E, et al. (2019). Analysis of Bone Impairment by 3D DXA Hip Measures in Patients With Primary Hyperparathyroidism: A Pilot Study. The Journal of Clinical Endocrinology \& Metabolism, 105(1), 175–184.
- Orduna G, Humbert L, Fonolla R, et al. (2018). Cortical and Trabecular Bone Analysis of Patients With High Bone Mass From the Barcelona Osteoporosis Cohort Using 3-Dimensional Dual-Energy X-ray Absorptiometry: A Case-Control Study. Journal of Clinical Densitometry, 21(4), 480–484.
- Gifre L, Humbert L, Muxi A, et al. (2017). Analysis of the evolution of cortical and trabecular bone compartments in the proximal femur after spinal cord injury by 3D-DXA. Osteoporosis International, 29(1), 201–209.
- García Hoyos M, Humbert L, Salmón Z, et al. (2019). Analysis of volumetric BMD in people with Down syndrome using DXA-based 3D modeling. Archives of Osteoporosis, 14(1).
- Beck B, Harding A, Weeks B, et al. (2021). Response to “Concerns regarding the use of 3D-DXA”. Bone, 149, 115936.
- Winzenrieth R, Humbert L, Di Gregorio S, Bonel E, García M, Del Rio L. Effects of osteoporosis drug treatments on cortical and trabecular bone in the femur using DXA-based 3D modeling. Osteoporos Int.2018;29(10):2323–2333.
- Cummings SR, Cauley JA, Palermo L, et al. Racial differences in hip axis lengths might explain racial differences in rates of hip fracture. Osteoporos Int.1994;4(4):226–229.
- Kim KM, Brown JK, Kim KJ, et al. Differences in femoral neck geometry associated with age and ethnicity. Osteoporos Int. 2010;22(7):2165–2174.
- Sone T, Humbert L, Lopez M, et al. (2022). Assessment of femoral shape, trabecular and cortical bone in Japanese subjects using DXA-based 3D modelling. JOURNAL OF BONE AND MINERAL RESEARCH, 37, 214--214.
- Varoquaux G, Cheplygina V (2022). Machine learning for medical imaging: methodological failures and recommendations for the future. npj Digital Medicine, 5(1).
- Hadjiiski L, Cha K, Chan H, et al. (). AAPM task group report 273: Recommendations on best practices for AI and machine learning for computer‐aided diagnosis in medical imaging. Medical Physics, 50(2).
- Huisman M (2024). When AUC-ROC and accuracy are not accurate: what everyone needs to know about evaluating artificial intelligence in radiology. European Radiology, 34(12), 7892–7894.
- Gallifant J, Bitterman DS, Celi LA, et al. (2024). Ethical debates amidst flawed healthcare artificial intelligence metrics. npj Digital Medicine, 7(1).
- Amani A, Bellver M, del Rio L, et al. (2022). Femur 3D-DXA Assessment in Female Football Players, Swimmers, and Sedentary Controls. International Journal of Sports Medicine, 44(06), 420–426.
- Maïmoun L, Renard E, Humbert L, et al. (2021). Modification of bone mineral density, bone geometry and volumetric BMD in young women with obesity. Bone, 150, 116005.
- Jain RK, López Picazo M, Humbert L, et al. (2025). Bone Structural Parameters as Measured by 3-Dimensional Dual-Energy X-Ray Absorptiometry Are Superior in Black Women and Demonstrate Unique Associations With Prior Fracture Versus White Women. Endocrine Practice, 31(2), 152–158.
- Gracia-Marco L, Gonzalez-Salvatierra S, Garcia-Martin A, et al. (2021). 3D DXA Hip Differences in Patients with Acromegaly or Adult Growth Hormone Deficiency. Journal of Clinical Medicine, 10(4), 657.
- Toussirot E, Winzenrieth R, Aubin F, et al. (2024). Areal bone mineral density, trabecular bone score and 3D-DXA analysis of proximal femur in psoriatic disease. Frontiers in Medicine, 11.
- Ubago-Guisado E, Moratalla-Aranda E, González-Salvatierra S, et al. (2023). Do patients with type 2 diabetes have impaired hip bone microstructure? A study using 3D modeling of hip dual-energy X-ray absorptiometry. Frontiers in Endocrinology, 13.
- Guerra FS, Palladino N, Winzenrieth R, et al. (2024). Advanced 3D-DXA insights into bone density changes in hyperparathyroidism. Journal of Diabetes \& Metabolic Disorders, 23(2), 2191–2199.
- Kužma M, Vaňuga P, Ságová I, et al. Non-invasive DXA derived bone structure assessment of acromegaly patients: a cross sectional study. Eur J Endocrinol. 2019;180(3):201–211.
- Maïmoun L, Aouinti S, Puech M, et al. Modification of bone architecture following sleeve gastrectomy: a five-year follow-up. J Bone Miner Res. 2024;40(2):251–261.
- Maïmoun L, Gelis A, Serrand C, et al. (2023). Alteration of Volumetric Bone Mineral Density Parameters in Men with Spinal Cord Injury. Calcified Tissue International, 113(3), 304–316.
- Harding AT, Weeks BK, Lambert C, et al. (2020). Effects of supervised high-intensity resistance and impact training or machine-based isometric training on regional bone geometry and strength in middle-aged and older men with low bone mass: The LIFTMOR-M semi-randomised controlled trial. Bone, 136, 115362.
- Gil-Cosano JJ, Ubago-Guisado E, Sánchez MJ, et al. (2020). The effect of an online exercise programme on bone health in paediatric cancer survivors (iBoneFIT): study protocol of a multi-centre randomized controlled trial. BMC Public Health, 20(1).
- Humbert L, Whitmarsh T, De Craene M, et al. (2010). 3D reconstruction of both shape and Bone Mineral Density distribution of the femur from DXA images. 2010 IEEE International Symposium on Biomedical Imaging: From Nano to Macro, 456–459.
- O’Rourke D, Beck BR, Harding AT, et al. (2021). Assessment of femoral neck strength and bone mineral density changes following exercise using 3D-DXA images. Journal of Biomechanics, 119, 110315.
- Dudle A, Gugler Y, Pretterklieber M, et al. (2023). 2D-3D reconstruction of the proximal femur from DXA scans: Evaluation of the 3D-Shaper software. Frontiers in Bioengineering and Biotechnology, 11.
- Clotet J, Martelli Y, Di Gregorio S, et al. (2018). Structural Parameters of the Proximal Femur by 3-Dimensional Dual-Energy X-ray Absorptiometry Software: Comparison With Quantitative Computed Tomography. Journal of Clinical Densitometry, 21(4), 550–562.
- Ramamurthi K, Ahmad O, Engelke K, et al. (2011). An in vivo comparison of hip structure analysis (HSA) with measurements obtained by QCT. Osteoporosis International, 23(2), 543–551.
- Whitmarsh T, Treece GM, Gee AH, et al. (2015). Mapping Bone Changes at the Proximal Femoral Cortex of Postmenopausal Women in Response to Alendronate and Teriparatide Alone, Combined or Sequentially. Journal of Bone and Mineral Research, 30(7), 1309–1318.
- Whitmarsh T, Treece GM, Gee AH, et al. (2016). The Effects on the Femoral Cortex of a 24 Month Treatment Compared to an 18 Month Treatment with Teriparatide: A Multi-Trial Retrospective Analysis. PLOS ONE, 11(2), e0147722.
- Huininga K, Koromani F, Zillikens M, et al. (2024). Use of 3D Shaper Analysis for the Assessment of Fracture Risk in a Population-Based Setting. JBMR Plus, 8(Supplement\_1), i1--i340.
- Huininga K, Koromani F, Zillikens MC, et al. (2024). Use of 3D Shaper Analysis for the Assessment of Fracture Risk in a Population-based Setting. ASBMR 2024 Annual Meeting Abstracts and Abstract Book.
- Qasim M, López Picazo M, Ruiz Wills C, et al. (2024). 3D-DXA Based Finite Element Modelling for Femur Strength Prediction: Evaluation Against QCT. Journal of Clinical Densitometry, 27(2), 101471.
- Iki M, Winzenrieth R, Tamaki J, et al. (2021). Predictive ability of novel volumetric and geometric indices derived from dual-energy X-ray absorptiometric images of the proximal femur for hip fracture compared with conventional areal bone mineral density: the Japanese Population-based Osteoporosis (JPOS) Cohort Study. Osteoporosis International, 32(11), 2289–2299.
- Grassi L, Väänänen SP, Ristinmaa M, et al. Prediction of femoral strength using 3D finite element models reconstructed from DXA images: validation against experiments. Biomechanics and Modeling in Mechanobiology, 16(3).
- Grassi L, Fleps I, Sahlstedt H, et al. (). Validation of 3D finite element models from simulated DXA images for biofidelic simulations of sideways fall impact to the hip. Bone, 142.
- Grassi L, Väänänen SP, Jehpsson L, et al. (). 3D Finite Element Models Reconstructed From 2D Dual‐Energy X‐Ray Absorptiometry (DXA) Images Improve Hip Fracture Prediction Compared to Areal BMD in Osteoporotic Fractures in Men (MrOS) Sweden Cohort. Journal of Bone and Mineral Research, 38(9).
- Grassi L, Väänänen SP, Voss A, et al. DXA-based 3D finite element models predict hip fractures better than areal BMD in elderly women. Bone. 2025;195:117457.
- Allison SJ, Poole KES, Treece GM, et al. (2015). The Influence of High-Impact Exercise on Cortical and Trabecular Bone Mineral Content and 3D Distribution Across the Proximal Femur in Older Men: A Randomized Controlled Unilateral Intervention. Journal of Bone and Mineral Research, 30(9), 1709–1716.
- Whitmarsh T, Fritscher KD, Humbert L, et al. (2011). Hip fracture discrimination using 3D reconstructions from Dual-energy X-ray Absorptiometry. 2011 IEEE International Symposium on Biomedical Imaging: From Nano to Macro, 1189–1192.
- Winzenrieth R, Ominsky M, Wang Y, et al. (2021). Differential effects of abaloparatide and teriparatide on hip cortical volumetric BMD by DXA-based 3D modeling. Osteoporosis International, 32(3), 575–583.
- England JR, Cheng PM (2019). Artificial Intelligence for Medical Image Analysis: A Guide for Authors and Reviewers. American Journal of Roentgenology, 212(3), 513–519.
- Lewiecki EM, Betah D, Humbert L, et al. (2024). 3D-modeling from hip DXA shows improved bone structure with romosozumab followed by denosumab or alendronate. Journal of Bone and Mineral Research, 39(4), 473–483.
- Winzenrieth R, Kostenuik P, Boxberger J, et al. (2022). Proximal Femur Responses to Sequential Therapy With Abaloparatide Followed by Alendronate in Postmenopausal Women With Osteoporosis by 3D Modeling of Hip Dual‐Energy X‐Ray Absorptiometry (DXA). JBMR Plus, 6(4).
- Winzenrieth R, Humbert L, Boxberger JI, et al. (2022). Abaloparatide Effects on Cortical Volumetric BMD and Estimated Strength Indices of Hip Subregions by 3D-DXA in Women With Postmenopausal Osteoporosis. Journal of Clinical Densitometry, 25(3), 392–400.
- Bennett C, Miller M, Wolford G (2009). Neural correlates of interspecies perspective taking in the post-mortem Atlantic Salmon: an argument for multiple comparisons correction. NeuroImage, 47, S125.
- Poole KE, Treece GM, Gee AH, et al. (2014). Denosumab Rapidly Increases Cortical Bone in Key Locations of the Femur: A 3D Bone Mapping Study in Women With Osteoporosis. Journal of Bone and Mineral Research, 30(1), 46–54.
- Sato M, Westmore M, Ma YL, et al. (2004). Teriparatide [PTH(1–34)] Strengthens the Proximal Femur of Ovariectomized Nonhuman Primates Despite Increasing Porosity. Journal of Bone and Mineral Research, 19(4), 623–629.
- Hadji P, Kamali L, Thomasius F, et al. (2024). Real-world efficacy of a teriparatide biosimilar (RGB-10) compared with reference teriparatide on bone mineral density, trabecular bone score, and bone parameters assessed using quantitative ultrasound, 3D-SHAPER{\textregistered} and high-resolution peripheral computer tomography in postmenopausal women with osteoporosis and very high fracture risk. Osteoporosis International, 35(12), 2107–2116.
- Sone T, Ohnaru K, Sugai T, et al. (2023). The effects of abaloparatide on hip geometry and biomechanical properties in Japanese osteoporotic patients assessed using DXA-based hip structural analysis: results of the Japanese phase 3 ACTIVE-J trial. Archives of Osteoporosis, 18(1).
- Genant HK, Engelke K, Bolognese MA, et al. (2016). Effects of Romosozumab Compared With Teriparatide on Bone Density and Mass at the Spine and Hip in Postmenopausal Women With Low Bone Mass. Journal of Bone and Mineral Research, 32(1), 181–187.
- MEDICAL 3S (2021). Webinar - Use of 3D-Shaper in clinical research: state of the art and potential applications
- Casado Burgos E, Di Gregorio S, González Macías J, et al. (2019). Datos de referencia de mediciones óseas en modelos 3D de fémur proximal en población española cn DXA: Proyecto SEIOMM 3D-SHAPPER. Congreso SEIOMM (24º : 2019 : Gerona).
- Brance ML, Saravi FD, Henr{\'i}quez MM, et al. (2020). Reference Values of Three-Dimensional Proximal Femur Parameters from Bone Densitometry Images in Healthy Subjects from Argentina. World Congress on Osteoporosis, Osteoarthritis and Musculoskeletal Diseases, 372--372.
- Jennings I (). 3D Shaper Technology: Revolutionizing Bone Health Analysis
- Al-Hashimi L, Klotsche J, Ohrndorf S, et al. (2023). Trabecular Bone Score Significantly Influences Treatment Decisions in Secondary Osteoporosis. Journal of Clinical Medicine, 12(12), 4147.
- Food {, Administration} D (2022). 510(k) Summary: K220822
- Broy SB, Cauley JA, Lewiecki ME, et al. (2015). Fracture Risk Prediction by Non-BMD DXA Measures: the 2015 ISCD Official Positions Part 1: Hip Geometry. Journal of Clinical Densitometry, 18(3), 287–308.
- Whitmarsh T, Humbert L, Craene MD, et al. (2009). Reconstrucción de la forma del fémur y densidad mineral ósea en 3D para el diagnóstico de osteoporosis a partir de DXA
- Whitmarsh T, Humbert L, Del Río Barquero LM, et al. (2011). Volumetric Bone Mineral Density Estimation using a 3D Reconstruction Method from Dual-energy X-ray Absorptiometry. ASBMR 2011 Annual Meeting Abstracts and Abstract Book.
- Whitmarsh T, Fritscher KD, Humbert L, et al. (2011). A Statistical Model of Shape and Bone Mineral Density Distribution of the Proximal Femur for Fracture Risk Assessment. Medical Image Computing and Computer-Assisted Intervention – MICCAI 2011, 393–400.
- Whitmarsh T, Fritscher KD, Humbert L, et al. (2012). Hip fracture discrimination from dual-energy X-ray absorptiometry by statistical model registration. Bone, 51(5), 896–901.
- Martelli Y, Whitmarsh T, Humbert L, et al. (2012). A software framework for 3D reconstruction and fracture risk assessment of the proximal femur from dual-energy x-ray absorptiometry. Proceedings of VPH 2012: Virtual Physiological Human - Integrative approaches to computational biomedicine.
- Slart RHJA, Punda M, Ali DS, et al. (2024). Updated practice guideline for dual-energy X-ray absorptiometry (DXA). European Journal of Nuclear Medicine and Molecular Imaging, 52(2), 539–563.