要旨
3D-Shaperというソフトウェアツールに実装されている3D-DXAは、統計モデルを登録することで単一の2D DXA画像から近位大腿骨の3D再構成を生成するソフトウェア手法です。3D-DXAの実装は、定量的コンピュータ断層撮影(QCT)から得られるものと同様の海綿骨、皮質骨、および構造パラメータの推定値を提供することを目的としています。3D-DXAの基礎となるソフトウェア手法の発明者および開発者として、私はその採用と普及を懸念を持って見守ってきました。本記事では、3D-DXAに内在する方法論的限界の批判的評価を提供し、研究および患者ケアへの影響について議論します。主な問題は、DXA画像における皮質の可視性が限られているため、3D-DXAが皮質パラメータを正確に導き出すことができないことです。その代わりに、ソフトウェアは直接的な皮質測定ではなく、全体的な骨密度に基づく予測に依存しています。これは、実際の皮質測定値を反映しない結果につながる可能性があります。
その他の懸念事項には、特定の人口統計から導き出された統計モデルによる集団バイアス、および単一ビューのDXA画像を使用することによる限られた再構成精度が含まれます。
これらの限界は、不正確な測定結果や研究成果をもたらしている可能性がありますが、不適切な性能評価指標の使用や、3D-DXAを含む研究における多重比較補正の欠如により、大半が認識されていません。
これらの限界にもかかわらず、3D-DXAは各国で規制当局の承認を受けており、臨床診断や治療決定の正確性を損なう可能性があります。これらの問題を強調することで、本記事は臨床医、研究者、および規制機関に3D-DXAの重大な限界について知らせることを目的としています。結果の誤解を防ぎ、患者の安全を確保するために、研究および臨床現場での使用を再評価する緊急の必要性を強調します。
キーワード
3D-DXA, 3D-Shaper, 定量的コンピュータ断層撮影, 骨密度, 二重エネルギーX線吸収測定法, 皮質パラメータマッピング,股関節構造解析.一般向け要約
このレビューは、単一のDXA画像から近位大腿骨の海綿骨、皮質骨、および構造パラメータを推定することを目的とした、3D-Shaperとしても知られる3D-DXAソフトウェアを批判的に検討します。3D-DXAには、不正確な測定につながる可能性のあるいくつかの内在的な限界があり、研究成果や患者の治療決定に影響を与える可能性があります。これらの問題を理解することは、骨生理学、薬物治療効果、および患者の安全性に関する知識に影響を与える可能性のある誤解を避けるために、研究者や臨床医にとって極めて重要です。はじめに
3D-DXAは、3D統計的変形モデルを単一の2D DXA画像に登録して近位大腿骨の3Dモデルを生成するソフトウェア手法です [1]。モデルは、平均年齢56.2 ± 12.1歳(30〜84歳)のスペイン人白人集団の女性81人と男性30人の一連の定量的コンピュータ断層撮影(QCT)スキャンから構築されています [2]。統計モデルのパラメータは、その後、この集団の形状と密度分布の主な変動を記述します。反復プロセスにおいて、モデルのパラメータ、および位置、向き、サイズが探索され、モデルの投影がDXA画像に似るように試みられます (図 1)。得られた3Dモデルから、皮質パラメータが骨表面全体で測定され、その内部の海綿骨体積BMD値も測定されます。3D-DXAをQCTと比較した場合、皮質厚については0.33 mm、皮質密度については72 mg/cm³の平均絶対誤差が報告されており、相関係数は0.86以上です [2]。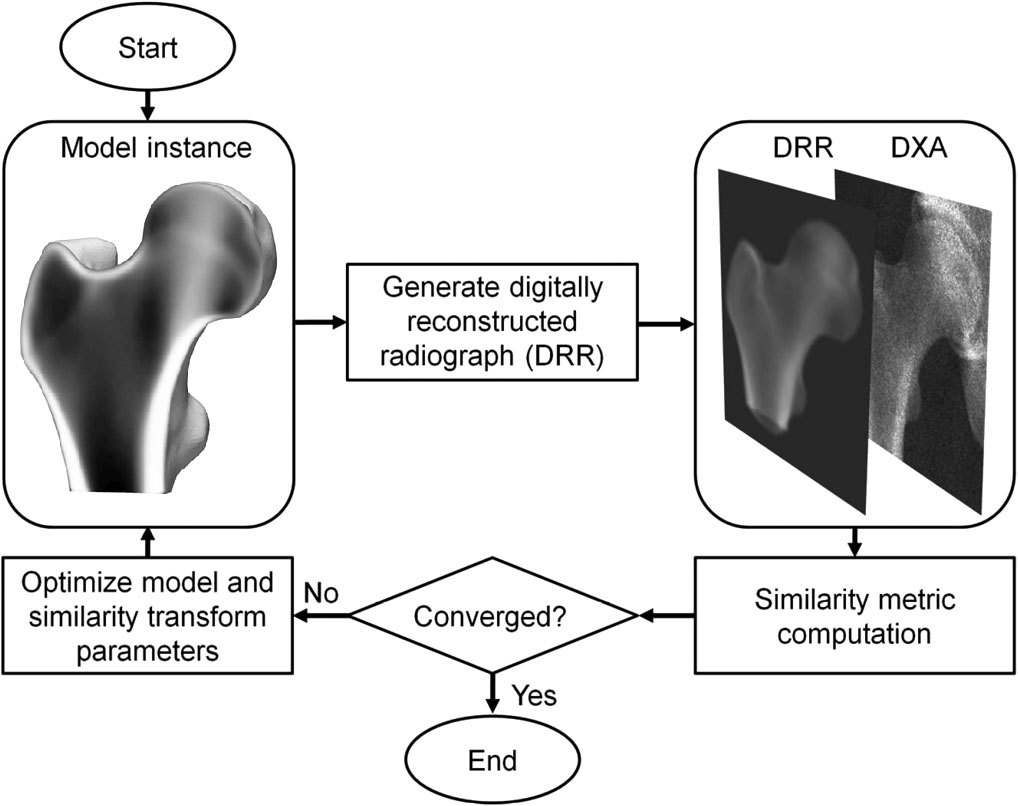
統計モデルを用いてDXA画像から骨構造を3D再構成するための他の方法も提案されていますが [4, 5]、2010年に最初に発表されたソフトウェア手法 [6] が、後にポンペウ・ファブラ大学(スペイン、バルセロナ)のスピンオフ企業であるGalgo Medical SL(スペイン、バルセロナ)によって3D-DXAとして商品化されました。このソフトウェアは後に、体積再構成から皮質厚と皮質骨密度(BMD)を測定するように拡張されました [2]。これは現在、Galgo Medical SLのさらなるスピンオフ企業であり、サービスとソフトウェアの両方を提供する3D-Shaper Medical SL(スペイン、バルセロナ)によって3D-Shaperとして商品化されています。このソフトウェアは、DMS Imaging(フランス、モーギオ)にライセンス供与され、同社のStratos/Medix DXAデバイスとともに3D-DXAとして販売されています。富士フイルム(東京、日本)は、富士フイルムブランド名FDX Visionary DXAの下でDMSによる同じDXAデバイスを販売しています。また、Imex Medical(ブラジル、サンジョゼ)はこれらのデバイスをElipseシリーズとして販売し、Radiología SA(スペイン、マドリッド)はRadioscore - DRとして販売しています。これらはすべて、3D-DXAを追加するオプションを含んでいます。
独自にソフトウェア手法を開発した者として [1]、私は他のユーザーや研究者には明らかではないかもしれないその内在的な限界について深い理解を持っています。Bone誌の編集者への手紙でこのソフトウェアの主な限界について説明しましたが [7]、3D-DXAは世界中で販売され使用され続けています。3D-ShaperはEU、日本、タイ、アルゼンチンの規制当局から承認を受けており、FDAから510(k)クリアランスを取得しており、患者の診断や治療決定への使用が許可されています。これらの承認を考慮すると、このソフトウェアに関するいくつかの誤解に対処し、明確にすることで、その限界についての理解を深めることが重要かつ緊急です。
方法論的限界
このセクションでは、3D-DXAの基礎となる方法論のいくつかの限界と、さらなる不正確さの一因となる可能性のある特定の実装の詳細について説明します。皮質パラメータは測定されていない
主な問題は、3D-DXAが皮質パラメータを導き出すためのDXA画像における皮質の可視性が欠如していることにあります。これを説明するために、Bone誌の編集者への手紙からの図を再検討したいと思います (図 2)。DXA画像は、骨表面のほとんどの場所で、皮質パラメータを導き出すための識別可能な皮質がないことを明確に示しています。これは骨投影像の輪郭に当てはまり (A)、特に2つの対向する皮質がX線検出器に対して垂直である場合に当てはまります (B)。これは、ピクセルサイズ0.3 x 0.25mmのGE iDXAスキャナーからのこの画像で明らかですが、ピクセルサイズ0.6 x 1.05mmのかなり低解像度の画像を生成する古いGE Prodigy DXAデバイスを使用した画像ではさらに顕著になりますが、これも3D-Shaperソフトウェアによってサポートされています。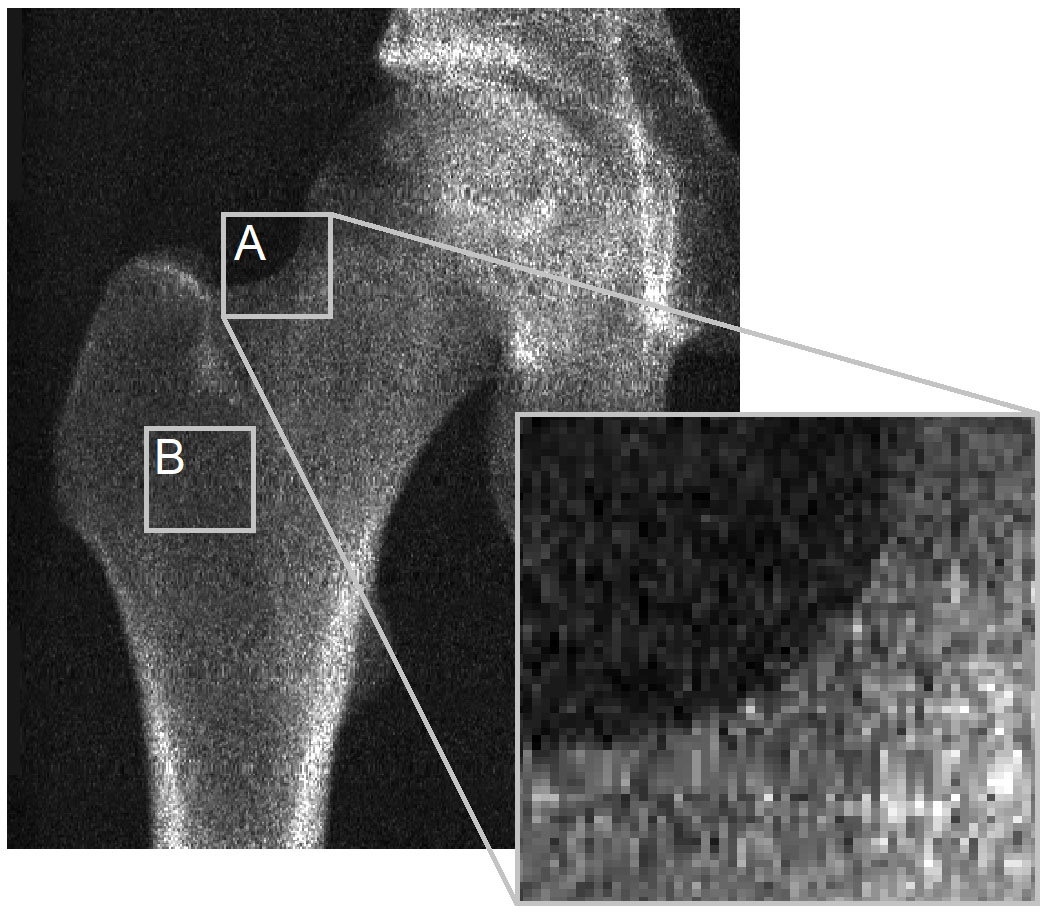
DXA画像から直接皮質パラメータを測定する代わりに、3D-DXAは形状と密度分布の統計モデルをDXA画像に登録し [7]、このモデルから皮質パラメータを抽出します [2]。このモデルは、標準的なCTスキャンのボクセルのハンスフィールド単位が校正ファントムを使用してBMD値に変換された、一連の校正済みQCTスキャンから構築されています。
モデルを構築するために、各QCTスキャンの近位大腿骨が最初にセグメンテーションされます。つまり、近位大腿骨の表面メッシュが構築されます。次に、主成分分析などの数学的手法が整列した大腿骨表面の点に適用され、平均形状と、重要度順に形状の変動を記述する一連の主成分(PC)が得られます。
密度分布の統計モデルを構築するために、QCTボリュームは平均形状に変形され、同じ統計的手法がボリューム内のBMD値に適用され、平均ボリュームとボリューム全体の骨密度の変動を記述する一連のPCが生成されます。
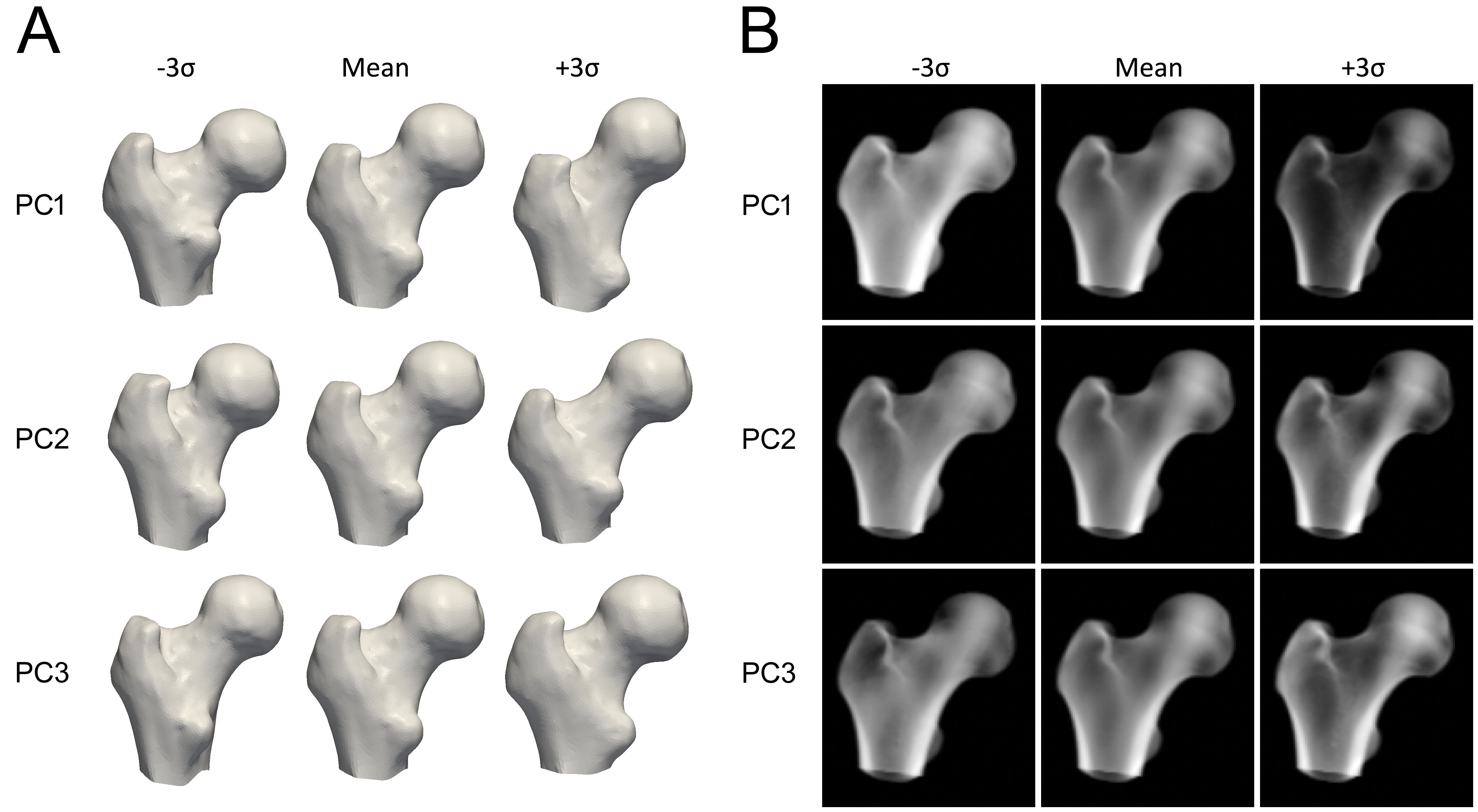
各主成分は、骨の形状または密度がどのように変化するかを表します (図 3)。モデルパラメータは、各成分が平均モデルにどれだけ追加されるかを決定する数値係数です。これらのパラメータを調整すると、形状または密度分布が変更され、新しいモデルインスタンスが生成されます。パラメータは、骨モデルが構築元のQCTスキャンのセットに従って常に現実的に見えるようにするために、通常、その変動の2.5〜3標準偏差に制限されます。モデルの新しいインスタンスを作成するために、密度ボリュームは、形状ポイントのサブセットで計算された薄板スプライン(TPS)変換を使用して、新しい形状に一致するように変形されます。
その後、3D-DXAは、モデルパラメータを変更して対応するモデルインスタンスを生成し、モデルの投影が所定の類似度メトリック閾値に従ってDXA画像と一致するまで、モデルを回転および平行移動することにより、3D再構成を反復的に生成します (図 1)。
その後、皮質厚と皮質密度は、QCTに対して提案されたデコンボリューションアプローチと同等の方法を使用して、モデルのインスタンスから測定されます [8]。したがって、皮質パラメータはDXA画像から測定されるのではなく、この画像に登録されたパラメトリックモデルから測定されます。
したがって、3D-DXAによって皮質パラメータのマップが提示され、皮質が測定されたはずのない場所の値がある場合 [9, 10, 11, 12, 13]、これらのマップは単にモデルインスタンスから導き出されたものです。3D-Shaper Medicalは、Bone誌の編集者への手紙に対する回答で、これらのパラメータは測定されたものではなく推定されたものであると説明していますが [14]、より正確な説明は、3D-DXAが複雑でエラーが発生しやすい統計的手法を使用してこれらの値を予測しているということです。DXA画像における皮質の可視性が限られているため、ソフトウェアは主に全体的な骨密度に依存しており、モデルが基づいているスペイン人集団の統計的特性によって制約されています。この限界の広範な影響については、レビューでさらに詳しく説明します。
使用されるモデルパラメータの数
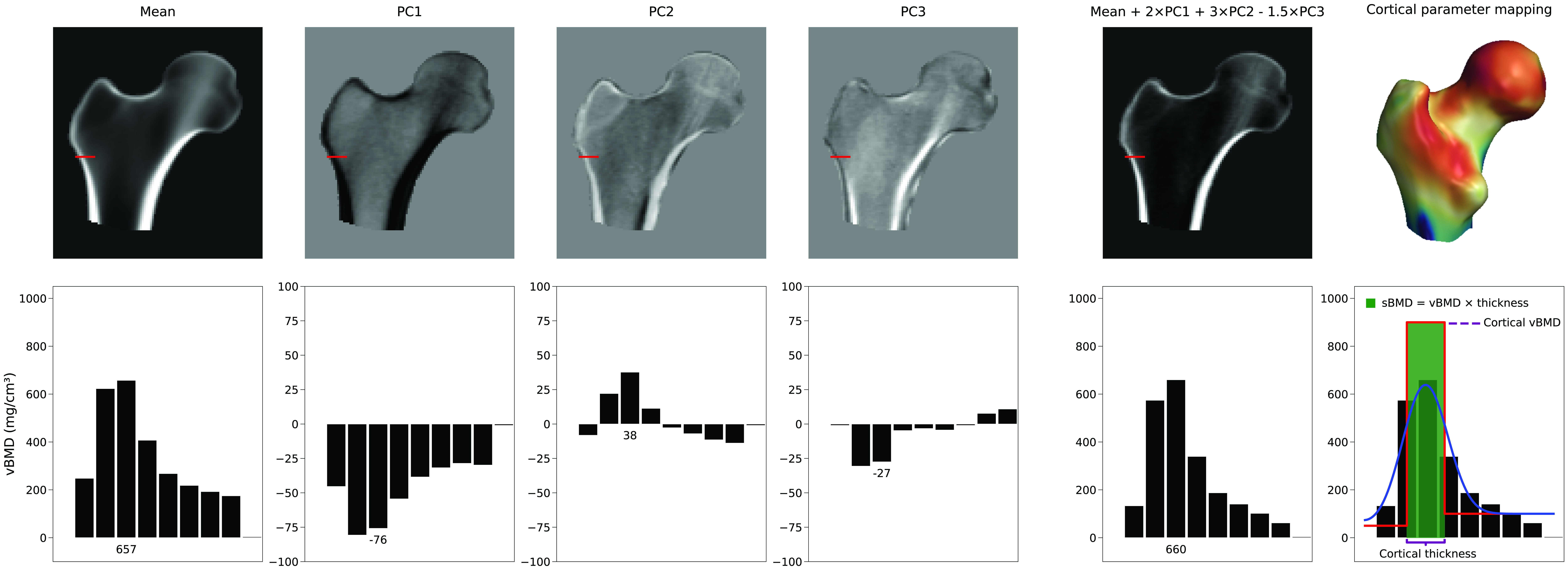
皮質厚を増加させる単一のパラメータはありません。代わりに、皮質の表現は、平均3Dボリュームと密度モデルのPCの線形結合に依存します。図 4では、平均と最初の3つのPCがどのように新しいモデルインスタンスを生成できるかの例を見ることができます。この例では、PCのスケーリング係数であるモデルパラメータの値は、それぞれ2、3、および-1.5です。PC1はどこでも密度を増減させますが、他のPCは記述的ではない方法で密度分布を変更します。この図は、平滑化された階段状モデルを適合させることにより、この新しいボリュームから皮質パラメータがどのように推定されるかも示しています。皮質厚、皮質密度、または海綿骨密度を選択的かつ独立して調整することは、達成可能であったとしても、複数の主成分の複雑な組み合わせ、ひいては多くのモデルパラメータを必要とします。通常、変動の主なモードを記述する主成分のサブセットが保持されます。これにより、BMD分布と表面点の変動が縮小されたパラメータセットに減少します。必要なモデルパラメータの数は、通常、その集団内の変動の95%を記述する形状および密度モデルパラメータの数を計算するか、累積分散プロットの「肘」を決定することによって決定されます。ただし、より正確なのは、どのPCをノイズと見なして破棄できるかを数学的に評価するHornの並列分析 [6] を使用することです。
使用されるパラメータの数は統計的モデリングアプローチにおいて重要な要素ですが、私の知る限り、この数、またはこの数を導出する方法は、3D-Shaper Medicalによって開示されたことはありません。Hornの並列分析によって決定されるようにパラメータの数が適切に大きくない場合、入力集団の大腿骨形態の変動の全範囲を正確に表すことができない可能性があります。さらに、このパラメータ数が研究と臨床応用で同じでない場合、報告された3D-DXAの精度と臨床的精度の間に乖離が生じます。
潜在的な集団バイアス
3D-DXAによって生成された3D骨モデルは、入力集団の変動に関する統計から導き出されます。3D-Shaperの場合、統計モデルは、平均年齢56.2 ± 12.1歳 [30歳 – 84歳] の骨代謝に影響を与える治療や疾患のない [15] スペイン人集団の女性81人と男性30人から構築されています [2]。大腿骨の形態が男女間で異なることは明らかですが、人口統計も重要な役割を果たします。たとえば、白人集団の大腿骨は、以前の研究で文書化されているように、アジア人集団の大腿骨とは大きく異なります [16]。白人集団から構築されたモデルは、アジア人集団のすべての被験者に適合する再構成を生成できるわけではありません。これは、統計モデルのパラメータが、スペイン人集団の平均大腿骨モデルの周囲の3標準偏差に制限されているためです。たとえば、ある研究では、QCTスキャンで測定した場合、白人女性の大腿骨頸部皮質厚は1.84±0.03 mmであるのに対し、韓国人女性では2.41±0.71 mmであると報告されています [17]。したがって、平均皮質厚2.41 mmの韓国人女性は、3標準偏差(1.75–1.93 mm)に制限された場合、白人集団の変動範囲外になります。この例は、モデルがターゲット集団を表すことの重要性を示しています。
3D-DXAによる測定値は日本人集団においてQCTと相関していますが [18]、これは単にすべてのパラメータが面積骨密度と相関しているためです。これは、患者固有の再構成が得られたことを意味するものではありません。特に、推定された皮質パラメータは、特にその空間分布に関して、真の値から大幅に逸脱する可能性があります。予測された大腿骨形状に欠陥がある場合でも、統計モデルの投影がDXA画像の骨と大部分重なる限り、皮質厚や皮質BMDを含む密度値はaBMDを反映します。aBMDが低い人は、どの集団においてもaBMDが高い患者と比較して、vBMDが低く、皮質BMDが低く、皮質が薄くなります。さらに、[18] は相関関係のみを報告しており、スペイン人集団から開発されたモデルを日本人集団に適用する場合に重大なバイアスが生じる可能性があり、臨床的な結果をもたらす可能性があります。この根本的な限界にもかかわらず、3D-DXAは現在、日本、タイ、インドなどの国々を含むアジアで販売されています。
統計モデルは、適用される集団でトレーニングする必要があります。これには、性別、民族、および潜在的に治療タイプごとに個別のモデルを構築するか、変動の全範囲を捉えるのに十分なパラメータが保持されていることを条件に、これらすべてのサブグループを1つのモデルに含めることが意味されます。この原則は、機械学習や人工知能ツールでは十分に確立されていますが [19, 20, 21, 22]、モデルが入力集団によって能動的に制約される統計的モデリングアプローチではさらに重要です。それにもかかわらず、3D-DXAは、モデル集団とは明らかに異なる集団を用いた研究で使用されています。これには以下が含まれます: プロのダンサー [9]、 サッカー選手と水泳選手 [23]、 肥満の若い女性 [24]、 黒人女性 [25]、 高骨量患者 [11]、 成人成長ホルモン欠乏症患者 [26] 乾癬性疾患患者 [27]、 2型糖尿病患者 [28]、 原発性副甲状腺機能亢進症患者 [10, 29]、 先端巨大症患者 [30]、 ダウン症候群患者 [13]、 スリーブ状胃切除術後 [31]、 脊髄損傷のある男性 [32]、 低骨量のオーストラリアの中高年男性 [33]、 そしておそらく最も懸念されるのは、小児がんサバイバー [34] です。
限られた再構成精度
3D-DXAは、複数の段階でエラーが発生しやすい非常に複雑な方法です。これらには、QCTキャリブレーション、統計モデルを構築するための変形可能登録、形状インスタンスへの密度モデルの変形、QCTとDXA間のBMDと解像度の不一致、およびファンビーム投影の代わりに等尺性投影によるモデル投影の簡略化による不正確さが含まれます。これらの要因のそれぞれが予測不可能な方法でバイアスを導入し、結果を歪める可能性があります。さらに、111人の成人スペイン人被験者という非常に小さなセットから統計モデルを構築する(形状、密度、皮質厚の分散を制限する)などの特定の実装の詳細は、このソフトウェアツールの適用可能性をさらに制限します。さらに、3D-ShaperがGEおよびHologicデバイスからの独自のデータファイルを正確に読み取ることができるかどうか、特にさまざまな体組成に対するキャリブレーションおよび補正係数を正確に適用することに関しては明確ではありません。これらの潜在的な不正確さは、3D-Shaperの結果が異なる集団に適用された場合や、集団の特性が時間の経過とともに変化する場合に影響を与える可能性があります。
近位大腿骨の形状と向きがDXA画像と完全に(サブミリメートルの精度内で)一致しない場合、サブミリメートルの精度内で皮質厚を抽出したり、皮質密度を抽出したりすることは不可能であるはずです。残念ながら、3D-DXAを用いた初期の研究ですでに示されているように、単一の2D DXA画像から完全な再構成を生成することは不可能です [35]。ここでは、2番目のビューを追加すると、形状誤差が1.3mmから0.9mmに、BMD誤差が4.4%から3.2%に減少することが示され、単一ビューからの再構成が明らかに最適ではないことが示されました。対照的に、コンピュータ断層撮影は、大腿骨の周囲のあらゆる角度から取得された何百もの投影を使用してボリュームを再構成します。したがって、QCTは皮質および海綿骨パラメータの独立した測定を可能にします。
3D-DXAは、モデルパラメータ検索がどこで収束したか、特に正しい回転が回復されなかった場合に、完全に異なる形態の大腿骨モデルを生成する可能性があります。これは、同日の繰り返しDXAスキャンを含む3D-DXAを使用した研究によって証明されているように大きく異なる可能性があり、予測強度の最大62%の違いが明らかになりました [36]。この研究では、要素ごとのBMDの違いが30 ± 50%に達することも報告されており、これらの数値は提供されていませんが、皮質パラメータの再現精度の低さにも反映される可能性があります。別の研究では、3D-ShaperとQCT密度値の相関も低いことが報告されており (r2 = 0.48) [37]、被験者固有の再構成精度が限られていることをさらに示しています。
3D-DXAを使用して大腿骨の構造パラメータを測定する研究では、3D-DXAボリュームから導出された測定値をCTからのグラウンドトゥルース測定値と相関させた場合、大腿骨頸部軸長についてr = 0.86の相関係数が報告されました [38]。これは、DXA画像で直接測定した場合 (r = 0.90, [39]) よりも悪いです。また、3D-DXAによって生成される頸部体幹角の精度は限られています (r = 0.71, [38])。この精度が欠如している明らかな理由は、[5] のように片側骨盤の2番目のモデルを追加することで解決できる可能性がありますが、半骨盤の重なりが再構成に干渉するのを防ぐために、再構成プロセスから大腿骨頭がマスクを使用して除外されるためです。
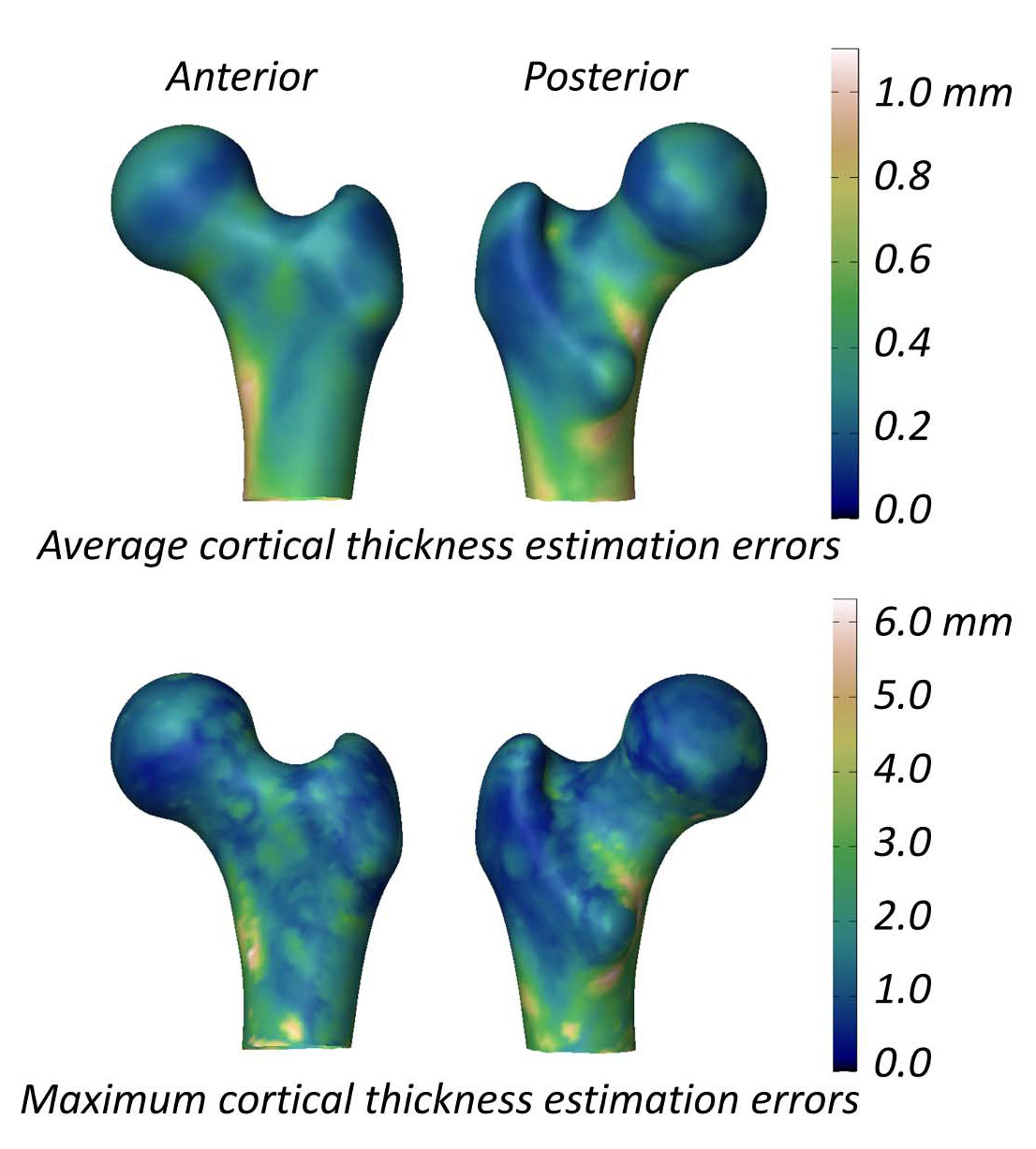
皮質パラメータを測定する3D-DXAの能力を評価する研究では、3D-DXAとQCTの間の平均(±標準偏差)皮質厚の差が、大腿骨頸部で0.04 ± 0.21mm、転子部で-0.07 ± 0.15 mmであると報告されています [2]。この研究では、大腿骨モデル表面全体の平均および最大絶対皮質厚推定誤差を示す図も提示されました(図5)。平均誤差は0.2 mmを超え、最大誤差は大腿骨表面の大部分で1 mmを超えています。比較として、18か月間のアレンドロネート治療後の皮質厚の変化を測定したQCT研究では、1.4%の増加、つまり約0.018 mmの皮質厚の増加が報告されました [40]。テリパラチドに関する3つの臨床試験から編集されたデータは、皮質厚が0.035 mm増加したことを示しました [41]。3D-DXAの誤差がこれらの典型的な治療誘発性の変化を超えていることを考えると、3D-DXA測定値は、真の治療主導の効果と方法論的ノイズを確実に区別できる可能性は低いです。言い換えれば、個人の皮質骨が変化しているように見える場合、これが真の生理学的変化によるものなのか、それとも固有の3D-DXA測定誤差によるものなのかは不明なままです。
面積骨密度(aBMD)に対する限定的な利点
3D-DXAが使用する統計的密度モデルでは、最初のモデルパラメータが変動の大部分を占めており、その値を増やすと、全体的な密度とすべての皮質パラメータの両方が増加します [7]。DXA画像には皮質に関する情報がほとんどないため、3D-DXAは主に全体的な密度、したがって最初のモデルパラメータに依存しています。その結果、皮質および海綿骨パラメータは本質的に相関しています。DXA画像で可視化されている骨幹の下内側および外側皮質からの寄与が多少あるかもしれませんが、3D-DXAによって返されるパラメータは、主に総面積BMD(aBMD)を反映しています。つまり、aBMDが増加すると、3D-DXA分析は、海綿骨BMD、皮質BMD、および皮質厚の同時増加を示します。実際、2024年の欧州石灰化組織学会議 [42] および2024年の米国骨代謝学会年次総会 [43] で発表された最近の研究では、3D-shaperパラメータがaBMDと高度に相関しており、したがって追加の骨折予測情報を提供しないことが確認されています。さらに、3D-DXA再構成はDXA画像に表示される全体的な大腿骨のシルエットを捉えていますが、頸部軸長と頸部体幹角を回復する能力は限られています。その結果、再構成された形状は主に一般的な骨サイズを反映しており、これはすでにaBMDによって提供されており、骨折強度の予測にはあまり寄与しません。これを例証するのは、3D-DXAからの強度予測がQCTと相関していた (r2 = 0.88) ものの、DXA画像からの大腿骨頸部aBMDのみによって予測された場合 (r2 = 0.87) よりも統計的に優れていなかったという発見です [37]。3D-Shaper Medicalによる研究でも同様の相関関係 (r2=0.86) が示されていますが、aBMDとの比較は除外されました [44]。日本人集団に関する別の研究では、3D-Shaperによる測定値は、股関節骨折の予測において股関節総aBMDよりも統計的に優れていませんでした [45]。
2D DXA画像に3D統計モデルを登録して大腿骨強度を予測する同様の方法に関する他の記事も公開されており [46, 47]、ある研究では骨折リスク予測においてaBMDよりも改善が見られました [48]。この方法は、完全な近位大腿骨形状を回復するのに役立つ追加の骨盤モデルの使用など、3D-DXAよりもいくつかの利点を提供する可能性があります。ただし、依然として多くの同じ方法論的限界の影響を受けます。
3D-DXAがaBMD単独よりも優れていない場合、DXA画像から直接測定されるaBMDとHSAパラメータの組み合わせを上回ることは間違いなくできません。これは、3D-DXAの根本的な限界を浮き彫りにし、臨床または研究環境での使用の正当性に疑問を投げかけます。それにもかかわらず、3D-Shaper Medicalは現在、3D-DXAベースの有限要素解析をサービスとして提供しています。
検証方法
3D-DXAの本質的な限界にもかかわらず、多数の出版物がその精度について肯定的な結果を報告しています。この不一致は、ソフトウェアの真の限界をあいまいにしがちな不適切な検証方法の採用に起因すると考えられます [21, 22]。以下のセクションでは、これらの検証に関する問題と、それらが3D-DXAの信頼性と臨床的有用性に対する認識をどのように生み出すかについて説明します。間違った性能評価指標
3D-Shaper Medicalは、DXA画像から3D-DXAによって生成された表面メッシュを、同じ被験者のQCTスキャンから手動で生成された表面メッシュと比較し、平均点対表面距離が0.93 mmであるという結果を得ました [2]。彼らはまた、皮質パラメータを比較し、皮質厚については0.33 mm、皮質密度については72 mg/cm³の平均絶対誤差を見つけました。ただし、これらの報告された誤差が許容できるかどうかを判断するための基準枠がないため、これらの指標は必ずしもソフトウェアの有効性を検証するものではありません。3D-DXAが評価されたもう1つの方法は、相関の使用によるものでした。海綿骨、皮質、および積分vBMD、ならびに皮質厚について、それぞれ0.86、0.93、0.95、および0.91の相関係数が報告されました。しかし、これらの強い相関関係は主に、3D-DXAモデルとQCTスキャンの両方のすべての皮質パラメータが全体的な密度と強く相関しているという事実によるものです。DXAスキャンで平均よりも高いaBMDを持つ患者は、平均して、海綿骨、皮質、および積分vBMDの増加、ならびに皮質の肥厚も示します。これらの相関結果は、患者固有の再構成を生成する際のソフトウェアの精度に関する決定的な証拠を提供するものではなく、実際には、その性能について誤解を招く印象を与える可能性があります。
相関関係は、3D-DXAを使用した人口ベースの研究を評価するためにも使用されます。3D-DXA分析がそのパラメータとテストされた要因の間、または異なる集団間での有意な相関関係を示す場合、同様の効果が見られます。これは、これらのパラメータが本質的に全体的なBMDと相関しており、したがってaBMDの変化または違いを直接反映しているためです。調査結果はもっともらしく見え、真の変化を密接に反映している可能性があります。たとえば、運動は全体的な密度と皮質骨ミネラル含有量の両方を増加させるため [49]、運動によりaBMDが増加した場合、3D-DXA分析から見かけ上もっともらしい結果が得られます。ただし、これらは実際の皮質パラメータ自体を反映しているのではなく、単にaBMDの根本的な変化または違いを反映しているだけです。その結果、これらの研究は3D-DXAの有効性について誤解を招く印象を与え、皮質パラメータを正確に測定する能力について誤った感覚を与える可能性があります。
より適切な評価には、皮質パラメータをブラインド推定器などの基本的なベースラインモデルと比較することが含まれます。ここで、ブラインド推定器とは、個々の変動を考慮せず、代わりに全集団からの平均値をすべての被験者に適用する、単純で素朴な推定方法を指します。たとえば、皮質厚のブラインド推定器は、個人のグループからの平均皮質厚マップを使用し、特定の特性に関係なく、すべてのケースに一律に適用します。このアプローチは、より高度な方法を評価するためのベースライン、または最小基準として機能します。洗練された方法は、少なくとも、この基本的な推定を上回る必要があります。私の知る限り、そのような評価はまだ公開されていません。
3D-DXAソフトウェアに関するほとんどの出版物は、成功した再構成のみを紹介しており、ソフトウェアの信頼性に対する誤った自信を生み出す可能性があります。3D-DXAの信頼性を定量的に評価するには、失敗率の評価を実行できます。以前の研究 [51] では、明示的には述べられていませんが、モデル投影とDXA画像の比較により不正確であると特定された再構成を除外した後、173人の被験者のうち80人のみが保持され、失敗率は50%を超えました。このような評価を可能にするために、3D-Shaperはモデル投影とDXA画像の並列表示を提供する必要があります。ただし、より堅牢な評価では、結果として得られるボリュームのレンダリングと断面図をグラウンドトゥルースQCTスキャンと比較し、独立した評価で失敗率を評価します。
場合によっては、実際の影響が正しいかどうかを無視しながら、単に有意な変化や違いを観察することが、3D-DXAが機能する証拠として提示されることがあります。私の編集者への手紙への回答として、治療群間の有意差が3D-DXAの有効性の証拠として提示されました。しかし、この評価において、著者らはTPTD治療後の皮質BMD変化について2つの異なる結果を提供しており、1つは有意な増加を示し [52]、もう1つは有意でない減少を示しています [15]。これらはどちらも、「薬効研究における誤解を招く結果」のセクションで説明するように、TPTD治療で予想される実際の変化を反映していません。
多重比較補正の欠如
このセクションでの懸念は、主に3D-DXAソフトウェア自体に関連するものではなく、3D-Shaper Medicalによって提供されるサービスとその後の出版物に関連しています。重要な問題は、3D-DXAパラメータ、特に皮質パラメータマップの変化や違いを報告する際に、多重比較補正が行われていないことにあります。多重比較補正の適用は、複数の異なる測定値を含むデータを分析する場合に不可欠です。3D-Shaperの場合、ソフトウェアは71個の骨パラメータを生成し、それぞれが別々の統計的検定を表します。ボンフェローニ補正などの多重比較の調整を行わないと、偶然に有意な結果が得られる可能性が高まり、誤った結論につながります。それにもかかわらず、3D-Shaperを使用した研究では、多重比較補正を一切適用せずに有意な変化や違いを報告することが多く [10, 24, 27, 28]、結果に対する不当な自信を生み出しています。特定のパラメータが測定されているものの報告されていない場合、これは誤解を招く可能性があります。これはpハッキングバイアスの一種であり [53]、実施された多数のテストによる偽陽性のリスクの増加を無視しながら、有意な結果が強調されます。
3D-Shaperを使用した研究が、骨表面の皮質パラメータの変化や違い、またはボリューム内のBMD値を示す色分けされたマップを提示する場合にも、同様の問題が発生します。これらの場合、各頂点またはボクセルは個別の統計的検定を表し、有意性は多くの場合、各点での単純なt検定によって決定されます [9, 10, 11, 12, 13, 28, 52, 54, 55]。このアプローチは、色分けされたマップ内の見かけ上有意な領域を強調表示し、実際には存在しない局所的な変化や違いの錯覚を生み出します。色分けされた断面図を通じてボリューム内の変化や違いを提示する場合、ボクセルレベルでの統計的有意性は通常まったく提供されません [9, 11, 30, 52, 54, 55, 56]。同様に、これは実際にはランダムな変動の結果にすぎない場合に、実際の変化を示唆しています。その結果、これらの色分けされたマップは、治療や介入の影響について過度に楽観的な印象を与え、効果がない可能性のある場所で誤って有効性を示唆する可能性があります。
不十分な多重比較補正による偽陽性の問題は、神経画像分野において根強い課題でした [57]。これに対処するために、神経画像コミュニティは、骨表面の皮質骨の変化やQCTスキャンのボクセルの密度変化を調べる研究にも適用できるソリューションを開発しました。Pooleら [58] は、SurfStat (http://math.mccgill.ca/keith/surfstat/) を使用して、多重比較補正のためにランダムフィールド理論を適用し、骨表面の各点での皮質パラメータの違いが統計的に有意かどうかをテストする方法について説明しています。Statistical Parametric Mappingライブラリ (https://www.fil.ion.ucl.ac.uk/spm/) やFMRIBソフトウェアライブラリ (https://fsl.fmrib.ox.ac.uk) など、ボクセルベースの分析のための同様のパッケージが存在します。これらのツールを使用すると、3D-DXAを使用した研究の統計的厳密性が向上しますが、観察された変化や違いは、依然としてすべてのパラメータとaBMDの相関関係を主に反映します。
影響
3D-DXAの使用は、研究と臨床診療の両方に広範囲にわたる影響を及ぼします。次のセクションでは、これらの課題について詳しく説明します。薬効研究における誤解を招く結果
ほとんどの研究では、3D-DXAの結果は皮質で予想されるものと一致します。これは、健康な個人の皮質パラメータが通常aBMDと相関しているためです。これは多くの場合、一見もっともらしい結果につながります。しかし、変化が従来のパターンに従わない場合、このアプローチには欠陥が生じます。この方法は、正常な骨リモデリングおよび再構築が変化し、すべてのパラメータの通常の比例的な増減が発生しない可能性がある薬物試験において特に問題となります。実例となるのはテリパラチドに関する研究で、3D-DXAは、プラセボと比較して皮質vBMDの有意な増加を含むすべての皮質パラメータの増加を示しました [52]。対照的に、QCTに適用された同等の皮質測定技術を使用すると、同じ18か月のテリパラチド治療後に皮質BMDが有意に減少することが示されました。これは、3つの異なる臨床試験のデータで一貫して見られました [41]。この減少は、マイクロCTを使用しても観察されるように、皮質多孔性の増加をもたらすリモデリング率の増加に起因します [59]。
以前の研究では、3D-Shaper Medicalはテリパラチドに応答して皮質BMDの減少を報告しました [15]。これは著者によって減少として指摘されましたが、変化は統計的に有意ではありませんでした。より最近の独立した研究でも、3D-DXA分析を使用してテリパラチド治療に応答した皮質BMDの有意な変化は見つかりませんでした [60]。DXA画像で部分的に見える骨幹の皮質からの何らかの影響がある可能性があります。3D-DXAの性質上、モデルパラメータは密度分布に全体的に影響を与えるため、この領域のaBMDの減少は、皮質が見えない領域を含む大腿骨モデル全体に投影された可能性があります。しかし、これはQCT研究で観察された皮質BMDの正しい有意な減少にはつながりませんでした。
テリパラチド(TPTD)ですべての皮質パラメータの増加を報告した研究では、アバロパラチドも並行して評価され、後者ではすべてのパラメータでさらに大きな増加が見られました [52]。3D-DXA分析を使用した追跡研究でも、アバロパラチド治療後に皮質BMDの有意な増加が報告されました [55, 56]。アバロパラチドはTPTDと同様の作用機序を共有し、骨リモデリング率を増加させることを考えると、それが皮質BMDの減少につながることも合理的に予想されます。実際、QCTを使用した研究では、35人の患者で同様の期間のアバロパラチド治療後に皮質BMDの減少が観察されましたが [61]、減少は統計的に有意ではありませんでした。これは、3D-DXA研究が不正確な変化を生み出しただけでなく、アバロパラチドの効果について過度に好意的な評価をもたらした可能性が高いことを示唆しています。
Lewieckiらによる研究 [54] は、不一致の皮質変化を測定する際の3D-DXAの限界をさらに示しています。彼らの3D-DXA分析では、ロモソズマブに応答してすべての皮質パラメータの増加が報告されました。対照的に、以前のQCT分析では、同じ治療後に皮質BMDの増加は見られませんでした [62]。著者らは次のように述べています。「ロモソズマブ治療についてQCTおよびDXAベースの3D-SHAPERによって得られたデータが、股関節の積分および海綿骨vBMDについては研究間で類似していたが、皮質vBMDについては異なっていた理由は不明です。」同じ著者の何人かが見たBone誌の編集者への手紙ですでにこの不一致が説明および予測されていたことを考えると [7]、3D-DXAの能力と限界に関する誤解が根強く残っているようです。その結果、この誤解はおそらく再び、薬物の有効性について過度に楽観的な評価につながっています。
これらの研究は、皮質骨および海綿骨の変化のカラーマップを提示することにより、潜在的に不正確な結果をさらに広めます。3D-DXAは、各モデルパラメータが密度分布に全体的に影響を与えること、またこれらの変化がDXA画像では見えないこともあり、局所的または焦点的な変化を測定することはできません。これらの研究で多重比較補正を適用しなかったことは、マップ内の見かけ上有意な領域が実際にははるかに有意性が低いため、結果をさらに弱体化させ、さまざまな薬物について過度に楽観的な評価につながります。
患者管理
3D-Shaperソフトウェアは71の測定値を生成できますが、臨床的に承認されたバージョンでは、全体的な海綿骨vBMDと皮質sBMD、および関連するTスコアとZスコアのみが生成されます。TスコアとZスコアがどの集団から導出されているかは明らかではありませんが、3D-Shaper Medicalによるウェビナーでは白人の参照データが記載されています [63]。参照プロットは以前にスペイン [64] およびアルゼンチン [65] の集団に対して作成されており、どちらも図6に再現されています。ただし、これらのプロットは互いに異なり、3D-Shaperソフトウェアによって生成された図とも異なるように見えます。3D-Shaper Medical、DMS Imaging、およびその代理店は、この集団やこれらのデータがどのように導出されたかを開示していません。しかし、日本での3D-Shaperの代理店である東洋メディック株式会社(東京、日本)によって、日本市場向けに承認された3D-Shaperソフトウェアは日本人集団からの参照データを使用していないことが確認されています。白人とアジア人の集団間の皮質および海綿骨パラメータの大きな違いを考慮すると [68]、さらなる検証なしに日本でこれらのTスコアとZスコアを適用することは賢明ではないようです。それらの妥当性は、適用されるすべての集団についても確認する必要があります。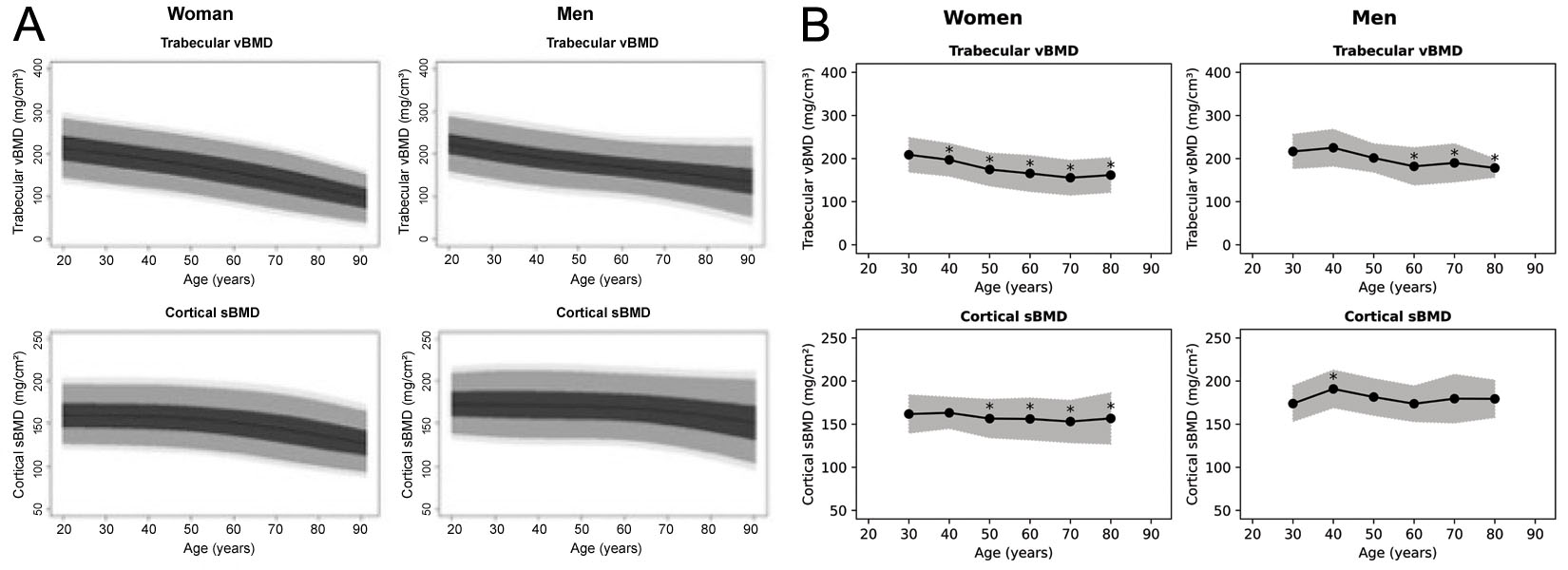
ウェビナー [66] で、3D-Shaper Medicalは、3D-Shaperが低い皮質sBMDと非常に低い海綿骨vBMDをもたらした潜在的な臨床使用を提案しました。表によると、テリパラチドは皮質骨よりも海綿骨を改善するため、テリパラチドが最適な治療法であると言われました。ただし、この表に基づくと、臨床医は椎骨aBMDを無視すれば、自然にテリパラチドよりもデノスマブまたはアバロパラチドを選択するでしょう。
3D-DXAはおそらく、通常のDXA TスコアおよびZスコア評価と一緒にのみ使用されます。したがって、高リスクの個人を見逃す危険性は最小限になります。ただし、3D-DXAに関連するエラーのため、皮質sBMDと海綿骨vBMDは常にわずかに高いか低くなります。治療の境界にいる患者では、これにより臨床医が動揺し、aBMDだけでは示されない骨粗鬆症治療薬を投与する可能性があります。
海綿骨スコア(TBS)に関する研究は、この追加評価が続発性骨粗鬆症の治療決定に大きく影響することを示しています [67]。その研究では、BMD測定値に異常のない患者の21〜25.5%がTBSによって示される骨質が悪く、治療決定が変更されました。同様の効果が3D-DXAでも発生し、過剰処方などの意図しない結果につながる可能性があります。表が使用された場合、これにより臨床医がある薬を別の薬よりも選択するように動揺する可能性もあります。
3D-Shaper Medicalは、選択された治療が実際に皮質および海綿骨コンパートメントに期待される効果をもたらしているかどうかを判断するために患者を監視できるとも述べています。しかし、3D-DXAの誤差が予想される変化よりも大きく、再現性が低いことを考慮すると [36]、追跡3D-DXA評価で見られる変化が実際の効果によるものなのか、単に3D-DXA固有の誤差によるものなのかを確認することはできません。臨床医がこれらの結果を信頼すると、不必要に治療を変更するように動揺する可能性があります。
(A)
| 2D DXA(股関節合計)aBMD | 3D-DXA (3D-Shaper) 海綿骨vBMD | 3D-DXA (3D-Shaper) 皮質sBMD | |
|---|---|---|---|
| アレンドロネート | + | + | + |
| デノスマブ | ++ | ++ | ++ |
| ゾレドロン酸 | + | + | ++ |
| テリパラチド [15, 52, 55*, 56] | + | ++ | = |
| アバロパラチド | ++ | ++ | ++ |
| ロモソズマブ | +++ | +++ | +++ |
(B)
| aBMD | vBMD | sBMD | |
|---|---|---|---|
| テリパラチド [52, 56] (18か月) | ++ (3.3%) | ++/+++ (9%) | + (1.8%) |
| テリパラチド [15] (24か月) | = (p > 0.05) | ++/+++ (5.9%) | = (p > 0.05) |
| テリパラチド [60] (24か月) | = (p > 0.05) | ++/+++ (>14%) | = (p > 0.05) |
(C)
| 記号 | (股関節合計)aBMD | 海綿骨vBMD | 皮質sBMD |
|---|---|---|---|
| +++ | Δ > n/a % | Δ > n/a % | Δ > n/a % |
| ++ | 2 < Δ ≤ n/a % | 4 < Δ ≤ n/a % | 2 < Δ ≤ n/a % |
| + | 0.5 < Δ ≤ 2 % | 0.5 < Δ ≤ 4 % | 0.5 < Δ ≤ 2 % |
| = | -0.5 ≤ Δ ≤ 0.5 % | -0.5 ≤ Δ ≤ 0.5 % | -0.5 ≤ Δ ≤ 0.5 % |
| - | -2 ≤ Δ < -0.5 % | -4 ≤ Δ < -0.5 % | -2 ≤ Δ < -0.5 % |
| -- | Δ < -2 % | Δ < -4 % | Δ < -2 % |
3D-DXAの臨床バージョンでは、さまざまな解剖学的領域の皮質sBMDに関する情報は提供されませんが、骨表面全体のsBMDの色分けされた3Dモデルが表示されます。3D-Shaper Medicalはその後、これが局所的な脆弱性を検出するために使用できることを示唆しています [66]。残念ながら、3D-DXAは患者固有の皮質マップを再構成できません。これについての直感的な説明については、図2を再度参照します。したがって、3D-DXA皮質マップが局所的な欠陥を示唆している場合、これらはモデルの統計的に妥当な出力である可能性がありますが、患者の実際の解剖学的構造には対応していません。これにより、不必要または不適切な治療決定につながる可能性があります。
3D-Shaperソフトウェアは、510(k)の市販前届出プロセスを通じてFDAの承認も受けています [68]。3D-Shaper Medicalは、断面積(CSA)、断面慣性モーメント(CSMI)、断面係数(Z)、座屈比(BR)、皮質表面骨密度(sBMD)、海綿骨体積骨密度(vBMD)、および積分vBMDを、以前にFDAの承認を受けたHologic Inc.の股関節構造解析(HSA)ソフトウェアからの同様の測定値と比較する相関研究を使用してこれを取得しました。
注目すべきことに、頸部軸長と頸部体幹角はこの評価に含まれておらず、したがってこれらのパラメータの使用はFDAによって承認されていません。国際臨床骨密度学会(ISCD)のガイドラインでは、股関節軸長を除き、股関節骨折のリスクを評価するためにHSAパラメータを使用すべきではないと推奨されていることに注意する必要があります [69]。さらに、この規制当局の承認には、測定値を参照データと比較するためのTスコアまたはZスコアは含まれていません。これは、米国における3D-Shaperの臨床的適用性に関する懸念を引き起こします。
最後に、3D-Shaperパラメータは、Hologic QDR X線骨密度計のHSAオプションと実質的に同等であると見なされました。FDAは、3D-Shaperが他のDXAスキャナーで使用できるかどうかを確認できず、米国における他のデバイスとの互換性の問題は未解決のままです。
考察
要約すると、3D-DXAは非常に詳細に見えるさまざまな骨パラメータを生成しますが、明確な皮質または海綿骨の特性を測定するのではなく、主に全体的な面積BMDを反映しています。ソフトウェアは、皮質および海綿骨の変化がaBMDに比例する集団では真の値と相関する結果をもたらす可能性がありますが、患者固有の測定値や局所的な変化を捉えるには不十分です。この制限は、皮質および海綿骨パラメータが逆に変化する可能性があり、3D-DXAがQCTで観察されるこれらの真の変化を反映できないアナボリック療法などのシナリオで特に顕著です。これは、日常的な臨床ケアまたは信頼できる研究ツールとしての使用に重大な懸念を引き起こします。3D-DXAは当初、積分vBMDの推定値を提供することで骨粗鬆症をより適切に診断するために開発されました [70, 71]。皮質および海綿骨コンパートメントを個別に評価しようとしないことで、3D-DXAによって生成される積分vBMDは依然として有効な推定値を表す可能性があります。その後、この方法は、モデルパラメータが統計モデルの形態を完全に記述しているため、モデルパラメータを直接分析することで骨折リスクの推定を改善しようとするように拡張されました [51, 72, 73, 74]。しかし、このレビューで詳述されているように、3D-DXAの主要な制限は依然として存在し、その精度と信頼性を損なっています。
この研究は、3D-Shaper Medical、DMS Imaging、Fujifilmなど、3D-DXAを商品化している企業の透明性の欠如によって制限されていました。その結果、公開されている情報と、この方法論を開発した私自身の経験に依存しています。読者の皆様には、3D-DXAおよび3D-Shaperの開示されていない側面について、これらの企業またはその担当者に説明を求めることをお勧めします。
専門学会からの評価は、3D-DXAの妥当性に関する独立した評価を提供し、その使用に関する公式の推奨事項を確立することにより、貴重なガイダンスを提供する可能性があります。DXAベストプラクティスに関する国際ワーキンググループによる二重エネルギーX線吸収測定法の実践ガイドラインの更新では、3D-DXAに関して「臨床診療におけるこれらの新しい画像技術の適用に関する推奨を行うには、より多くの証拠が必要である」と述べられていますが [75]、推奨の根拠となる十分な証拠が現在あると考えており、このレビューがその点で役立つことを願っています。
結論として、3D-DXAの基本的な制限を考慮すると、3D-DXAによって提供される皮質および海綿骨パラメータは研究目的で使用されるべきではなく、診断、モニタリング、または治療決定支援などの臨床応用にも適していないというのが私の専門的な評価です。
著者貢献
TWは、概念化、データキュレーション、形式分析、調査、方法論、リソース、視覚化、および原稿の執筆に貢献しました。資金提供
この研究のための資金提供はありませんでした。データ利用可能性
この記事で提示されたすべてのデータは、リクエストに応じて著者から入手できます。利益相反
著者は、3D-DXAソフトウェアの基礎となる方法論に関連する特許の共同発明者です。著者は、商用3D-DXAソフトウェアコード、統計モデル、および販促資料の知的財産権と起源に関する議論に関与してきました。著者は、3D-Shaper Medicalまたは3D-DXAの商業利用に関与している他の企業とは提携しておらず、株式、ロイヤルティ、またはその他の金銭的報酬を受け取っていません。著者は、教育フォーラムでUCBのために講演を行い、Amgen Inc.およびLillyから研究助成金の支援を受けています。この記事で表明された見解は著者単独のものであり、方法論と利用可能な科学的証拠の批判的評価に基づいています。参考文献
- Whitmarsh T (2012). 3D Reconstruction of the Proximal Femur and Lumbar Vertebrae from Dual-Energy X-Ray Absorptiometry for Osteoporotic Risk Assessment
- Humbert L, Martelli Y, Fonolla R, et al. (2017). 3D-DXA: Assessing the Femoral Shape, the Trabecular Macrostructure and the Cortex in 3D from DXA images. IEEE Transactions on Medical Imaging, 36(1), 27–39.
- Whitmarsh T, Humbert L, De Craene M, et al. (2011). Reconstructing the 3D Shape and Bone Mineral Density Distribution of the Proximal Femur From Dual-Energy X-Ray Absorptiometry. IEEE Transactions on Medical Imaging, 30(12), 2101–2114.
- Ahmad O, Ramamurthi K, Wilson KE, et al. (2010). Volumetric DXA (VXA): A new method to extract 3D information from multiple in vivo DXA images. Journal of Bone and Mineral Research, 25(12), 2744–2751.
- Väänänen SP, Grassi L, Flivik G, et al. (). Generation of 3D shape, density, cortical thickness and finite element mesh of proximal femur from a DXA image. Medical Image Analysis, 24(1).
- Whitmarsh T, Humbert L, De Craene M, et al. 3D bone mineral density distribution and shape reconstruction of the proximal femur from a single simulated DXA image: an in vitro study. In: Dawant BM, Haynor DR, eds. Medical Imaging 2010: Image Processing. Vol. 7623. SPIE; 2010:76234U.
- Whitmarsh T. Concerns regarding the use of 3D-DXA. Bone. 2021;149:115939.
- Treece G, Gee A (2015). Independent measurement of femoral cortical thickness and cortical bone density using clinical CT. Medical Image Analysis, 20(1), 249–264.
- Freitas L, Amorim T, Humbert L, et al. (2018). Cortical and trabecular bone analysis of professional dancers using 3D-DXA: a case–control study. Journal of Sports Sciences, 37(1), 82–89.
- Gracia-Marco L, García-Fontana B, Ubago-Guisado E, et al. (2019). Analysis of Bone Impairment by 3D DXA Hip Measures in Patients With Primary Hyperparathyroidism: A Pilot Study. The Journal of Clinical Endocrinology \& Metabolism, 105(1), 175–184.
- Orduna G, Humbert L, Fonolla R, et al. (2018). Cortical and Trabecular Bone Analysis of Patients With High Bone Mass From the Barcelona Osteoporosis Cohort Using 3-Dimensional Dual-Energy X-ray Absorptiometry: A Case-Control Study. Journal of Clinical Densitometry, 21(4), 480–484.
- Gifre L, Humbert L, Muxi A, et al. (2017). Analysis of the evolution of cortical and trabecular bone compartments in the proximal femur after spinal cord injury by 3D-DXA. Osteoporosis International, 29(1), 201–209.
- García Hoyos M, Humbert L, Salmón Z, et al. (2019). Analysis of volumetric BMD in people with Down syndrome using DXA-based 3D modeling. Archives of Osteoporosis, 14(1).
- Beck B, Harding A, Weeks B, et al. (2021). Response to “Concerns regarding the use of 3D-DXA”. Bone, 149, 115936.
- Winzenrieth R, Humbert L, Di Gregorio S, Bonel E, García M, Del Rio L. Effects of osteoporosis drug treatments on cortical and trabecular bone in the femur using DXA-based 3D modeling. Osteoporos Int.2018;29(10):2323–2333.
- Cummings SR, Cauley JA, Palermo L, et al. Racial differences in hip axis lengths might explain racial differences in rates of hip fracture. Osteoporos Int.1994;4(4):226–229.
- Kim KM, Brown JK, Kim KJ, et al. Differences in femoral neck geometry associated with age and ethnicity. Osteoporos Int. 2010;22(7):2165–2174.
- Sone T, Humbert L, Lopez M, et al. (2022). Assessment of femoral shape, trabecular and cortical bone in Japanese subjects using DXA-based 3D modelling. JOURNAL OF BONE AND MINERAL RESEARCH, 37, 214--214.
- Varoquaux G, Cheplygina V (2022). Machine learning for medical imaging: methodological failures and recommendations for the future. npj Digital Medicine, 5(1).
- Hadjiiski L, Cha K, Chan H, et al. (). AAPM task group report 273: Recommendations on best practices for AI and machine learning for computer‐aided diagnosis in medical imaging. Medical Physics, 50(2).
- Huisman M (2024). When AUC-ROC and accuracy are not accurate: what everyone needs to know about evaluating artificial intelligence in radiology. European Radiology, 34(12), 7892–7894.
- Gallifant J, Bitterman DS, Celi LA, et al. (2024). Ethical debates amidst flawed healthcare artificial intelligence metrics. npj Digital Medicine, 7(1).
- Amani A, Bellver M, del Rio L, et al. (2022). Femur 3D-DXA Assessment in Female Football Players, Swimmers, and Sedentary Controls. International Journal of Sports Medicine, 44(06), 420–426.
- Maïmoun L, Renard E, Humbert L, et al. (2021). Modification of bone mineral density, bone geometry and volumetric BMD in young women with obesity. Bone, 150, 116005.
- Jain RK, López Picazo M, Humbert L, et al. (2025). Bone Structural Parameters as Measured by 3-Dimensional Dual-Energy X-Ray Absorptiometry Are Superior in Black Women and Demonstrate Unique Associations With Prior Fracture Versus White Women. Endocrine Practice, 31(2), 152–158.
- Gracia-Marco L, Gonzalez-Salvatierra S, Garcia-Martin A, et al. (2021). 3D DXA Hip Differences in Patients with Acromegaly or Adult Growth Hormone Deficiency. Journal of Clinical Medicine, 10(4), 657.
- Toussirot E, Winzenrieth R, Aubin F, et al. (2024). Areal bone mineral density, trabecular bone score and 3D-DXA analysis of proximal femur in psoriatic disease. Frontiers in Medicine, 11.
- Ubago-Guisado E, Moratalla-Aranda E, González-Salvatierra S, et al. (2023). Do patients with type 2 diabetes have impaired hip bone microstructure? A study using 3D modeling of hip dual-energy X-ray absorptiometry. Frontiers in Endocrinology, 13.
- Guerra FS, Palladino N, Winzenrieth R, et al. (2024). Advanced 3D-DXA insights into bone density changes in hyperparathyroidism. Journal of Diabetes \& Metabolic Disorders, 23(2), 2191–2199.
- Kužma M, Vaňuga P, Ságová I, et al. Non-invasive DXA derived bone structure assessment of acromegaly patients: a cross sectional study. Eur J Endocrinol. 2019;180(3):201–211.
- Maïmoun L, Aouinti S, Puech M, et al. Modification of bone architecture following sleeve gastrectomy: a five-year follow-up. J Bone Miner Res. 2024;40(2):251–261.
- Maïmoun L, Gelis A, Serrand C, et al. (2023). Alteration of Volumetric Bone Mineral Density Parameters in Men with Spinal Cord Injury. Calcified Tissue International, 113(3), 304–316.
- Harding AT, Weeks BK, Lambert C, et al. (2020). Effects of supervised high-intensity resistance and impact training or machine-based isometric training on regional bone geometry and strength in middle-aged and older men with low bone mass: The LIFTMOR-M semi-randomised controlled trial. Bone, 136, 115362.
- Gil-Cosano JJ, Ubago-Guisado E, Sánchez MJ, et al. (2020). The effect of an online exercise programme on bone health in paediatric cancer survivors (iBoneFIT): study protocol of a multi-centre randomized controlled trial. BMC Public Health, 20(1).
- Humbert L, Whitmarsh T, De Craene M, et al. (2010). 3D reconstruction of both shape and Bone Mineral Density distribution of the femur from DXA images. 2010 IEEE International Symposium on Biomedical Imaging: From Nano to Macro, 456–459.
- O’Rourke D, Beck BR, Harding AT, et al. (2021). Assessment of femoral neck strength and bone mineral density changes following exercise using 3D-DXA images. Journal of Biomechanics, 119, 110315.
- Dudle A, Gugler Y, Pretterklieber M, et al. (2023). 2D-3D reconstruction of the proximal femur from DXA scans: Evaluation of the 3D-Shaper software. Frontiers in Bioengineering and Biotechnology, 11.
- Clotet J, Martelli Y, Di Gregorio S, et al. (2018). Structural Parameters of the Proximal Femur by 3-Dimensional Dual-Energy X-ray Absorptiometry Software: Comparison With Quantitative Computed Tomography. Journal of Clinical Densitometry, 21(4), 550–562.
- Ramamurthi K, Ahmad O, Engelke K, et al. (2011). An in vivo comparison of hip structure analysis (HSA) with measurements obtained by QCT. Osteoporosis International, 23(2), 543–551.
- Whitmarsh T, Treece GM, Gee AH, et al. (2015). Mapping Bone Changes at the Proximal Femoral Cortex of Postmenopausal Women in Response to Alendronate and Teriparatide Alone, Combined or Sequentially. Journal of Bone and Mineral Research, 30(7), 1309–1318.
- Whitmarsh T, Treece GM, Gee AH, et al. (2016). The Effects on the Femoral Cortex of a 24 Month Treatment Compared to an 18 Month Treatment with Teriparatide: A Multi-Trial Retrospective Analysis. PLOS ONE, 11(2), e0147722.
- Huininga K, Koromani F, Zillikens M, et al. (2024). Use of 3D Shaper Analysis for the Assessment of Fracture Risk in a Population-Based Setting. JBMR Plus, 8(Supplement\_1), i1--i340.
- Huininga K, Koromani F, Zillikens MC, et al. (2024). Use of 3D Shaper Analysis for the Assessment of Fracture Risk in a Population-based Setting. ASBMR 2024 Annual Meeting Abstracts and Abstract Book.
- Qasim M, López Picazo M, Ruiz Wills C, et al. (2024). 3D-DXA Based Finite Element Modelling for Femur Strength Prediction: Evaluation Against QCT. Journal of Clinical Densitometry, 27(2), 101471.
- Iki M, Winzenrieth R, Tamaki J, et al. (2021). Predictive ability of novel volumetric and geometric indices derived from dual-energy X-ray absorptiometric images of the proximal femur for hip fracture compared with conventional areal bone mineral density: the Japanese Population-based Osteoporosis (JPOS) Cohort Study. Osteoporosis International, 32(11), 2289–2299.
- Grassi L, Väänänen SP, Ristinmaa M, et al. Prediction of femoral strength using 3D finite element models reconstructed from DXA images: validation against experiments. Biomechanics and Modeling in Mechanobiology, 16(3).
- Grassi L, Fleps I, Sahlstedt H, et al. (). Validation of 3D finite element models from simulated DXA images for biofidelic simulations of sideways fall impact to the hip. Bone, 142.
- Grassi L, Väänänen SP, Jehpsson L, et al. (). 3D Finite Element Models Reconstructed From 2D Dual‐Energy X‐Ray Absorptiometry (DXA) Images Improve Hip Fracture Prediction Compared to Areal BMD in Osteoporotic Fractures in Men (MrOS) Sweden Cohort. Journal of Bone and Mineral Research, 38(9).
- Grassi L, Väänänen SP, Voss A, et al. DXA-based 3D finite element models predict hip fractures better than areal BMD in elderly women. Bone. 2025;195:117457.
- Allison SJ, Poole KES, Treece GM, et al. (2015). The Influence of High-Impact Exercise on Cortical and Trabecular Bone Mineral Content and 3D Distribution Across the Proximal Femur in Older Men: A Randomized Controlled Unilateral Intervention. Journal of Bone and Mineral Research, 30(9), 1709–1716.
- Whitmarsh T, Fritscher KD, Humbert L, et al. (2011). Hip fracture discrimination using 3D reconstructions from Dual-energy X-ray Absorptiometry. 2011 IEEE International Symposium on Biomedical Imaging: From Nano to Macro, 1189–1192.
- Winzenrieth R, Ominsky M, Wang Y, et al. (2021). Differential effects of abaloparatide and teriparatide on hip cortical volumetric BMD by DXA-based 3D modeling. Osteoporosis International, 32(3), 575–583.
- England JR, Cheng PM (2019). Artificial Intelligence for Medical Image Analysis: A Guide for Authors and Reviewers. American Journal of Roentgenology, 212(3), 513–519.
- Lewiecki EM, Betah D, Humbert L, et al. (2024). 3D-modeling from hip DXA shows improved bone structure with romosozumab followed by denosumab or alendronate. Journal of Bone and Mineral Research, 39(4), 473–483.
- Winzenrieth R, Kostenuik P, Boxberger J, et al. (2022). Proximal Femur Responses to Sequential Therapy With Abaloparatide Followed by Alendronate in Postmenopausal Women With Osteoporosis by 3D Modeling of Hip Dual‐Energy X‐Ray Absorptiometry (DXA). JBMR Plus, 6(4).
- Winzenrieth R, Humbert L, Boxberger JI, et al. (2022). Abaloparatide Effects on Cortical Volumetric BMD and Estimated Strength Indices of Hip Subregions by 3D-DXA in Women With Postmenopausal Osteoporosis. Journal of Clinical Densitometry, 25(3), 392–400.
- Bennett C, Miller M, Wolford G (2009). Neural correlates of interspecies perspective taking in the post-mortem Atlantic Salmon: an argument for multiple comparisons correction. NeuroImage, 47, S125.
- Poole KE, Treece GM, Gee AH, et al. (2014). Denosumab Rapidly Increases Cortical Bone in Key Locations of the Femur: A 3D Bone Mapping Study in Women With Osteoporosis. Journal of Bone and Mineral Research, 30(1), 46–54.
- Sato M, Westmore M, Ma YL, et al. (2004). Teriparatide [PTH(1–34)] Strengthens the Proximal Femur of Ovariectomized Nonhuman Primates Despite Increasing Porosity. Journal of Bone and Mineral Research, 19(4), 623–629.
- Hadji P, Kamali L, Thomasius F, et al. (2024). Real-world efficacy of a teriparatide biosimilar (RGB-10) compared with reference teriparatide on bone mineral density, trabecular bone score, and bone parameters assessed using quantitative ultrasound, 3D-SHAPER® and high-resolution peripheral computer tomography in postmenopausal women with osteoporosis and very high fracture risk. Osteoporosis International, 35(12), 2107–2116.
- Sone T, Ohnaru K, Sugai T, et al. (2023). The effects of abaloparatide on hip geometry and biomechanical properties in Japanese osteoporotic patients assessed using DXA-based hip structural analysis: results of the Japanese phase 3 ACTIVE-J trial. Archives of Osteoporosis, 18(1).
- Genant HK, Engelke K, Bolognese MA, et al. (2016). Effects of Romosozumab Compared With Teriparatide on Bone Density and Mass at the Spine and Hip in Postmenopausal Women With Low Bone Mass. Journal of Bone and Mineral Research, 32(1), 181–187.
- MEDICAL 3S (2021). Webinar - Use of 3D-Shaper in clinical research: state of the art and potential applications
- Casado Burgos E, Di Gregorio S, González Macías J, et al. (2019). Datos de referencia de mediciones óseas en modelos 3D de fémur proximal en población española cn DXA: Proyecto SEIOMM 3D-SHAPPER. Congreso SEIOMM (24º : 2019 : Gerona).
- Brance ML, Saravi FD, Henr{\'i}quez MM, et al. (2020). Reference Values of Three-Dimensional Proximal Femur Parameters from Bone Densitometry Images in Healthy Subjects from Argentina. World Congress on Osteoporosis, Osteoarthritis and Musculoskeletal Diseases, 372--372.
- Jennings I (). 3D Shaper Technology: Revolutionizing Bone Health Analysis
- Al-Hashimi L, Klotsche J, Ohrndorf S, et al. (2023). Trabecular Bone Score Significantly Influences Treatment Decisions in Secondary Osteoporosis. Journal of Clinical Medicine, 12(12), 4147.
- Food {, Administration} D (2022). 510(k) Summary: K220822
- Broy SB, Cauley JA, Lewiecki ME, et al. (2015). Fracture Risk Prediction by Non-BMD DXA Measures: the 2015 ISCD Official Positions Part 1: Hip Geometry. Journal of Clinical Densitometry, 18(3), 287–308.
- Whitmarsh T, Humbert L, Craene MD, et al. (2009). Reconstrucción de la forma del fémur y densidad mineral ósea en 3D para el diagnóstico de osteoporosis a partir de DXA
- Whitmarsh T, Humbert L, Del Río Barquero LM, et al. (2011). Volumetric Bone Mineral Density Estimation using a 3D Reconstruction Method from Dual-energy X-ray Absorptiometry. ASBMR 2011 Annual Meeting Abstracts and Abstract Book.
- Whitmarsh T, Fritscher KD, Humbert L, et al. (2011). A Statistical Model of Shape and Bone Mineral Density Distribution of the Proximal Femur for Fracture Risk Assessment. Medical Image Computing and Computer-Assisted Intervention – MICCAI 2011, 393–400.
- Whitmarsh T, Fritscher KD, Humbert L, et al. (2012). Hip fracture discrimination from dual-energy X-ray absorptiometry by statistical model registration. Bone, 51(5), 896–901.
- Martelli Y, Whitmarsh T, Humbert L, et al. (2012). A software framework for 3D reconstruction and fracture risk assessment of the proximal femur from dual-energy x-ray absorptiometry. Proceedings of VPH 2012: Virtual Physiological Human - Integrative approaches to computational biomedicine.
- Slart RHJA, Punda M, Ali DS, et al. (2024). Updated practice guideline for dual-energy X-ray absorptiometry (DXA). European Journal of Nuclear Medicine and Molecular Imaging, 52(2), 539–563.