Abstract
La 3D-DXA, come implementata nello strumento software 3D-Shaper, è un metodo software che genera una ricostruzione 3D del femore prossimale da una singola immagine DXA 2D registrando un modello statistico. Le implementazioni della 3D-DXA mirano a fornire stime dei parametri trabecolari, corticali e strutturali simili a quelli derivati dalla tomografia computerizzata quantitativa (QCT). In qualità di inventore e sviluppatore dei metodi software su cui si basa la 3D-DXA, ho osservato la sua adozione e il suo uso diffuso con crescente preoccupazione. Questo articolo fornisce una valutazione critica delle limitazioni metodologiche inerenti alla 3D-DXA e discute le loro implicazioni per la ricerca e la cura dei pazienti. Il problema principale è che la visibilità limitata della corteccia in un'immagine DXA impedisce alla 3D-DXA di derivare accuratamente i parametri corticali. Invece, il software si basa su previsioni basate sulla BMD complessiva piuttosto che su misurazioni corticali dirette. Ciò può portare a risultati che non riflettono le misurazioni corticali effettive. Ulteriori preoccupazioni includono il bias della popolazione dovuto al fatto che il modello statistico è derivato da una specifica demografia e l'accuratezza limitata della ricostruzione utilizzando immagini DXA a vista singola. Queste limitazioni hanno probabilmente portato a misurazioni e risultati di ricerca errati, che sono passati in gran parte inosservati a causa dell'uso di metriche di valutazione delle prestazioni inappropriate e dell'assenza di correzioni per confronti multipli negli studi che coinvolgono la 3D-DXA. Nonostante queste limitazioni, la 3D-DXA ha ricevuto l'approvazione normativa in vari paesi, compromettendo potenzialmente l'accuratezza delle diagnosi cliniche e delle decisioni terapeutiche. Evidenziando questi problemi, questo articolo mira a informare clinici, ricercatori ed enti normativi sulle significative limitazioni della 3D-DXA. Sottolinea l'urgente necessità di una rivalutazione del suo utilizzo in contesti di ricerca e clinici per prevenire l'errata interpretazione dei risultati e garantire la sicurezza del paziente.Parole chiave
3D-DXA, 3D-Shaper, Tomografia Computerizzata Quantitativa, Densità Minerale Ossea, Assorbimetria a Raggi X a Doppia Energia, Mappatura dei Parametri Corticali, Analisi della Struttura dell'Anca.Riassunto divulgativo
Questa recensione esamina criticamente il software 3D-DXA, noto anche come 3D-Shaper, che mira a stimare i parametri trabecolari, corticali e strutturali del femore prossimale da una singola immagine DXA. La 3D-DXA presenta diverse limitazioni intrinseche che possono portare a misurazioni imprecise, influenzando potenzialmente i risultati della ricerca e le decisioni terapeutiche per i pazienti. Comprendere questi problemi è fondamentale per ricercatori e clinici al fine di evitare interpretazioni errate che potrebbero avere un impatto sulla nostra conoscenza della fisiologia ossea, degli effetti dei trattamenti farmacologici e della sicurezza del paziente.Introduzione
La 3D-DXA è un metodo software che registra un modello deformabile statistico 3D su una singola immagine DXA 2D per generare un modello 3D del femore prossimale [1]. Il modello è costruito da una serie di scansioni di tomografia computerizzata quantitativa (QCT) di una popolazione caucasica spagnola di 81 donne e 30 uomini con un'età media di 56,2 ± 12,1 anni, compresa tra 30 e 84 anni [2]. I parametri del modello statistico descrivono successivamente la variazione principale nella distribuzione della forma e della densità di questa popolazione. In un processo iterativo, i parametri del modello, così come la posizione, l'orientamento e la dimensione, vengono ricercati nel tentativo di far assomigliare la proiezione del modello all'immagine DXA (Figura 1). Dal modello 3D risultante, i parametri corticali vengono quindi misurati attraverso la superficie ossea, insieme ai valori volumetrici di BMD trabecolare all'interno. È stato riportato un errore medio assoluto di 0,33 mm per lo spessore corticale e 72 mg/cm³ per la densità corticale confrontando la 3D-DXA con la QCT, con coefficienti di correlazione maggiori o uguali a 0,86 [2].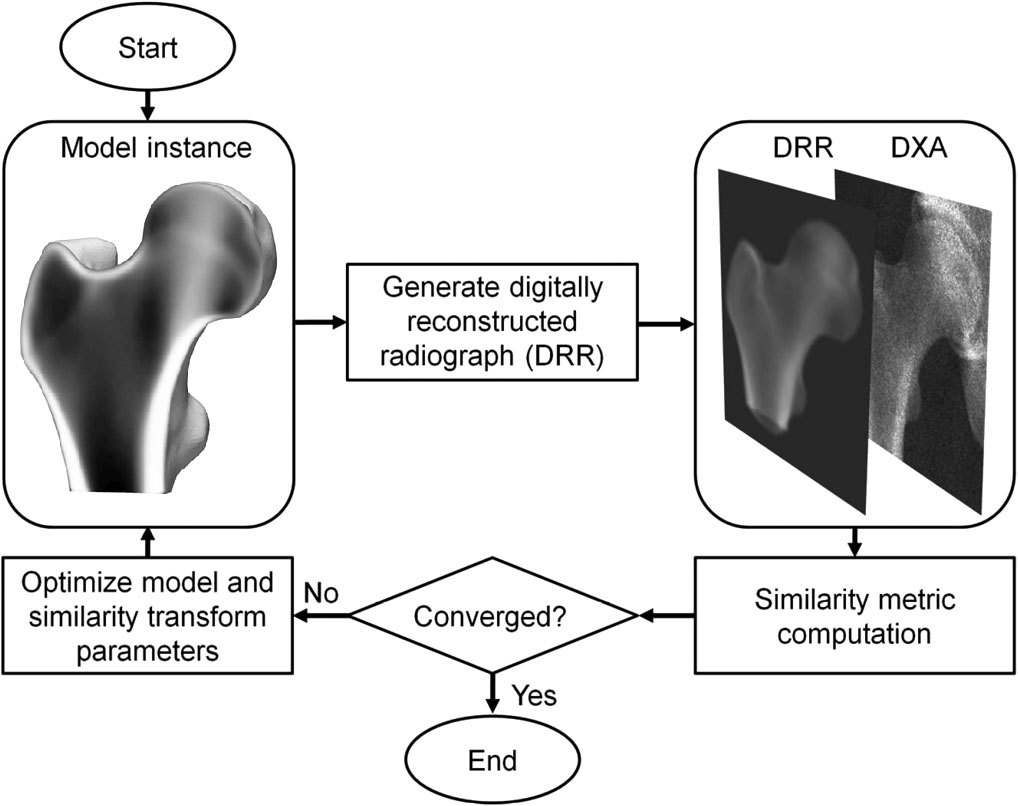
Sebbene siano stati proposti altri metodi per la ricostruzione 3D delle strutture ossee dalle immagini DXA utilizzando un modello statistico [4, 5], è il metodo software pubblicato per la prima volta nel 2010 [6] che è stato successivamente commercializzato come 3D-DXA da Galgo Medical SL (Barcellona, Spagna), una società spin-off dell'Università Pompeu Fabra (Barcellona, Spagna). Questo software è stato successivamente esteso per misurare lo spessore corticale e la densità minerale ossea (BMD) corticale dalle ricostruzioni volumetriche [2], che è ora commercializzato come 3D-Shaper da 3D-Shaper Medical SL (Barcellona, Spagna), un'ulteriore società spin-off di Galgo Medical SL, che fornisce sia un servizio che un software. Il software è concesso in licenza a DMS Imaging (Mauguio, Francia) per essere venduto come 3D-DXA con i loro dispositivi DXA Stratos/Medix. Fujifilm (Tokyo, Giappone) vende gli stessi dispositivi DXA di DMS con il marchio Fujifilm FDX Visionary DXA. Anche Imex Medical (São José, Brasile) vende questi dispositivi come serie Elipse e Radiología SA (Madrid, Spagna) li vende come Radioscore - DR. Tutti questi includono l'opzione di aggiungere la 3D-DXA.
Avendo sviluppato il metodo software originale [1], possiedo una profonda comprensione delle sue limitazioni intrinseche che potrebbero non essere evidenti ad altri utenti e ricercatori. Sebbene abbia spiegato la limitazione principale con questo software in una lettera all'editore di Bone [7], la 3D-DXA continua a essere venduta e utilizzata in tutto il mondo. 3D-Shaper ha ricevuto l'approvazione delle autorità di regolamentazione in UE, Giappone, Thailandia, Argentina e un'autorizzazione 510(k) dalla FDA, autorizzandone l'uso per la diagnosi e le decisioni terapeutiche nei pazienti. Visti questi riconoscimenti, è fondamentale e urgente affrontare e chiarire alcune delle idee sbagliate su questo software, migliorando così la comprensione delle sue limitazioni.
Limitazioni metodologiche
In questa sezione spiegherò alcune delle limitazioni della metodologia su cui si basa la 3D-DXA, nonché specifici dettagli di implementazione che possono contribuire a ulteriori imprecisioni.I parametri corticali non vengono misurati
Il problema principale risiede nella mancanza di visibilità della corteccia nelle immagini DXA affinché la 3D-DXA possa derivare i suoi parametri corticali. Per illustrare ciò, vorrei rivisitare una figura dalla lettera all'editore di Bone (Figura 2). L'immagine DXA mostra chiaramente che nella maggior parte delle posizioni sulla superficie ossea, non vi è alcuna corteccia distinguibile da cui derivare i parametri corticali. Ciò si applica al contorno della proiezione ossea (A) ed è particolarmente vero dove due cortecce opposte sono perpendicolari al rilevatore a raggi X (B). Ciò è evidente in questa immagine dallo scanner GE iDXA con una dimensione dei pixel di 0,3 x 0,25 mm, ma diventa ancora più pronunciato nelle immagini che utilizzano dispositivi DXA GE Prodigy più vecchi, che producono immagini a risoluzione considerevolmente inferiore con una dimensione dei pixel di 0,6 x 1,05 mm, ma sono anche supportati dal software 3D-Shaper.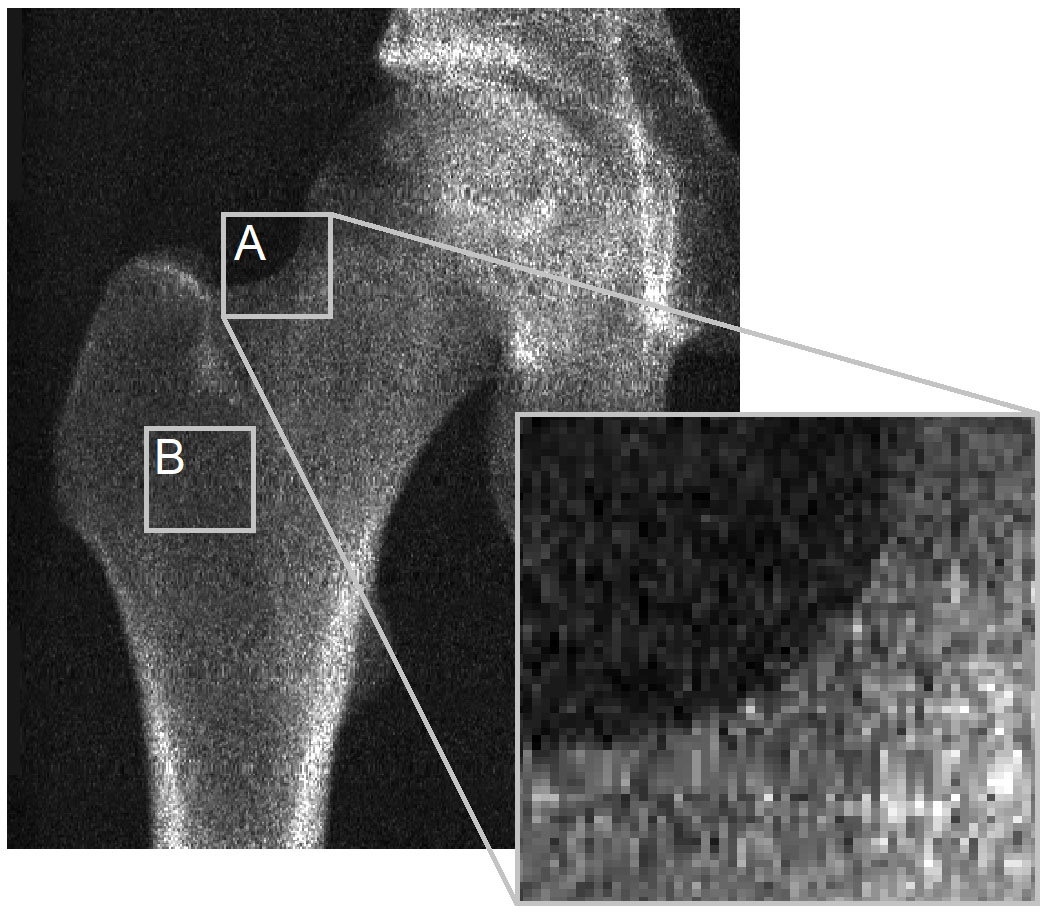
Invece di misurare i parametri corticali direttamente dall'immagine DXA, la 3D-DXA registra un modello statistico della forma e della distribuzione della densità sull'immagine DXA [7], ed estrae i parametri corticali da questo modello [2]. Questo modello è costruito da una serie di scansioni QCT calibrate, in cui le unità Hounsfield dei voxel in una scansione CT standard sono convertite in valori BMD utilizzando un fantoccio di calibrazione.
Per costruire il modello, il femore prossimale in ogni scansione QCT viene prima segmentato, il che significa che viene costruita una mesh superficiale del femore prossimale. Una tecnica matematica, come l'Analisi delle Componenti Principali (PCA), viene quindi applicata ai punti delle superfici ossee del femore allineate, risultando in una forma media e un insieme di Componenti Principali (PC) che descrivono le variazioni nella forma, ordinate per importanza.
Per costruire il modello statistico della distribuzione della densità, i volumi QCT vengono deformati alla forma media, e lo stesso metodo statistico viene applicato ai valori di BMD nei volumi, generando un volume medio e un insieme di PC che descrivono la variazione nella densità minerale ossea attraverso il volume.
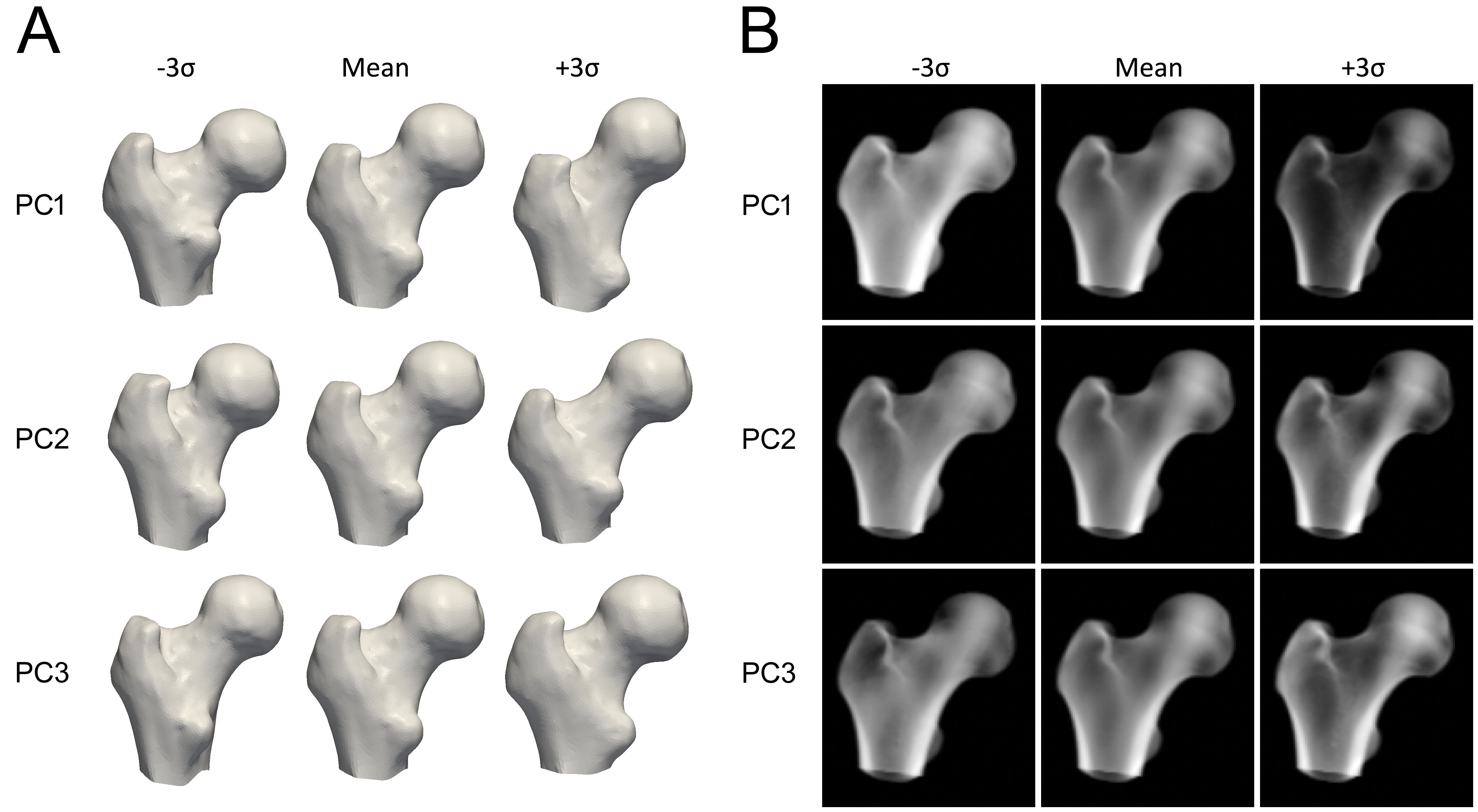
Ogni componente principale rappresenta il modo in cui la forma o la densità dell'osso può variare (Figura 3). I parametri del modello sono fattori numerici che determinano quanto di ogni componente viene aggiunto al modello medio. La regolazione di questi parametri modifica la forma o la distribuzione della densità, producendo nuove istanze del modello. I parametri sono vincolati a tipicamente da 2,5 a 3 deviazioni standard della sua variazione per assicurarsi che il modello osseo appaia sempre realistico secondo l'insieme di scansioni QCT da cui è costruito. Per creare una nuova istanza del modello, il volume di densità viene deformato per corrispondere alla nuova forma, utilizzando una trasformazione Thin Plate Splines (TPS) calcolata con un sottoinsieme dei punti di forma.
La 3D-DXA genera successivamente una ricostruzione 3D modificando iterativamente i parametri del modello e generando le istanze del modello corrispondenti, oltre a ruotare e traslare il modello, fino a quando la proiezione del modello corrisponde all'immagine DXA secondo una soglia metrica di somiglianza predeterminata (Figura 1).
Lo spessore corticale e la densità corticale vengono quindi misurati dall'istanza del modello utilizzando un metodo equivalente a un approccio di deconvoluzione proposto per la QCT [8]. Pertanto, i parametri corticali non vengono misurati dall'immagine DXA, ma da un modello parametrico che è stato registrato su questa immagine.
Quindi, quando le mappe dei parametri corticali vengono presentate dalla 3D-DXA, con valori in posizioni dove nessuna corteccia potrebbe essere stata misurata [9, 10, 11, 12, 13], queste mappe erano semplicemente derivate dall'istanza del modello. Sebbene 3D-Shaper Medical chiarisca in una risposta a una lettera all'editore di Bone [14] che questi parametri sono stimati piuttosto che misurati, una descrizione più accurata sarebbe che la 3D-DXA prevede questi valori utilizzando un metodo statistico complesso e potenzialmente soggetto a errori. Data la visibilità limitata della corteccia nelle immagini DXA, il software si basa principalmente sulla densità ossea complessiva ed è vincolato dalle caratteristiche statistiche della popolazione spagnola su cui si basa il modello. Le implicazioni più ampie di questa limitazione sono esplorate ulteriormente nella recensione.
Numero di parametri del modello utilizzati
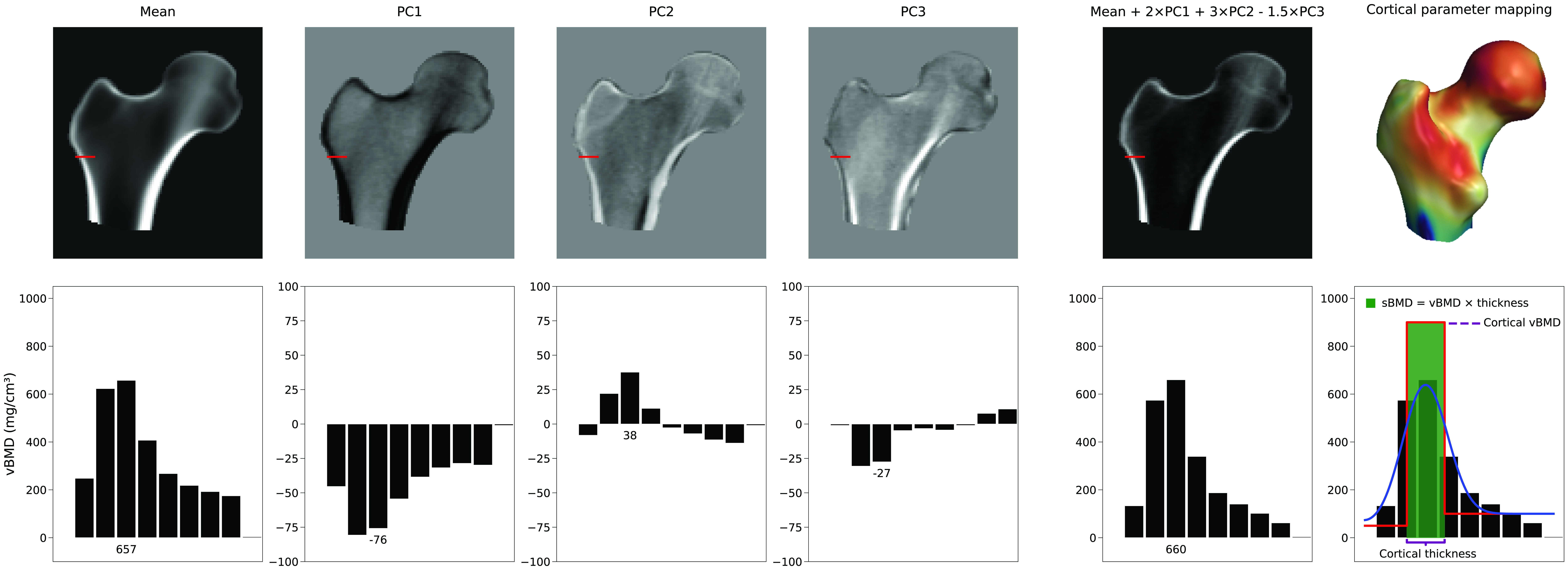
Non esiste un singolo parametro che aumenti lo spessore corticale. Invece, la rappresentazione della corteccia dipende da una combinazione lineare del volume 3D medio e delle PC del modello di densità. Nella Figura 4 possiamo vedere un esempio di come la media e le prime tre PC possano generare una nuova istanza del modello. In questo esempio, i parametri del modello, che sono i fattori di scala per le PC, hanno valori di 2, 3 e -1,5, rispettivamente. Mentre la PC1 aumenta o diminuisce la densità ovunque, le altre PC cambiano la distribuzione della densità in modi non descrittivi. Questa figura illustra anche come i parametri corticali vengono successivamente stimati da questo nuovo volume adattando un modello a gradini levigato. Regolazioni selettive e indipendenti dello spessore corticale, della densità corticale o della densità trabecolare, se realizzabili, richiederebbero una combinazione complessa di molteplici componenti principali e, di conseguenza, molti parametri del modello.Tipicamente viene mantenuto un sottoinsieme di componenti principali che descrivono le principali modalità di variazione. Ciò riduce la variazione della distribuzione BMD e dei punti superficiali a un insieme ridotto di parametri. Quanti parametri del modello sono necessari è tipicamente determinato calcolando il numero di parametri del modello di forma e densità che descrivono il 95% delle variazioni all'interno della sua popolazione, o determinando il "gomito" nel grafico della varianza cumulativa. Tuttavia, è più accurato utilizzare l'analisi parallela di Horn [6] che valuta matematicamente quali PC dovrebbero essere considerate rumore e possono quindi essere scartate.
Sebbene il numero di parametri utilizzati sia un elemento critico in qualsiasi approccio di modellazione statistica, a nostra conoscenza questo numero, o il metodo per derivare questo numero, non è mai stato divulgato da 3D-Shaper Medical. Se il numero di parametri non è appropriatamente grande, come determinato dall'analisi parallela di Horn, potrebbe non essere in grado di rappresentare accuratamente l'intera gamma di variazioni nella morfologia del femore della popolazione di input. Inoltre, se questo numero di parametri non è lo stesso nelle applicazioni di ricerca e cliniche, ci sarà una discrepanza nell'accuratezza riportata e clinica della 3D-DXA.
Potenziale bias della popolazione
Qualsiasi modello osseo 3D generato dalla 3D-DXA è derivato da statistiche sulle variazioni della popolazione di input. Nel caso di 3D-Shaper, il modello statistico è costruito da una popolazione spagnola di 81 donne e 30 uomini con un'età media di 56,2 ± 12,1 anni [30 anni – 84 anni] [2] senza trattamenti o malattie che influiscono sul metabolismo osseo [15]. È chiaro che la morfologia del femore differisce tra uomini e donne, ma la demografia gioca anche un ruolo importante. Ad esempio, le ossa del femore delle popolazioni caucasiche sono significativamente diverse da quelle delle popolazioni asiatiche, come documentato in studi precedenti [16].Un modello costruito da una popolazione caucasica non sarà in grado di generare una ricostruzione che si adatta a ogni soggetto in una popolazione asiatica. Questo perché i parametri di un modello statistico sono vincolati a 3 deviazioni standard attorno al modello medio del femore di una popolazione spagnola. Ad esempio, uno studio riporta che le donne bianche hanno uno spessore corticale del collo del femore di 1,84±0,03 mm, mentre per le donne coreane è di 2,41±0,71 mm, misurato mediante scansioni QCT [17]. Di conseguenza, una donna coreana con uno spessore corticale medio di 2,41 mm cadrebbe al di fuori dell'intervallo di variazione per una popolazione bianca se vincolata a tre deviazioni standard (1,75–1,93 mm). Questo esempio illustra l'importanza di avere un modello che rappresenti la popolazione target.
Sebbene le misure della 3D-DXA siano correlata con la QCT in una popolazione giapponese [18], ciò è semplicemente perché tutti i parametri sono correlati con l'aBMD. Non significa che siano state ottenute ricostruzioni specifiche per il paziente. In particolare, i parametri corticali stimati possono discostarsi sostanzialmente dai valori reali, specialmente per quanto riguarda la loro distribuzione spaziale. Anche se la forma prevista del femore è errata, i valori di densità, inclusi lo spessore corticale e la BMD corticale, rispecchieranno comunque l'aBMD, purché la proiezione del modello statistico si sovrapponga ampiamente all'osso nell'immagine DXA. Una persona con bassa aBMD avrà una bassa vBMD, una bassa BMD corticale e una corteccia più sottile rispetto a un paziente con alta aBMD in qualsiasi popolazione. Inoltre, [18] ha riportato solo correlazioni, e potrebbe esserci un bias significativo quando si applica un modello sviluppato da una popolazione spagnola a una popolazione giapponese, che potrebbe avere conseguenze cliniche. Nonostante questa limitazione fondamentale, la 3D-DXA è attualmente commercializzata in Asia, inclusi paesi come Giappone, Thailandia e India.
Un modello statistico deve essere addestrato sulla popolazione a cui viene applicato. Ciò potrebbe significare costruire modelli separati per ogni genere, etnia e potenzialmente tipo di trattamento, o includendo tutti questi sottogruppi in un unico modello, a condizione che vengano mantenuti abbastanza parametri per catturare l'intera gamma di variabilità. Questo principio è ben stabilito per gli strumenti di apprendimento automatico e intelligenza artificiale [19, 20, 21, 22] ma è ancora più critico per gli approcci di modellazione statistica, dove i modelli sono attivamente vincolati dalla popolazione di input. Tuttavia, la 3D-DXA è stata utilizzata in studi con popolazioni che differiscono ovviamente dalla popolazione del modello, tra cui: ballerini professionisti[9], giocatori di football e nuotatori[23] giovani donne con obesità[24], donne nere[25], pazienti con massa ossea elevata [11], con deficit dell'ormone della crescita negli adulti [26] con malattia psoriasica [27], con diabete di tipo 2 [28], con iperparatiroidismo primario [10, 29], con acromegalia [30], con sindrome di Down [13], dopo gastrectomia a manica [31], uomini con lesione del midollo spinale [32], uomini australiani di mezza età e anziani con bassa massa ossea [33], e forse la cosa più preoccupante di tutte, sopravvissuti al cancro pediatrico [34].
Accuratezza di ricostruzione limitata
La 3D-DXA è un metodo altamente complesso soggetto a errori in più fasi. Questi includono inesattezze dalla calibrazione QCT, registrazione deformabile per la costruzione di modelli statistici, deformazione del modello di densità all'istanza di forma, discrepanze in BMD e risoluzione tra QCT e DXA, e semplificazione della proiezione del modello mediante una proiezione isometrica invece della proiezione a ventaglio. Ognuno di questi fattori può introdurre bias in modi imprevedibili, potenzialmente distorcendo i risultati. Inoltre, specifici dettagli di implementazione, come la costruzione del modello statistico da un set molto piccolo di 111 soggetti adulti spagnoli (che limita la varianza in forma, densità e spessore corticale), limitano ulteriormente l'applicabilità di questo strumento software.Inoltre, non è chiaro se 3D-Shaper possa leggere accuratamente i file di dati proprietari dai dispositivi GE e Hologic, in particolare per quanto riguarda l'applicazione corretta dei fattori di calibrazione e correzione per varie composizioni corporee. Queste potenziali inesattezze possono influenzare i risultati di 3D-Shaper quando applicati a diverse popolazioni o quando le caratteristiche della popolazione variano nel tempo.
È ragionevole pensare che, se la forma e l'orientamento del femore prossimale non sono perfettamente abbinati all'immagine DXA, entro un'accuratezza sub-millimetrica, non dovrebbe essere possibile estrarre lo spessore corticale entro un'accuratezza sub-millimetrica, né la densità corticale. Sfortunatamente non è possibile generare una ricostruzione perfetta da una sola immagine DXA 2D come ha già dimostrato un primo studio con 3D-DXA [35]. Qui è stato dimostrato che l'aggiunta di una seconda vista riduce l'errore di forma da 1,3 mm a 0,9 mm e l'errore BMD dal 4,4% al 3,2%, indicando una chiara ricostruzione non ottimale da una singola vista. Al contrario, la tomografia computerizzata ricostruisce un volume utilizzando centinaia di proiezioni acquisite da tutte le angolazioni attorno al femore. Pertanto, la QCT consente la misurazione indipendente dei parametri corticali e trabecolari.
La 3D-DXA può produrre modelli di femore con una morfologia completamente diversa a seconda di dove la ricerca dei parametri del modello è convenuta, in particolare se la rotazione corretta non è stata recuperata. Ciò può variare notevolmente, come evidenziato da uno studio che utilizza la 3D-DXA che ha coinvolto scansioni DXA ripetute lo stesso giorno, che ha rivelato differenze nella forza prevista fino al 62% [36]. Questo studio ha anche riportato differenze element-by-element di BMD che raggiungono il 30 ± 50%, che si rifletteranno probabilmente in una bassa accuratezza di ripetibilità anche per i parametri corticali, sebbene questi numeri non siano stati forniti. In uno studio separato, è stato riportato che anche la correlazione tra i valori di densità 3D-Shaper e QCT è bassa (r2 = 0.48) [37], indicando ulteriormente una limitata accuratezza di ricostruzione specifica del soggetto.
In uno studio sulla misurazione dei parametri strutturali del femore utilizzando la 3D-DXA, è stato riportato un coefficiente di correlazione di r = 0,86 per la lunghezza dell'asse del collo del femore [38] correlando le misurazioni derivate dal volume 3D-DXA con le misurazioni di verità dal terreno dalla CT. Questo è peggio di quando misurato direttamente nell'immagine DXA (r = 0,90, [39]). Anche gli angoli dell'asse del collo del femore prodotti dalla 3D-DXA sono di accuratezza limitata (r = 0,71, [38]). Una ragione ovvia per la mancanza di questa accuratezza è che la testa del femore è esclusa dal processo di ricostruzione utilizzando una maschera per impedire che la sovrapposizione dell'emibacino interferisca con la ricostruzione, sebbene ciò potrebbe essere risolto aggiungendo un secondo modello dell'emibacino come in [5].
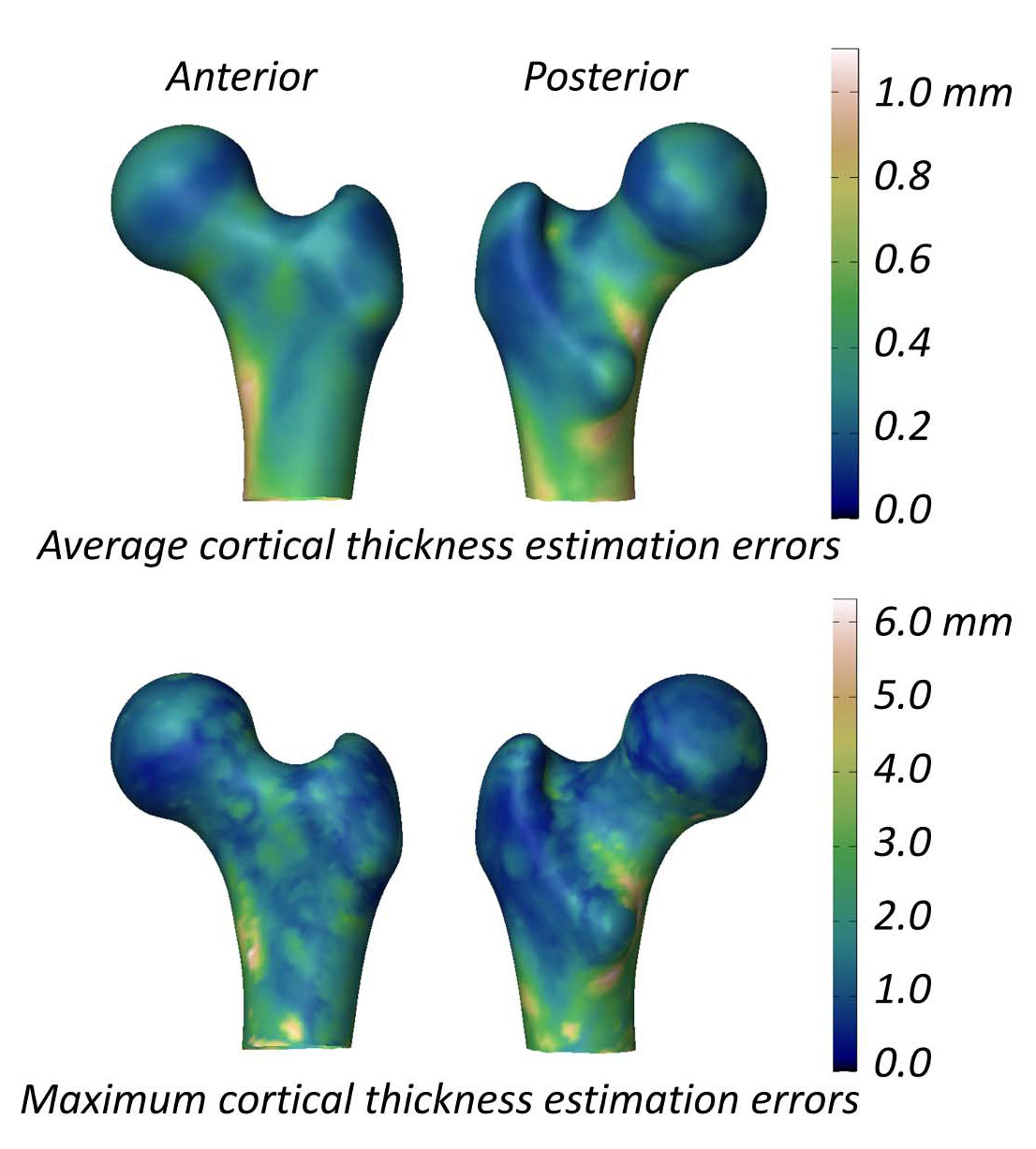
Lo studio che valuta la capacità della 3D-DXA di misurare i parametri corticali riporta una differenza media (± deviazione standard) dello spessore corticale tra 3D-DXA e QCT di 0,04 ± 0,21 mm al collo del femore e -0,07 ± 0,15 mm al trocantere [2]. Questo studio ha anche presentato una figura che mostra gli errori di stima dello spessore corticale assoluto medio e massimo attraverso la superficie del modello del femore (Figura 5), con un errore medio superiore a 0,2 mm e un errore massimo superiore a 1 mm attraverso gran parte della superficie del femore. In confronto, uno studio QCT che misura i cambiamenti dello spessore corticale a seguito di un trattamento con alendronato di 18 mesi ha riportato un aumento dell'1,4%, corrispondente a un aumento approssimativo di 0,018 mm dello spessore corticale [40]. I dati compilati da tre studi clinici sul teriparatide hanno indicato che lo spessore corticale è aumentato di 0,035 mm [41]. Considerando che l'errore della 3D-DXA supera questi tipici cambiamenti indotti dal trattamento, è improbabile che le misurazioni 3D-DXA distinguano in modo affidabile tra veri effetti guidati dalla terapia e rumore metodologico. In altre parole, se l'osso corticale di un individuo sembra cambiare, rimane poco chiaro se ciò derivi da un autentico cambiamento fisiologico o dall'errore di misurazione intrinseco della 3D-DXA.
Beneficio limitato rispetto alla aBMD
Nel modello di densità statistica che utilizza la 3D-DXA, il primo parametro del modello rappresenta la stragrande maggioranza della variazione e l'aumento del suo valore porta a un aumento sia della densità complessiva che di tutti i parametri corticali [7]. Dato che ci sono poche informazioni sulla corteccia nell'immagine DXA, la 3D-DXA si basa principalmente sulla densità complessiva e, quindi, sul primo parametro del modello. Di conseguenza, i parametri corticali e trabecolari sono intrinsecamente correlati. Sebbene possa esserci un certo contributo dalle cortecce mediale e laterale inferiori dell'asta che sono visibili nell'immagine DXA, i parametri restituiti dalla 3D-DXA riflettono prevalentemente la BMD areale totale (aBMD). Ciò significa che, se l'aBMD aumenta, l'analisi 3D-DXA mostrerà aumenti simultanei di BMD trabecolare, BMD corticale e spessore corticale. In effetti, un recente studio presentato al congresso della European Calcified Tissue Society del 2024 [42] e all'incontro annuale del 2024 dell'American Society for Bone and Mineral Research [43] conferma che i parametri 3D-shaper sono altamente correlati all'aBMD e quindi non forniscono ulteriori informazioni sulla previsione delle fratture.Inoltre, mentre la ricostruzione 3D-DXA cattura la silhouette femorale complessiva visibile nell'immagine DXA, la sua capacità di recuperare la lunghezza dell'asse del collo e l'angolo dell'asse del collo è limitata. Di conseguenza, la forma ricostruita riflette principalmente la dimensione generale dell'osso, che è già fornita dall'aBMD e non aggiunge molto alla previsione della resistenza alla frattura. Illustrativo di ciò è la constatazione che le previsioni di forza dalla 3D-DXA correlate con la QCT (r2 = 0.88), ma non erano statisticamente migliori rispetto a quando previste solo dall'aBMD del collo del femore dall'immagine DXA (r2 = 0.87) [37]. Uno studio di 3D-Shaper Medical mostra una correlazione simile (r2=0.86) ma un confronto con l'aBMD è stato escluso [44]. In uno studio diverso su una popolazione giapponese, le misure da 3D-Shaper non erano statisticamente migliori nel prevedere la frattura dell'anca rispetto all'aBMD totale dell'anca [45].
Ci sono stati altri articoli pubblicati su un metodo simile di registrazione di un modello statistico 3D su un'immagine DXA 2D e previsione della forza femorale [46, 47], con uno studio che mostra un miglioramento rispetto all'aBMD nella previsione del rischio di frattura [48]. Questo metodo può offrire alcuni vantaggi rispetto alla 3D-DXA, come l'uso di un modello pelvico aggiuntivo per aiutare a recuperare la forma completa del femore prossimale. Sebbene rimanga soggetto a molte delle stesse limitazioni metodologiche.
Se la 3D-DXA non riesce a superare la sola aBMD, non può certamente superare una combinazione di parametri aBMD e HSA, che sono misurati direttamente dalle immagini DXA. Ciò evidenzia le limitazioni fondamentali della 3D-DXA e mette in discussione la sua giustificazione per l'uso in contesti clinici o di ricerca. Tuttavia, 3D-Shaper Medical offre ora un'analisi degli elementi finiti basata sulla 3D-DXA come servizio.
Metodi di validazione
Nonostante le limitazioni intrinseche della 3D-DXA, numerose pubblicazioni riportano risultati positivi sulla sua accuratezza. Questa discrepanza può essere attribuita all'uso di metodi di validazione inappropriati [21, 22] che tendono a oscurare le vere limitazioni del software. Nelle sezioni seguenti, discuterò i problemi con queste validazioni e come creano una percezione dell'affidabilità e dell'utilità clinica della 3D-DXA.Metriche di valutazione delle prestazioni errate
3D-Shaper Medical ha confrontato la mesh superficiale generata dalla 3D-DXA da un'immagine DXA con la mesh superficiale generata manualmente dalla scansione QCT degli stessi soggetti, risultando in una distanza media punto-superficie di 0,93 mm [2]. Hanno anche confrontato i parametri corticali, trovando un errore medio assoluto di 0,33 mm per lo spessore corticale e 72 mg/cm³ per la densità corticale. Tuttavia, non esiste un quadro di riferimento per determinare se questi errori riportati siano accettabili, il che significa che queste metriche non convalidano necessariamente l'efficacia del software.Un altro modo in cui è stata valutata la 3D-DXA è stato attraverso l'uso delle correlazioni. Sono stati riportati coefficienti di correlazione di 0,86, 0,93, 0,95 e 0,91 rispettivamente per vBMD trabecolare, corticale e integrale e spessore corticale. Tuttavia, queste forti correlazioni sono principalmente dovute al fatto che tutti i parametri corticali sia nei modelli 3D-DXA che nelle scansioni QCT sono fortemente correlati alla densità complessiva. I pazienti con aBMD superiore alla media nelle loro scansioni DXA mostreranno, in media, anche un aumento della vBMD trabecolare, corticale e integrale, insieme a una corteccia più spessa. Questi risultati di correlazione non forniscono prove conclusive dell'accuratezza del software nel generare ricostruzioni specifiche per il paziente e, in effetti, possono creare un'impressione fuorviante delle sue prestazioni.
Le correlazioni vengono utilizzate anche per valutare studi basati sulla popolazione utilizzando la 3D-DXA. Effetti simili possono essere visti quando le analisi 3D-DXA mostrano correlazioni significative tra i suoi parametri e i fattori testati o attraverso diverse popolazioni. Anche questo è perché questi parametri sono intrinsecamente correlati alla BMD complessiva e quindi riflettono direttamente i cambiamenti o le differenze nella aBMD. I risultati possono sembrare sensati e possono rispecchiare da vicino i veri cambiamenti. Ad esempio, l'esercizio aumenta sia la densità complessiva che il contenuto minerale osseo corticale [49], portando a risultati apparentemente sensati da un'analisi 3D-DXA quando l'aBMD aumenta a causa dell'esercizio. Tuttavia, questi non riflettono i parametri corticali effettivi stessi, ma semplicemente i cambiamenti sottostanti o le differenze nella aBMD. Di conseguenza, questi studi possono creare un'impressione fuorviante dell'efficacia della 3D-DXA, dando un falso senso della sua capacità di misurare accuratamente i parametri corticali.
Una valutazione più appropriata comporterebbe il confronto dei parametri corticali con un modello di base semplice, come uno stimatore cieco. Qui uno stimatore cieco si riferisce a un metodo di stima semplice e ingenuo che non tiene conto della variabilità individuale e applica invece un valore medio dell'intera popolazione a tutti i soggetti. Ad esempio, uno stimatore cieco per lo spessore corticale utilizzerebbe la mappa dello spessore corticale medio da un gruppo di individui e la applicherebbe uniformemente a ogni caso, indipendentemente dalle loro caratteristiche specifiche. Questo approccio funge da base, o standard minimo, rispetto al quale dovrebbero essere valutati metodi più avanzati. A mia conoscenza, tale valutazione non è ancora stata pubblicata.
La maggior parte delle pubblicazioni sul software 3D-DXA mostra solo ricostruzioni di successo, il che può creare un falso senso di fiducia nell'affidabilità del software. Per valutare quantitativamente l'affidabilità della 3D-DXA, può essere eseguita una valutazione del tasso di fallimento. In uno studio precedente [51], sebbene non esplicitamente dichiarato, solo 80 su 173 soggetti sono stati conservati dopo aver escluso le ricostruzioni identificate come inaccurate attraverso il confronto delle proiezioni del modello con le immagini DXA, producendo un tasso di fallimento superiore al 50%. Per consentire tale valutazione, 3D-Shaper dovrebbe fornire una visualizzazione affiancata della proiezione del modello e dell'immagine DXA. Una valutazione più solida, tuttavia, confronterebbe rendering e viste trasversali dei volumi risultanti con le scansioni QCT di verità dal terreno e valuterebbe il tasso di fallimento in una valutazione indipendente.
In alcuni casi, la semplice osservazione di cambiamenti o differenze significativi viene presentata come prova che la 3D-DXA funziona, trascurando se gli effetti reali siano corretti. In risposta alla mia lettera all'editore, differenze significative tra i gruppi di trattamento sono state presentate come prova dell'efficacia della 3D-DXA. Tuttavia, in questa valutazione, gli autori forniscono 2 risultati diversi per i cambiamenti della BMD corticale dopo il trattamento con TPTD, uno che mostra un aumento significativo [52] e l'altro una diminuzione non significativa [15]. Nessuno di questi riflette il cambiamento effettivo che ci si aspetterebbe nel trattamento con TPTD, come spiego nella Sezione "Risultati fuorvianti negli studi sull'efficacia dei farmaci".
Assenza di correzione per confronti multipli
La preoccupazione in questa sezione non è principalmente correlata al software 3D-DXA stesso, ma piuttosto al servizio fornito da 3D-Shaper Medical e alle successive pubblicazioni. Il problema critico risiede nella mancanza di correzioni per confronti multipli quando si riportano cambiamenti o differenze nei parametri 3D-DXA, in particolare nelle mappe dei parametri corticali.L'applicazione di correzioni per confronti multipli è fondamentale quando si analizzano dati con misurazioni distinte multiple. Per 3D-Shaper, il software genera 71 parametri ossei, con ciascuno che rappresenta un test statistico separato. Senza aggiustare per questi confronti multipli, come con una correzione di Bonferroni, la probabilità di ottenere risultati significativi per caso aumenta, portando a conclusioni false. Nonostante ciò, gli studi che utilizzano 3D-Shaper riportano spesso cambiamenti o differenze significativi senza applicare alcuna forma di correzione per confronti multipli [10, 24, 27, 28], creando un senso ingiustificato di fiducia nei risultati. Ciò può essere fuorviante quando determinati parametri vengono misurati ma non riportati, una forma di bias di p-hacking [53], dove vengono evidenziati risultati significativi ignorando il rischio aumentato di falsi positivi a causa del gran numero di test condotti.
Un problema simile si verifica quando gli studi che utilizzano 3D-Shaper presentano mappe codificate a colori che mostrano cambiamenti o differenze nei parametri corticali sulla superficie ossea o valori BMD nel volume. In questi casi, ogni vertice o voxel rappresenta un test statistico individuale, con significatività spesso determinata da un semplice t-test in ogni punto [9, 10, 11, 12, 13, 28, 52, 54, 55]. Questo approccio evidenzia regioni apparentemente significative nelle mappe codificate a colori, creando l'illusione di cambiamenti localizzati o differenze dove non ce ne sono. Quando si presentano cambiamenti o differenze nel volume attraverso viste trasversali codificate a colori, la significatività statistica a livello di voxel non viene generalmente fornita affatto [9, 11, 30, 52, 54, 55, 56]. Allo stesso modo questo suggerisce cambiamenti reali quando, in realtà, potrebbero essere semplicemente il risultato di una variazione casuale. Di conseguenza, queste mappe codificate a colori possono dare un'impressione eccessivamente ottimistica dell'impatto di trattamenti o interventi, suggerendo falsamente efficacia dove potrebbe non essercene.
Il problema dei falsi positivi dovuti a correzioni inadeguate per confronti multipli è stato una sfida persistente nel campo della neuroimaging [57]. Per affrontare questo problema, la comunità di neuroimaging ha sviluppato soluzioni che possono essere applicate anche agli studi che esaminano i cambiamenti ossei corticali sulla superficie ossea e i cambiamenti di densità nei voxel delle scansioni QCT. Poole et al. [58] descrivono come SurfStat (http://math.mccgill.ca/keith/surfstat/) può essere utilizzato per testare se le differenze nei parametri corticali in ogni punto sulla superficie ossea fossero statisticamente significative, con la teoria dei campi casuali applicata per la correzione dei confronti multipli. Esistono pacchetti simili per l'analisi basata su voxel, come la libreria Statistical Parametric Mapping (https://www.fil.ion.ucl.ac.uk/spm/) e la FMRIB Software Library (https://fsl.fmrib.ox.ac.uk). L'uso di questi strumenti migliorerebbe il rigore statistico degli studi che utilizzano la 3D-DXA, sebbene i cambiamenti o le differenze osservati rifletterebbero comunque prevalentemente la correlazione di tutti i parametri con aBMD.
Implicazioni
L'uso della 3D-DXA ha implicazioni di ampia portata sia nella ricerca che nella pratica clinica. Le seguenti sezioni approfondiranno queste sfide.Risultati fuorvianti negli studi sull'efficacia dei farmaci
Nella maggior parte degli studi, i risultati della 3D-DXA si allineano con quanto ci si aspetta nella corteccia, poiché i parametri corticali negli individui sani sono tipicamente correlati all'aBMD. Questo porta spesso a risultati apparentemente sensati. Tuttavia, questo approccio diventa errato quando i cambiamenti non seguono modelli convenzionali. Il metodo è particolarmente problematico negli studi sui farmaci in cui il normale modellamento e rimodellamento osseo sono alterati e i soliti aumenti o diminuzioni proporzionali in tutti i parametri potrebbero non verificarsi.Un esempio illustrativo è uno studio sul teriparatide, dove la 3D-DXA ha indicato un aumento in tutti i parametri corticali, incluso un aumento significativo della vBMD corticale rispetto al placebo [52]. Al contrario, utilizzando una tecnica di misurazione corticale equivalente applicata alla QCT, è stato dimostrato che la BMD corticale diminuisce significativamente a seguito dello stesso trattamento con teriparatide di 18 mesi, che è stato visto costantemente nei dati di tre diversi studi clinici [41]. Questa diminuzione è attribuita a un tasso aumentato di rimodellamento, che provoca una maggiore porosità corticale, come osservato anche utilizzando la micro-CT [59].
In uno studio precedente, 3D-Shaper Medical ha riportato una diminuzione della BMD corticale in risposta al teriparatide [15]. Sebbene ciò sia stato notato dagli autori come una diminuzione, il cambiamento non è stato statisticamente significativo. Uno studio indipendente più recente non ha inoltre riscontrato cambiamenti significativi nella BMD corticale in risposta al trattamento con teriparatide utilizzando un'analisi 3D-DXA [60]. Potrebbe essere possibile che ci sia una certa influenza dalla corteccia dell'asta, che è parzialmente visibile nell'immagine DXA. A causa della natura della 3D-DXA, una diminuzione dell'aBMD in questa regione potrebbe essere stata proiettata sull'intero modello del femore, comprese le aree in cui non è visibile alcuna corteccia, poiché i parametri del modello influenzano la distribuzione della densità a livello globale. Tuttavia, ciò non ha portato alla corretta diminuzione significativa della BMD corticale osservata negli studi QCT.
Lo studio che ha riportato un aumento in tutti i parametri corticali con teriparatide (TPTD) ha valutato anche l'abaloparatide in parallelo, mostrando un aumento ancora maggiore in tutti i parametri per quest'ultimo [52]. Studi di follow-up utilizzando l'analisi 3D-DXA hanno anche riportato aumenti significativi della BMD corticale dopo il trattamento con abaloparatide [55, 56]. Dato che l'abaloparatide condivide un meccanismo d'azione simile con il TPTD, aumentando il tasso di rimodellamento osseo, ci si aspetterebbe ragionevolmente che porti anche a una diminuzione della BMD corticale. In effetti, uno studio utilizzando la QCT ha osservato una diminuzione della BMD corticale a seguito di un periodo simile di trattamento con abaloparatide in 35 pazienti [61], sebbene la riduzione non fosse statisticamente significativa. Ciò suggerisce che gli studi 3D-DXA non solo hanno prodotto cambiamenti imprecisi, ma hanno anche probabilmente portato a una valutazione eccessivamente favorevole degli effetti dell'abaloparatide.
Uno studio di Lewiecki et al. [54] illustra ulteriormente le limitazioni della 3D-DXA nella misurazione di cambiamenti corticali discordanti. La loro analisi 3D-DXA ha riportato aumenti in tutti i parametri corticali in risposta al romosozumab. Al contrario, una precedente analisi QCT non ha riscontrato alcun aumento della BMD corticale a seguito dello stesso trattamento [62]. Gli autori hanno notato: "Non è chiaro perché i dati ottenuti da QCT e 3D-SHAPER basato su DXA per il trattamento con romosozumab sulla vBMD integrale e trabecolare dell'anca fossero simili tra gli studi ma differissero per la vBMD corticale". Dato che la lettera all'editore di Bone vista da alcuni degli stessi autori aveva già spiegato e previsto questa discrepanza [7], sembra che persista un malinteso riguardo alle capacità e alle limitazioni della 3D-DXA. Di conseguenza, questo malinteso ha probabilmente portato di nuovo a una valutazione eccessivamente ottimistica dell'efficacia del farmaco.
Questi studi diffondono ulteriormente risultati potenzialmente errati presentando mappe a colori dei cambiamenti ossei corticali e trabecolari. La 3D-DXA non può misurare cambiamenti localizzati o focali, in parte perché ogni parametro del modello influenza la distribuzione della densità a livello globale, e anche perché questi cambiamenti non sono visibili su un'immagine DXA. La mancata applicazione di correzioni per confronti multipli in questi studi mina ulteriormente i risultati, poiché le regioni apparentemente significative nelle mappe sono, in effetti, molto meno significative, portando a una valutazione eccessivamente ottimistica di vari farmaci.
Gestione del paziente
Sebbene il software 3D-Shaper possa produrre 71 misure, la versione approvata clinicamente produce solo la vBMD trabecolare globale e la sBMD corticale, nonché un T-score e uno Z-score associati. Non è chiaro da quale popolazione siano derivati il T-score e lo Z-score, sebbene in un webinar di 3D-Shaper Medical vengano citati dati di riferimento caucasici [63]. I grafici di riferimento sono stati precedentemente prodotti per una popolazione spagnola [64] e argentina [65], che sono entrambi riprodotti nella Figura 6. Questi grafici, tuttavia, appaiono distinti l'uno dall'altro e dalle figure prodotte dal software 3D-Shaper. 3D-Shaper Medical, DMS Imaging e i loro distributori non divulgano questa popolazione, o come questi dati siano stati derivati. Tuttavia, è confermato da Toyo Medic Co., Ltd. (Tokyo, Giappone), il distributore di 3D-Shaper in Giappone, che il software 3D-Shaper approvato per il mercato giapponese non utilizza dati di riferimento di una popolazione giapponese. Considerando la grande differenza nei parametri corticali e trabecolari tra le popolazioni caucasiche e asiatiche [68], applicare questi T-score e Z-score in Giappone non sembra prudente senza ulteriori validazioni. La loro validità dovrebbe anche essere confermata per ogni popolazione in cui vengono applicati.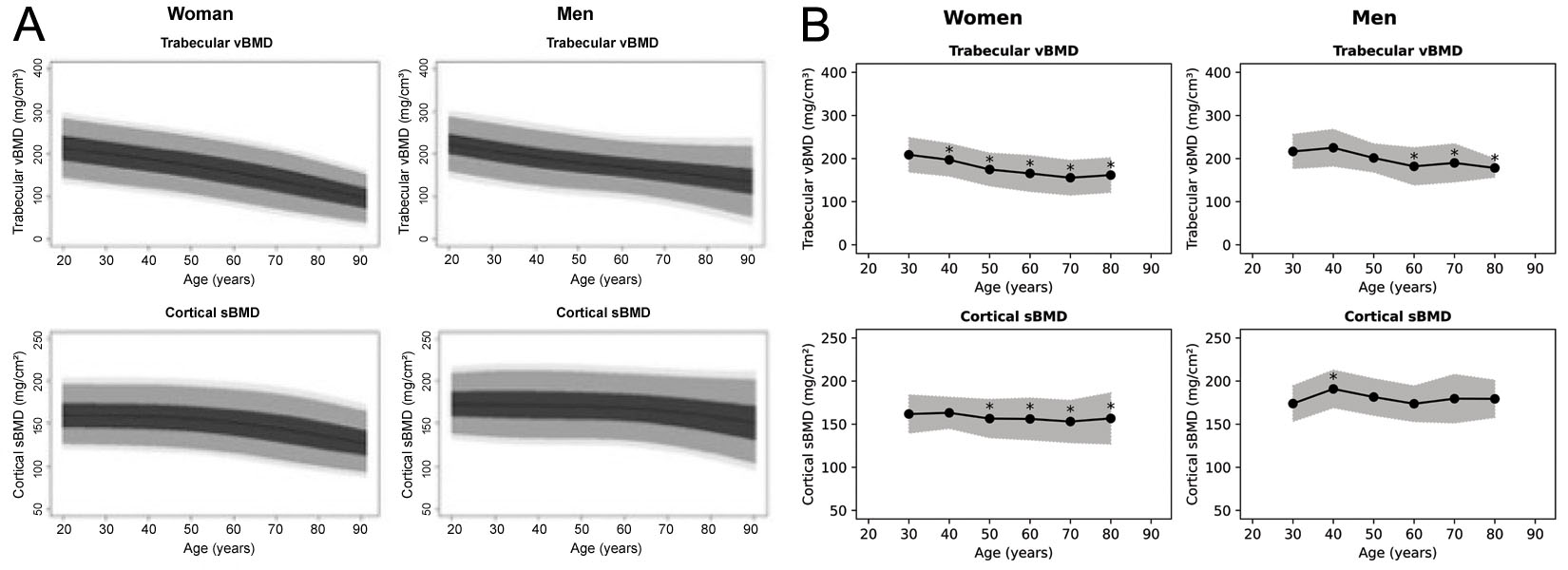
In un webinar [66] 3D-Shaper Medical ha suggerito un potenziale uso clinico in cui 3D-Shaper ha portato a una bassa sBMD corticale e una vBMD trabecolare molto bassa. Poiché il teriparatide, secondo la tabella, migliora l'osso trabecolare più dell'osso corticale, si diceva che il teriparatide fosse il miglior trattamento. Tuttavia, sulla base di questa tabella, un clinico sceglierebbe naturalmente Denosumab o Abaloparatide rispetto al teriparatide se si trascura l'aBMD vertebrale.
La 3D-DXA verrà probabilmente utilizzata solo insieme alle valutazioni regolari del T-score e dello Z-score DXA. Pertanto, il pericolo di perdere un individuo ad alto rischio sarà minimo. Tuttavia, a causa dell'errore associato alla 3D-DXA, la sBMD corticale e la vBMD trabecolare saranno sempre leggermente superiori o inferiori. Nei pazienti al confine del trattamento, ciò potrebbe influenzare il clinico a somministrare farmaci anti-osteoporosi laddove non sarebbe indicato dalla sola aBMD.
Uno studio sul Trabecular Bone Score (TBS) mostra che questa valutazione aggiuntiva influenza significativamente le decisioni terapeutiche nell'osteoporosi secondaria [67]. In quello studio, il 21-25,5% dei pazienti con misurazioni BMD non degne di nota aveva una scarsa qualità ossea indicata dal TBS, che ha cambiato la decisione terapeutica. Un effetto simile potrebbe verificarsi con la 3D-DXA, portando potenzialmente a conseguenze indesiderate, come la sovrainclusione. Se la tabella venisse utilizzata, ciò potrebbe anche influenzare il clinico a scegliere un farmaco rispetto all'altro.
Viene anche affermato da 3D-Shaper Medical che i pazienti possono essere monitorati per determinare se il trattamento selezionato ha effettivamente l'effetto previsto sulla corteccia e sul compartimento trabecolare. Tuttavia, considerando che gli errori della 3D-DXA sono maggiori dei cambiamenti previsti e che la ripetibilità è bassa [36], non è possibile accertare se i cambiamenti osservati in una valutazione 3D-DXA di follow-up siano dovuti a effetti reali o semplicemente all'errore intrinseco della 3D-DXA. Se un clinico si fida di questi risultati, potrebbe essere influenzato a cambiare inutilmente il trattamento.
(A)
| aBMD DXA 2D (Totale anca) | vBMD Trabecolare 3D-DXA (3D-Shaper) | sBMD Corticale 3D-DXA (3D-Shaper) | |
|---|---|---|---|
| Alendronato | + | + | + |
| Denosumab | ++ | ++ | ++ |
| Acido zoledronico | + | + | ++ |
| Teriparatide [15, 52, 55*, 56] | + | ++ | = |
| Abaloparatide | ++ | ++ | ++ |
| Romosozumab | +++ | +++ | +++ |
(B)
| aBMD | vBMD | sBMD | |
|---|---|---|---|
| Teriparatide [52, 56] (18 mesi) | ++ (3.3%) | ++/+++ (9%) | + (1.8%) |
| Teriparatide [15] (24 mesi) | = (p > 0.05) | ++/+++ (5.9%) | = (p > 0.05) |
| Teriparatide [60] (24 mesi) | = (p > 0.05) | ++/+++ (>14%) | = (p > 0.05) |
(C)
| Simbolo | aBMD (Totale anca) | vBMD Trabecolare | sBMD Corticale |
|---|---|---|---|
| +++ | Δ > n/a % | Δ > n/a % | Δ > n/a % |
| ++ | 2 < Δ ≤ n/a % | 4 < Δ ≤ n/a % | 2 < Δ ≤ n/a % |
| + | 0.5 < Δ ≤ 2 % | 0.5 < Δ ≤ 4 % | 0.5 < Δ ≤ 2 % |
| = | -0.5 ≤ Δ ≤ 0.5 % | -0.5 ≤ Δ ≤ 0.5 % | -0.5 ≤ Δ ≤ 0.5 % |
| - | -2 ≤ Δ < -0.5 % | -4 ≤ Δ < -0.5 % | -2 ≤ Δ < -0.5 % |
| -- | Δ < -2 % | Δ < -4 % | Δ < -2 % |
Sebbene la versione clinica della 3D-DXA non fornisca informazioni sulla sBMD corticale nelle varie regioni anatomiche, visualizza un modello 3D codificato a colori della sBMD attraverso la superficie ossea. 3D-Shaper Medical suggerisce successivamente che questo può essere utilizzato per rilevare la fragilità locale [66]. Sfortunatamente, la 3D-DXA non può ricostruire la mappa corticale specifica del paziente. Farò nuovamente riferimento alla Figura 2 per una spiegazione intuitiva di questo. Pertanto, se una mappa corticale 3D-DXA suggerisce carenze locali, queste possono essere output statisticamente plausibili del modello, ma non corrispondono all'effettiva anatomia del paziente. Anche questo può portare a una decisione terapeutica non necessaria o inappropriata.
Il software 3D-Shaper ha ora ricevuto anche l'autorizzazione FDA attraverso il processo di notifica pre-commercializzazione 510(k) [68]. 3D-Shaper Medical ha ottenuto questo utilizzando uno studio di correlazione che confronta l'area della sezione trasversale (CSA), il momento d'inerzia della sezione trasversale (CSMI), il modulo di sezione (Z), il rapporto di instabilità (BR), la densità minerale ossea della superficie corticale (sBMD), la densità minerale ossea volumetrica trabecolare (vBMD) e la vBMD integrale con misurazioni simili dal software Hip Structural Analysis (HSA) di Hologic Inc., che aveva precedentemente ricevuto l'autorizzazione FDA.
In particolare, la lunghezza dell'asse del collo e l'angolo dell'asse del collo sono rimasti assenti da questa valutazione e quindi l'uso di questi parametri non è autorizzato dalla FDA. Va notato che le linee guida della International Society for Clinical Densitometry (ISCD) raccomandano che i parametri HSA non debbano essere utilizzati per valutare il rischio di frattura dell'anca, ad eccezione della lunghezza dell'asse dell'anca [69]. Inoltre, questa approvazione normativa non include un T-score o uno Z-score per confrontare le misurazioni con i dati di riferimento. Ciò solleva preoccupazioni sull'applicabilità clinica di 3D-Shaper negli Stati Uniti.
Infine, i parametri 3D-Shaper sono stati considerati sostanzialmente equivalenti all'opzione HSA per i densitometri ossei a raggi X Hologic QDR. La FDA non è in grado di confermare se 3D-Shaper possa essere utilizzato con altri scanner DXA, lasciando irrisolta la questione della compatibilità con altri dispositivi negli Stati Uniti.
Discussione
In sintesi, la 3D-DXA produce una varietà di parametri ossei che appaiono altamente dettagliati, ma riflettono principalmente l'aBMD areale complessiva piuttosto che misurare distinte proprietà corticali o trabecolari. Mentre il software può produrre risultati che sono correlati ai valori reali nelle popolazioni in cui i cambiamenti corticali e trabecolari sono proporzionali all'aBMD, non riesce a catturare misurazioni specifiche per il paziente o cambiamenti localizzati. Questa limitazione è particolarmente pronunciata in scenari come la terapia anabolica, in cui i parametri ossei corticali e trabecolari possono cambiare inversamente e la 3D-DXA non riesce a riflettere questi veri cambiamenti osservati dalla QCT. Ciò solleva notevoli preoccupazioni per il suo utilizzo nella cura clinica di routine o come strumento di ricerca affidabile.La 3D-DXA è stata inizialmente sviluppata per diagnosticare meglio l'osteoporosi fornendo una stima della vBMD integrale [70, 71]. Non tentando di valutare separatamente i compartimenti corticale e trabecolare, la vBMD integrale prodotta dalla 3D-DXA può ancora rappresentare una stima valida. La metodologia è stata successivamente estesa per tentare di migliorare le stime del rischio di frattura analizzando direttamente i parametri del modello, poiché questi parametri descrivono completamente la morfologia del modello statistico [51, 72, 73, 74]. Tuttavia, le limitazioni chiave della 3D-DXA, come dettagliato in questa recensione, rimangono e minano la sua accuratezza e affidabilità.
Questo studio è stato limitato dalla mancanza di trasparenza da parte delle aziende che commercializzano la 3D-DXA, tra cui 3D-Shaper Medical, DMS Imaging e Fujifilm. Di conseguenza, si basa sulle informazioni pubblicamente disponibili e sulla mia esperienza nello sviluppo di questa metodologia. Incoraggio i lettori a chiedere chiarimenti a queste aziende o ai loro rappresentanti in merito agli aspetti di 3D-DXA e 3D-Shaper che non sono stati divulgati.
Le valutazioni delle società professionali potrebbero fornire una guida preziosa fornendo valutazioni indipendenti della validità della 3D-DXA e stabilendo raccomandazioni ufficiali riguardanti il suo utilizzo. Sebbene un aggiornamento sulla linea guida pratica per l'assorbimetria a raggi X a doppia energia da parte dell'International Working Group on DXA Best Practices affermi riguardo alla 3D-DXA che "sono necessarie ulteriori prove per formulare raccomandazioni per l'applicazione di queste nuove tecniche di imaging nella pratica clinica" [75], credo che ci siano ora prove sufficienti su cui basare una raccomandazione e spero che questa recensione sia utile a tale riguardo.
In conclusione, date le limitazioni fondamentali della 3D-DXA, è la mia valutazione professionale che i parametri corticali e trabecolari forniti dalla 3D-DXA non dovrebbero essere utilizzati per scopi di ricerca, né sono adatti per applicazioni cliniche come diagnosi, monitoraggio o supporto alle decisioni terapeutiche.
Contributi degli autori
TW ha contribuito alla concettualizzazione, alla cura dei dati, all'analisi formale, all'indagine, alla metodologia, alle risorse, alla visualizzazione e alla stesura del manoscritto.Finanziamento
Nessun finanziamento è stato ricevuto per questo studio.Disponibilità dei dati
Tutti i dati presentati in questo articolo sono disponibili presso l'autore su richiesta.Conflitti di interesse
L'autore è co-inventore di un brevetto relativo alla metodologia alla base del software 3D-DXA. L'autore è stato coinvolto in discussioni riguardanti la proprietà intellettuale e le origini del codice software commerciale 3D-DXA, dei modelli statistici e del materiale promozionale. L'autore non è affiliato con 3D-Shaper Medical o altre società coinvolte nello sfruttamento commerciale della 3D-DXA e non ha ricevuto azioni, royalties o altri compensi finanziari. L'autore ha tenuto conferenze per UCB in fori educativi e ha ricevuto supporto per borse di ricerca da Amgen Inc. e Lilly. Le opinioni espresse in questo articolo sono esclusivamente quelle dell'autore e si basano su una valutazione critica della metodologia e delle prove scientifiche disponibili.Bibliografia
- Whitmarsh T (2012). 3D Reconstruction of the Proximal Femur and Lumbar Vertebrae from Dual-Energy X-Ray Absorptiometry for Osteoporotic Risk Assessment
- Humbert L, Martelli Y, Fonolla R, et al. (2017). 3D-DXA: Assessing the Femoral Shape, the Trabecular Macrostructure and the Cortex in 3D from DXA images. IEEE Transactions on Medical Imaging, 36(1), 27–39.
- Whitmarsh T, Humbert L, De Craene M, et al. (2011). Reconstructing the 3D Shape and Bone Mineral Density Distribution of the Proximal Femur From Dual-Energy X-Ray Absorptiometry. IEEE Transactions on Medical Imaging, 30(12), 2101–2114.
- Ahmad O, Ramamurthi K, Wilson KE, et al. (2010). Volumetric DXA (VXA): A new method to extract 3D information from multiple in vivo DXA images. Journal of Bone and Mineral Research, 25(12), 2744–2751.
- Väänänen SP, Grassi L, Flivik G, et al. (). Generation of 3D shape, density, cortical thickness and finite element mesh of proximal femur from a DXA image. Medical Image Analysis, 24(1).
- Whitmarsh T, Humbert L, De Craene M, et al. 3D bone mineral density distribution and shape reconstruction of the proximal femur from a single simulated DXA image: an in vitro study. In: Dawant BM, Haynor DR, eds. Medical Imaging 2010: Image Processing. Vol. 7623. SPIE; 2010:76234U.
- Whitmarsh T. Concerns regarding the use of 3D-DXA. Bone. 2021;149:115939.
- Treece G, Gee A (2015). Independent measurement of femoral cortical thickness and cortical bone density using clinical CT. Medical Image Analysis, 20(1), 249–264.
- Freitas L, Amorim T, Humbert L, et al. (2018). Cortical and trabecular bone analysis of professional dancers using 3D-DXA: a case–control study. Journal of Sports Sciences, 37(1), 82–89.
- Gracia-Marco L, García-Fontana B, Ubago-Guisado E, et al. (2019). Analysis of Bone Impairment by 3D DXA Hip Measures in Patients With Primary Hyperparathyroidism: A Pilot Study. The Journal of Clinical Endocrinology \& Metabolism, 105(1), 175–184.
- Orduna G, Humbert L, Fonolla R, et al. (2018). Cortical and Trabecular Bone Analysis of Patients With High Bone Mass From the Barcelona Osteoporosis Cohort Using 3-Dimensional Dual-Energy X-ray Absorptiometry: A Case-Control Study. Journal of Clinical Densitometry, 21(4), 480–484.
- Gifre L, Humbert L, Muxi A, et al. (2017). Analysis of the evolution of cortical and trabecular bone compartments in the proximal femur after spinal cord injury by 3D-DXA. Osteoporosis International, 29(1), 201–209.
- García Hoyos M, Humbert L, Salmón Z, et al. (2019). Analysis of volumetric BMD in people with Down syndrome using DXA-based 3D modeling. Archives of Osteoporosis, 14(1).
- Beck B, Harding A, Weeks B, et al. (2021). Response to “Concerns regarding the use of 3D-DXA”. Bone, 149, 115936.
- Winzenrieth R, Humbert L, Di Gregorio S, Bonel E, García M, Del Rio L. Effects of osteoporosis drug treatments on cortical and trabecular bone in the femur using DXA-based 3D modeling. Osteoporos Int.2018;29(10):2323–2333.
- Cummings SR, Cauley JA, Palermo L, et al. Racial differences in hip axis lengths might explain racial differences in rates of hip fracture. Osteoporos Int.1994;4(4):226–229.
- Kim KM, Brown JK, Kim KJ, et al. Differences in femoral neck geometry associated with age and ethnicity. Osteoporos Int. 2010;22(7):2165–2174.
- Sone T, Humbert L, Lopez M, et al. (2022). Assessment of femoral shape, trabecular and cortical bone in Japanese subjects using DXA-based 3D modelling. JOURNAL OF BONE AND MINERAL RESEARCH, 37, 214--214.
- Varoquaux G, Cheplygina V (2022). Machine learning for medical imaging: methodological failures and recommendations for the future. npj Digital Medicine, 5(1).
- Hadjiiski L, Cha K, Chan H, et al. (). AAPM task group report 273: Recommendations on best practices for AI and machine learning for computer‐aided diagnosis in medical imaging. Medical Physics, 50(2).
- Huisman M (2024). When AUC-ROC and accuracy are not accurate: what everyone needs to know about evaluating artificial intelligence in radiology. European Radiology, 34(12), 7892–7894.
- Gallifant J, Bitterman DS, Celi LA, et al. (2024). Ethical debates amidst flawed healthcare artificial intelligence metrics. npj Digital Medicine, 7(1).
- Amani A, Bellver M, del Rio L, et al. (2022). Femur 3D-DXA Assessment in Female Football Players, Swimmers, and Sedentary Controls. International Journal of Sports Medicine, 44(06), 420–426.
- Maïmoun L, Renard E, Humbert L, et al. (2021). Modification of bone mineral density, bone geometry and volumetric BMD in young women with obesity. Bone, 150, 116005.
- Jain RK, López Picazo M, Humbert L, et al. (2025). Bone Structural Parameters as Measured by 3-Dimensional Dual-Energy X-Ray Absorptiometry Are Superior in Black Women and Demonstrate Unique Associations With Prior Fracture Versus White Women. Endocrine Practice, 31(2), 152–158.
- Gracia-Marco L, Gonzalez-Salvatierra S, Garcia-Martin A, et al. (2021). 3D DXA Hip Differences in Patients with Acromegaly or Adult Growth Hormone Deficiency. Journal of Clinical Medicine, 10(4), 657.
- Toussirot E, Winzenrieth R, Aubin F, et al. (2024). Areal bone mineral density, trabecular bone score and 3D-DXA analysis of proximal femur in psoriatic disease. Frontiers in Medicine, 11.
- Ubago-Guisado E, Moratalla-Aranda E, González-Salvatierra S, et al. (2023). Do patients with type 2 diabetes have impaired hip bone microstructure? A study using 3D modeling of hip dual-energy X-ray absorptiometry. Frontiers in Endocrinology, 13.
- Guerra FS, Palladino N, Winzenrieth R, et al. (2024). Advanced 3D-DXA insights into bone density changes in hyperparathyroidism. Journal of Diabetes \& Metabolic Disorders, 23(2), 2191–2199.
- Kužma M, Vaňuga P, Ságová I, et al. Non-invasive DXA derived bone structure assessment of acromegaly patients: a cross sectional study. Eur J Endocrinol. 2019;180(3):201–211.
- Maïmoun L, Aouinti S, Puech M, et al. Modification of bone architecture following sleeve gastrectomy: a five-year follow-up. J Bone Miner Res. 2024;40(2):251–261.
- Maïmoun L, Gelis A, Serrand C, et al. (2023). Alteration of Volumetric Bone Mineral Density Parameters in Men with Spinal Cord Injury. Calcified Tissue International, 113(3), 304–316.
- Harding AT, Weeks BK, Lambert C, et al. (2020). Effects of supervised high-intensity resistance and impact training or machine-based isometric training on regional bone geometry and strength in middle-aged and older men with low bone mass: The LIFTMOR-M semi-randomised controlled trial. Bone, 136, 115362.
- Gil-Cosano JJ, Ubago-Guisado E, Sánchez MJ, et al. (2020). The effect of an online exercise programme on bone health in paediatric cancer survivors (iBoneFIT): study protocol of a multi-centre randomized controlled trial. BMC Public Health, 20(1).
- Humbert L, Whitmarsh T, De Craene M, et al. (2010). 3D reconstruction of both shape and Bone Mineral Density distribution of the femur from DXA images. 2010 IEEE International Symposium on Biomedical Imaging: From Nano to Macro, 456–459.
- O’Rourke D, Beck BR, Harding AT, et al. (2021). Assessment of femoral neck strength and bone mineral density changes following exercise using 3D-DXA images. Journal of Biomechanics, 119, 110315.
- Dudle A, Gugler Y, Pretterklieber M, et al. (2023). 2D-3D reconstruction of the proximal femur from DXA scans: Evaluation of the 3D-Shaper software. Frontiers in Bioengineering and Biotechnology, 11.
- Clotet J, Martelli Y, Di Gregorio S, et al. (2018). Structural Parameters of the Proximal Femur by 3-Dimensional Dual-Energy X-ray Absorptiometry Software: Comparison With Quantitative Computed Tomography. Journal of Clinical Densitometry, 21(4), 550–562.
- Ramamurthi K, Ahmad O, Engelke K, et al. (2011). An in vivo comparison of hip structure analysis (HSA) with measurements obtained by QCT. Osteoporosis International, 23(2), 543–551.
- Whitmarsh T, Treece GM, Gee AH, et al. (2015). Mapping Bone Changes at the Proximal Femoral Cortex of Postmenopausal Women in Response to Alendronate and Teriparatide Alone, Combined or Sequentially. Journal of Bone and Mineral Research, 30(7), 1309–1318.
- Whitmarsh T, Treece GM, Gee AH, et al. (2016). The Effects on the Femoral Cortex of a 24 Month Treatment Compared to an 18 Month Treatment with Teriparatide: A Multi-Trial Retrospective Analysis. PLOS ONE, 11(2), e0147722.
- Huininga K, Koromani F, Zillikens M, et al. (2024). Use of 3D Shaper Analysis for the Assessment of Fracture Risk in a Population-Based Setting. JBMR Plus, 8(Supplement\_1), i1--i340.
- Huininga K, Koromani F, Zillikens MC, et al. (2024). Use of 3D Shaper Analysis for the Assessment of Fracture Risk in a Population-based Setting. ASBMR 2024 Annual Meeting Abstracts and Abstract Book.
- Qasim M, López Picazo M, Ruiz Wills C, et al. (2024). 3D-DXA Based Finite Element Modelling for Femur Strength Prediction: Evaluation Against QCT. Journal of Clinical Densitometry, 27(2), 101471.
- Iki M, Winzenrieth R, Tamaki J, et al. (2021). Predictive ability of novel volumetric and geometric indices derived from dual-energy X-ray absorptiometric images of the proximal femur for hip fracture compared with conventional areal bone mineral density: the Japanese Population-based Osteoporosis (JPOS) Cohort Study. Osteoporosis International, 32(11), 2289–2299.
- Grassi L, Väänänen SP, Ristinmaa M, et al. Prediction of femoral strength using 3D finite element models reconstructed from DXA images: validation against experiments. Biomechanics and Modeling in Mechanobiology, 16(3).
- Grassi L, Fleps I, Sahlstedt H, et al. (). Validation of 3D finite element models from simulated DXA images for biofidelic simulations of sideways fall impact to the hip. Bone, 142.
- Grassi L, Väänänen SP, Jehpsson L, et al. (). 3D Finite Element Models Reconstructed From 2D Dual‐Energy X‐Ray Absorptiometry (DXA) Images Improve Hip Fracture Prediction Compared to Areal BMD in Osteoporotic Fractures in Men (MrOS) Sweden Cohort. Journal of Bone and Mineral Research, 38(9).
- Grassi L, Väänänen SP, Voss A, et al. DXA-based 3D finite element models predict hip fractures better than areal BMD in elderly women. Bone. 2025;195:117457.
- Allison SJ, Poole KES, Treece GM, et al. (2015). The Influence of High-Impact Exercise on Cortical and Trabecular Bone Mineral Content and 3D Distribution Across the Proximal Femur in Older Men: A Randomized Controlled Unilateral Intervention. Journal of Bone and Mineral Research, 30(9), 1709–1716.
- Whitmarsh T, Fritscher KD, Humbert L, et al. (2011). Hip fracture discrimination using 3D reconstructions from Dual-energy X-ray Absorptiometry. 2011 IEEE International Symposium on Biomedical Imaging: From Nano to Macro, 1189–1192.
- Winzenrieth R, Ominsky M, Wang Y, et al. (2021). Differential effects of abaloparatide and teriparatide on hip cortical volumetric BMD by DXA-based 3D modeling. Osteoporosis International, 32(3), 575–583.
- England JR, Cheng PM (2019). Artificial Intelligence for Medical Image Analysis: A Guide for Authors and Reviewers. American Journal of Roentgenology, 212(3), 513–519.
- Lewiecki EM, Betah D, Humbert L, et al. (2024). 3D-modeling from hip DXA shows improved bone structure with romosozumab followed by denosumab or alendronate. Journal of Bone and Mineral Research, 39(4), 473–483.
- Winzenrieth R, Kostenuik P, Boxberger J, et al. (2022). Proximal Femur Responses to Sequential Therapy With Abaloparatide Followed by Alendronate in Postmenopausal Women With Osteoporosis by 3D Modeling of Hip Dual‐Energy X‐Ray Absorptiometry (DXA). JBMR Plus, 6(4).
- Winzenrieth R, Humbert L, Boxberger JI, et al. (2022). Abaloparatide Effects on Cortical Volumetric BMD and Estimated Strength Indices of Hip Subregions by 3D-DXA in Women With Postmenopausal Osteoporosis. Journal of Clinical Densitometry, 25(3), 392–400.
- Bennett C, Miller M, Wolford G (2009). Neural correlates of interspecies perspective taking in the post-mortem Atlantic Salmon: an argument for multiple comparisons correction. NeuroImage, 47, S125.
- Poole KE, Treece GM, Gee AH, et al. (2014). Denosumab Rapidly Increases Cortical Bone in Key Locations of the Femur: A 3D Bone Mapping Study in Women With Osteoporosis. Journal of Bone and Mineral Research, 30(1), 46–54.
- Sato M, Westmore M, Ma YL, et al. (2004). Teriparatide [PTH(1–34)] Strengthens the Proximal Femur of Ovariectomized Nonhuman Primates Despite Increasing Porosity. Journal of Bone and Mineral Research, 19(4), 623–629.
- Hadji P, Kamali L, Thomasius F, et al. (2024). Real-world efficacy of a teriparatide biosimilar (RGB-10) compared with reference teriparatide on bone mineral density, trabecular bone score, and bone parameters assessed using quantitative ultrasound, 3D-SHAPER® and high-resolution peripheral computer tomography in postmenopausal women with osteoporosis and very high fracture risk. Osteoporosis International, 35(12), 2107–2116.
- Sone T, Ohnaru K, Sugai T, et al. (2023). The effects of abaloparatide on hip geometry and biomechanical properties in Japanese osteoporotic patients assessed using DXA-based hip structural analysis: results of the Japanese phase 3 ACTIVE-J trial. Archives of Osteoporosis, 18(1).
- Genant HK, Engelke K, Bolognese MA, et al. (2016). Effects of Romosozumab Compared With Teriparatide on Bone Density and Mass at the Spine and Hip in Postmenopausal Women With Low Bone Mass. Journal of Bone and Mineral Research, 32(1), 181–187.
- MEDICAL 3S (2021). Webinar - Use of 3D-Shaper in clinical research: state of the art and potential applications
- Casado Burgos E, Di Gregorio S, González Macías J, et al. (2019). Datos de referencia de mediciones óseas en modelos 3D de fémur proximal en población española cn DXA: Proyecto SEIOMM 3D-SHAPPER. Congreso SEIOMM (24º : 2019 : Gerona).
- Brance ML, Saravi FD, Henr{\'i}quez MM, et al. (2020). Reference Values of Three-Dimensional Proximal Femur Parameters from Bone Densitometry Images in Healthy Subjects from Argentina. World Congress on Osteoporosis, Osteoarthritis and Musculoskeletal Diseases, 372--372.
- Jennings I (). 3D Shaper Technology: Revolutionizing Bone Health Analysis
- Al-Hashimi L, Klotsche J, Ohrndorf S, et al. (2023). Trabecular Bone Score Significantly Influences Treatment Decisions in Secondary Osteoporosis. Journal of Clinical Medicine, 12(12), 4147.
- Food {, Administration} D (2022). 510(k) Summary: K220822
- Broy SB, Cauley JA, Lewiecki ME, et al. (2015). Fracture Risk Prediction by Non-BMD DXA Measures: the 2015 ISCD Official Positions Part 1: Hip Geometry. Journal of Clinical Densitometry, 18(3), 287–308.
- Whitmarsh T, Humbert L, Craene MD, et al. (2009). Reconstrucción de la forma del fémur y densidad mineral ósea en 3D para el diagnóstico de osteoporosis a partir de DXA
- Whitmarsh T, Humbert L, Del Río Barquero LM, et al. (2011). Volumetric Bone Mineral Density Estimation using a 3D Reconstruction Method from Dual-energy X-ray Absorptiometry. ASBMR 2011 Annual Meeting Abstracts and Abstract Book.
- Whitmarsh T, Fritscher KD, Humbert L, et al. (2011). A Statistical Model of Shape and Bone Mineral Density Distribution of the Proximal Femur for Fracture Risk Assessment. Medical Image Computing and Computer-Assisted Intervention – MICCAI 2011, 393–400.
- Whitmarsh T, Fritscher KD, Humbert L, et al. (2012). Hip fracture discrimination from dual-energy X-ray absorptiometry by statistical model registration. Bone, 51(5), 896–901.
- Martelli Y, Whitmarsh T, Humbert L, et al. (2012). A software framework for 3D reconstruction and fracture risk assessment of the proximal femur from dual-energy x-ray absorptiometry. Proceedings of VPH 2012: Virtual Physiological Human - Integrative approaches to computational biomedicine.
- Slart RHJA, Punda M, Ali DS, et al. (2024). Updated practice guideline for dual-energy X-ray absorptiometry (DXA). European Journal of Nuclear Medicine and Molecular Imaging, 52(2), 539–563.