Résumé
Le 3D-DXA, tel qu'implémenté dans l'outil logiciel 3D-Shaper, est une méthode logicielle qui génère une reconstruction 3D du fémur proximal à partir d'une seule image DXA 2D par recalage d'un modèle statistique. Les implémentations de 3D-DXA visent à fournir des estimations des paramètres trabéculaires, corticaux et structurels similaires à ceux dérivés de la tomodensitométrie quantitative (QCT). En tant qu'inventeur et développeur des méthodes logicielles sur lesquelles le 3D-DXA est basé, j'ai observé son adoption et son utilisation généralisée avec une inquiétude croissante. Cet article fournit une évaluation critique des limitations méthodologiques inhérentes au 3D-DXA et discute de leurs implications pour la recherche et les soins aux patients. Le problème principal est que la visibilité limitée du cortex dans une image DXA empêche le 3D-DXA de dériver avec précision les paramètres corticaux. Au lieu de cela, le logiciel s'appuie sur des prédictions basées sur la DMO globale plutôt que sur des mesures corticales directes. Cela peut conduire à des résultats qui ne reflètent pas les mesures corticales réelles. Des préoccupations supplémentaires incluent le biais de population dû au fait que le modèle statistique est dérivé d'une démographie spécifique, et la précision limitée de la reconstruction en utilisant des images DXA à vue unique. Ces limitations ont probablement entraîné des mesures et des résultats de recherche incorrects, qui sont largement passés inaperçus en raison de l'utilisation de mesures d'évaluation de la performance inappropriées et de l'absence de corrections pour comparaisons multiples dans les études impliquant le 3D-DXA. Malgré ces limitations, le 3D-DXA a reçu une approbation réglementaire dans divers pays, compromettant potentiellement l'exactitude des diagnostics cliniques et des décisions de traitement. En mettant en lumière ces problèmes, cet article vise à informer les cliniciens, les chercheurs et les organismes de réglementation sur les limitations significatives du 3D-DXA. Il souligne le besoin urgent d'une réévaluation de son utilisation dans les contextes de recherche et cliniques pour éviter une mauvaise interprétation des résultats et pour assurer la sécurité des patients.Mots-clés
3D-DXA, 3D-Shaper, Tomodensitométrie Quantitative, Densité Minérale Osseuse, Absorptiométrie à Rayons X à Double Énergie, Cartographie des Paramètres Corticaux, Analyse de la Structure de la Hanche.Résumé vulgarisé
Cette revue examine de manière critique le logiciel 3D-DXA, également connu sous le nom de 3D-Shaper, qui vise à estimer les paramètres trabéculaires, corticaux et structurels du fémur proximal à partir d'une seule image DXA. Le 3D-DXA présente plusieurs limitations inhérentes qui peuvent conduire à des mesures inexactes, affectant potentiellement les résultats de la recherche et les décisions de traitement des patients. Comprendre ces problèmes est crucial pour les chercheurs et les cliniciens afin d'éviter des interprétations erronées qui pourraient impacter nos connaissances sur la physiologie osseuse, les effets des traitements médicamenteux et la sécurité des patients.Introduction
Le 3D-DXA est une méthode logicielle qui recale un modèle statistique 3D déformable sur une seule image DXA 2D pour générer un modèle 3D du fémur proximal [1]. Le modèle est construit à partir d'un ensemble de scans de tomodensitométrie quantitative (QCT) d'une population caucasienne espagnole de 81 femmes et 30 hommes avec un âge moyen de 56,2 ± 12,1 ans, allant de 30 à 84 ans [2]. Les paramètres du modèle statistique décrivent ensuite la variation principale de forme et de distribution de densité de cette population. Dans un processus itératif, les paramètres du modèle, ainsi que la localisation, l'orientation et la taille, sont recherchés pour tenter de faire ressembler la projection du modèle à l'image DXA (Figure 1). À partir du modèle 3D résultant, les paramètres corticaux sont ensuite mesurés sur la surface osseuse, ainsi que les valeurs de DMO volumétrique trabéculaire à l'intérieur. Une erreur absolue moyenne de 0,33 mm pour l'épaisseur corticale et de 72 mg/cm³ pour la densité corticale a été rapportée lors de la comparaison du 3D-DXA au QCT, avec des coefficients de corrélation supérieurs ou égaux à 0,86 [2].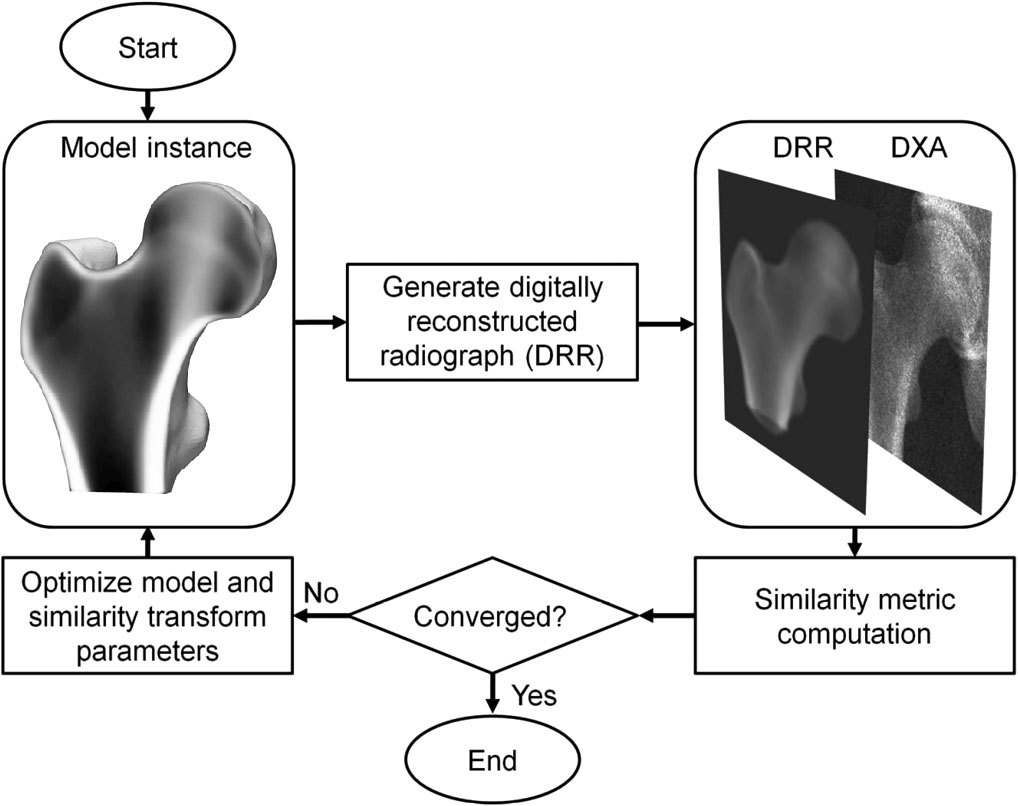
Bien que d'autres méthodes aient été proposées pour la reconstruction 3D de structures osseuses à partir d'images DXA à l'aide d'un modèle statistique [4, 5], c'est la méthode logicielle d'abord publiée en 2010 [6] qui a ensuite été commercialisée sous le nom de 3D-DXA par Galgo Medical SL (Barcelone, Espagne), une entreprise dérivée de l'Université Pompeu Fabra (Barcelone, Espagne). Ce logiciel a ensuite été étendu pour mesurer l' épaisseur corticale et la densité minérale osseuse (DMO) corticale à partir des reconstructions volumétriques [2], ce qui est maintenant commercialisé sous le nom de 3D-Shaper par 3D-Shaper Medical SL (Barcelone, Espagne), une autre entreprise dérivée de Galgo Medical SL, fournissant à la fois un service et un logiciel. Le logiciel est sous licence de DMS Imaging (Mauguio, France) pour être vendu sous le nom de 3D-DXA avec leurs appareils DXA Stratos/Medix. Fujifilm (Tokyo, Japon) vend les mêmes appareils DXA de DMS sous la marque Fujifilm FDX Visionary DXA. De plus, Imex Medical (São José, Brésil) vend ces appareils sous la série Elipse et Radiología SA (Madrid, Espagne) les vend sous le nom de Radioscore - DR. Tous incluent l'option d'ajouter le 3D-DXA.
Ayant développé la méthode logicielle originale [1], je possède une compréhension approfondie de ses limitations inhérentes qui peuvent ne pas être apparentes pour d'autres utilisateurs et chercheurs. Bien que j'aie expliqué la principale limitation de ce logiciel dans une lettre à l'éditeur de Bone [7], le 3D-DXA continue d'être vendu et utilisé dans le monde entier. 3D-Shaper a reçu l'approbation des autorités réglementaires dans l'UE, au Japon, en Thaïlande, en Argentine, et une autorisation 510(k) de la FDA, autorisant son utilisation pour diagnostiquer et prendre des décisions de traitement chez les patients. Compte tenu de ces approbations, il est critique et urgent d'aborder et de clarifier certaines des idées fausses sur ce logiciel, améliorant ainsi la compréhension de ses limitations.
Limitations méthodologiques
Dans cette section, j'expliquerai certaines des limitations de la méthodologie sur laquelle repose le 3D-DXA, ainsi que des détails d'implémentation spécifiques qui peuvent contribuer à des inexactitudes supplémentaires.Les paramètres corticaux ne sont pas mesurés
Le problème principal réside dans le manque de visibilité du cortex dans les images DXA pour que le 3D-DXA puisse en dériver ses paramètres corticaux. Pour illustrer cela, je voudrais revenir sur une figure de la lettre à l'éditeur de Bone (Figure 2). L'image DXA montre clairement qu'à la plupart des endroits de la surface osseuse, il n'y a pas de cortex discernable pour en dériver les paramètres corticaux. Cela s'applique au contour de la projection osseuse (A) et est particulièrement vrai là où deux cortex opposés sont perpendiculaires au détecteur de rayons X (B). C'est évident dans cette image provenant du scanner GE iDXA avec une taille de pixel de 0,3 x 0,25 mm, mais cela devient encore plus prononcé dans les images utilisant des appareils DXA GE Prodigy plus anciens, qui produisent des images de résolution considérablement inférieure avec une taille de pixel de 0,6 x 1,05 mm, mais qui sont également pris en charge par le logiciel 3D-Shaper.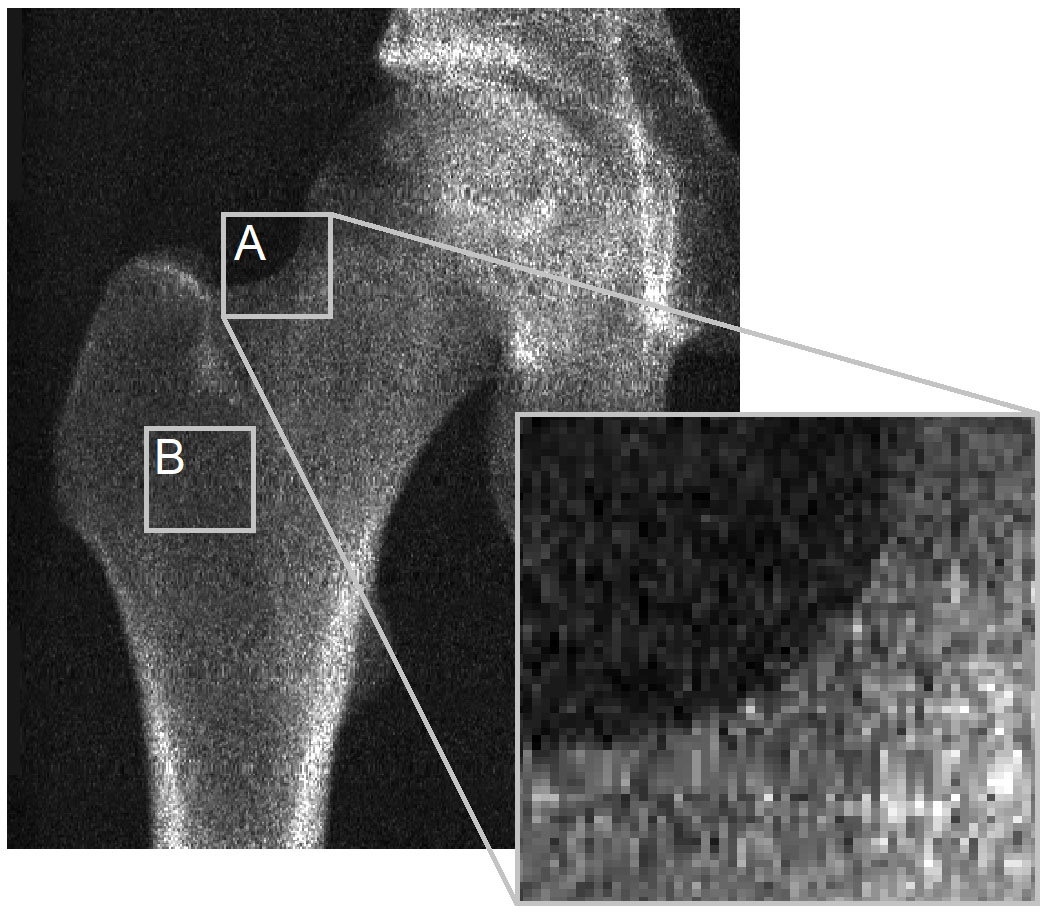
Au lieu de mesurer les paramètres corticaux directement à partir de l'image DXA, le 3D-DXA recale un modèle statistique de la forme et de la distribution de densité sur l'image DXA [7], et extrait les paramètres corticaux de ce modèle [2]. Ce modèle est construit à partir d'un ensemble de scans QCT calibrés, dans lesquels les unités Hounsfield des voxels d'un scan CT standard sont converties en valeurs de DMO à l'aide d'un fantôme de calibration.
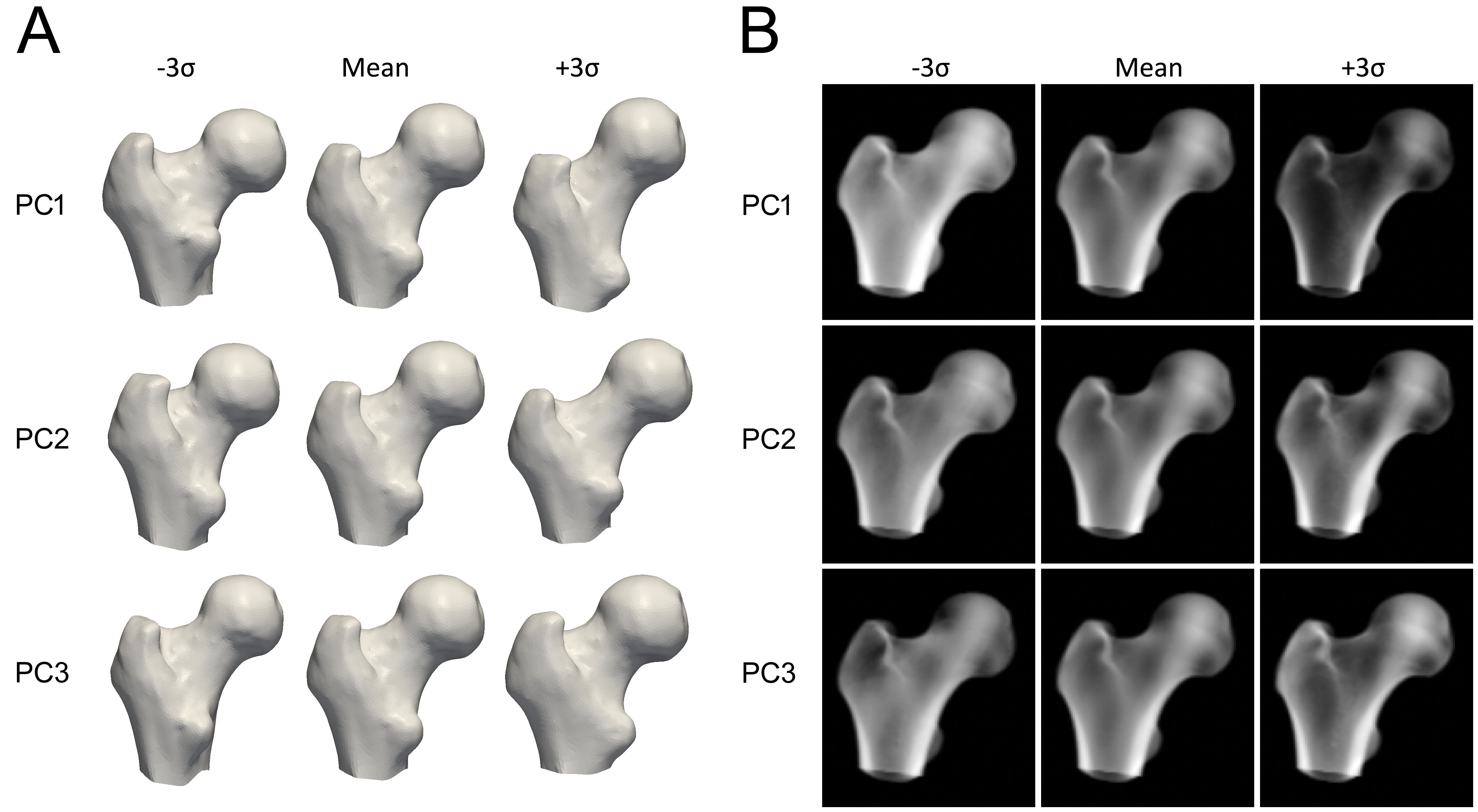
Pour construire le modèle, le fémur proximal de chaque scan QCT est d'abord segmenté, ce qui signifie qu'un maillage de surface du fémur proximal est construit. Une technique mathématique, telle que l'Analyse en Composantes Principales, est ensuite appliquée aux points des surfaces osseuses fémorales alignées, résultant en une forme moyenne et un ensemble de Composantes Principales (CP) qui décrivent les variations de forme, ordonnées par leur importance.
Pour construire le modèle statistique de la distribution de densité, les volumes QCT sont déformés vers la forme moyenne, et la même méthode statistique est appliquée aux valeurs de DMO dans les volumes, générant un volume moyen et un ensemble de CP qui décrivent la variation de la densité minérale osseuse à travers le volume.
Chaque composante principale représente la manière dont la forme ou la densité de l'os peut varier (Figure 3). Les paramètres du modèle sont des facteurs numériques qui déterminent quelle quantité de chaque composante est ajoutée au modèle moyen. L'ajustement de ces paramètres modifie la forme ou la distribution de densité, produisant de nouvelles instances de modèle. Les paramètres sont contraints à typiquement 2,5 à 3 écarts-types de sa variation pour s'assurer que le modèle osseux semble toujours réaliste selon l'ensemble de scans QCT à partir duquel il est construit. Pour créer une nouvelle instance du modèle, le volume de densité est déformé pour correspondre à la nouvelle forme, en utilisant une transformation Thin Plate Splines (TPS) calculée avec un sous-ensemble des points de forme.
Le 3D-DXA génère ensuite une reconstruction 3D en changeant itérativement les paramètres du modèle et en générant des instances de modèle correspondantes, ainsi qu'en faisant tourner et en translatant le modèle, jusqu'à ce que la projection du modèle corresponde à l'image DXA selon un seuil de métrique de similarité prédéterminé (Figure 1).
L'épaisseur corticale et la densité corticale sont ensuite mesurées à partir de l'instance du modèle en utilisant une méthode équivalente à une approche de déconvolution proposée pour le QCT [8]. Par conséquent, les paramètres corticaux ne sont pas mesurés à partir de l'image DXA, mais à partir d'un modèle paramétrique qui a été recalé sur cette image.
Ainsi, lorsque des cartes des paramètres corticaux sont présentées par le 3D-DXA, avec des valeurs à des endroits où aucun cortex n'aurait pu être mesuré [9, 10, 11, 12, 13], ces cartes étaient simplement dérivées de l'instance du modèle. Bien que 3D-Shaper Medical clarifie dans une réponse à une lettre à l'éditeur de Bone [14] que ces paramètres sont estimés plutôt que mesurés, une description plus précise serait que le 3D-DXA prédit ces valeurs en utilisant une méthode statistique complexe et potentiellement sujette aux erreurs. Compte tenu de la visibilité limitée du cortex dans les images DXA, le logiciel s'appuie principalement sur la densité osseuse globale et est contraint par les caractéristiques statistiques de la population espagnole sur laquelle le modèle est basé. Les implications plus larges de cette limitation sont explorées plus loin dans la revue.
Nombre de paramètres de modèle utilisés
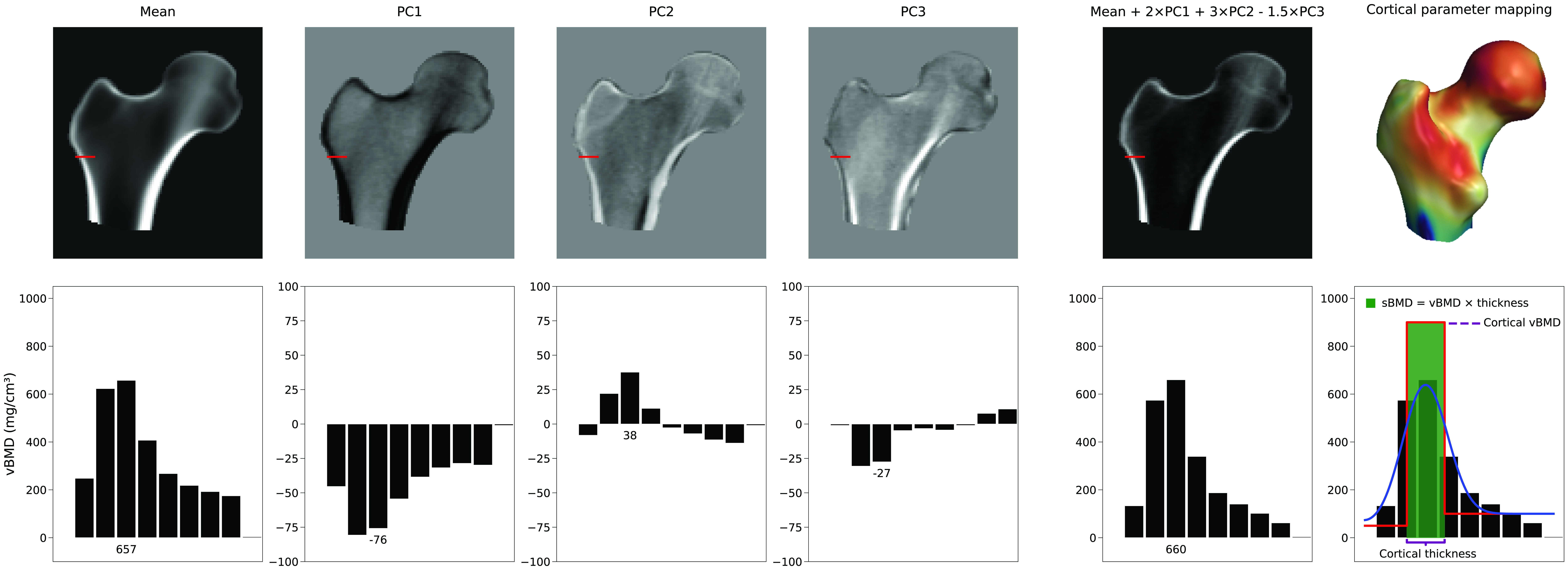
Il n'existe pas de paramètre unique qui augmente l'épaisseur corticale. Au lieu de cela, la représentation du cortex dépend d'une combinaison linéaire du volume 3D moyen et des CP du modèle de densité. Dans la Figure 4, nous pouvons voir un exemple de la façon dont la moyenne et les trois premières CP peuvent générer une nouvelle instance de modèle. Dans cet exemple, les paramètres du modèle, qui sont les facteurs d'échelle pour les CP, ont des valeurs de 2, 3 et -1,5, respectivement. Alors que CP1 augmente ou diminue la densité partout, les autres CP modifient la distribution de densité de manière non descriptive. Cette figure illustre également comment les paramètres corticaux sont ensuite estimés à partir de ce nouveau volume en ajustant un modèle en escalier lissé. Des ajustements sélectifs et indépendants de l'épaisseur corticale, de la densité corticale ou de la densité trabéculaire, s'ils sont réalisables, nécessiteraient une combinaison complexe de multiples composantes principales et, par conséquent, de nombreux paramètres de modèle.Typiquement, un sous-ensemble de composantes principales est conservé, décrivant les principaux modes de variation. Cela réduit la variation de la distribution de DMO et des points de surface à un ensemble réduit de paramètres. Le nombre de paramètres de modèle nécessaires est généralement déterminé en calculant le nombre de paramètres de modèle de forme et de densité qui décrivent 95 % des variations au sein de sa population, ou en déterminant le « coude » dans le tracé de la variance cumulée. Cependant, plus précis est d'utiliser l'analyse parallèle de Horn [6] qui évalue mathématiquement quelles CP doivent être considérées comme du bruit et peuvent donc être écartées.
Bien que le nombre de paramètres utilisés soit un élément critique dans toute approche de modélisation statistique, à ma connaissance, ce nombre, ou la méthode pour dériver ce nombre, n'a jamais été divulgué par 3D-Shaper Medical. Si le nombre de paramètres n'est pas suffisamment grand, tel que déterminé par l'analyse parallèle de Horn, il se peut qu'il ne soit pas capable de représenter avec précision toute la gamme de variation de la morphologie du fémur de la population d'entrée. De plus, si ce nombre de paramètres n'est pas le même dans les applications de recherche et cliniques, il y aura une déconnexion entre la précision rapportée et la précision clinique du 3D-DXA.
Biais de population potentiel
Tout modèle osseux 3D généré par 3D-DXA est dérivé de statistiques sur les variations de la population d'entrée. Dans le cas de 3D-Shaper, le modèle statistique est construit à partir d'une population espagnole de 81 femmes et 30 hommes avec un âge moyen de 56,2 ± 12,1 ans [30 ans – 84 ans] [2] sans traitements ni maladies ayant un impact sur le métabolisme osseux [15]. Il est clair que la morphologie du fémur diffère entre les hommes et les femmes, mais la démographie joue également un rôle important. Par exemple, les fémurs des populations caucasiennes sont significativement différents de ceux des populations asiatiques, comme documenté dans des études précédentes [16].Un modèle construit à partir d'une population caucasienne ne pourra pas générer une reconstruction qui correspond à chaque sujet d'une population asiatique. C'est parce que les paramètres d'un modèle statistique sont contraints à 3 écarts-types autour du modèle de fémur moyen d'une population espagnole. Par exemple, une étude rapporte que les femmes blanches ont une épaisseur corticale du col fémoral de 1,84 ± 0,03 mm, alors que pour les femmes coréennes, elle est de 2,41 ± 0,71 mm, telle que mesurée par des scans QCT [17]. Par conséquent, une femme coréenne avec une épaisseur corticale moyenne de 2,41 mm tomberait en dehors de la plage de variation pour une population blanche lorsqu'elle est contrainte à trois écarts-types (1,75–1,93 mm). Cet exemple illustre l'importance d'avoir un modèle qui représente la population cible.
Bien que les mesures par 3D-DXA corrèlent avec le QCT dans une population japonaise [18], c'est simplement parce que tous les paramètres corrèlent avec la DMO surfacique. Cela ne signifie pas que des reconstructions spécifiques au patient ont été obtenues. En particulier, les paramètres corticaux estimés peuvent dévier considérablement des vraies valeurs, notamment en ce qui concerne leur distribution spatiale. Même si la forme prédite du fémur est défectueuse, les valeurs de densité, y compris l'épaisseur corticale et la DMO corticale, refléteront toujours la DMOs, tant que la projection du modèle statistique chevauche largement l'os dans l'image DXA. Une personne avec une faible DMOs aura une faible DMOv, une faible DMO corticale et un cortex plus fin par rapport à un patient avec une DMOs élevée dans n'importe quelle population. De plus, [18] n'a rapporté que des corrélations, et il peut y avoir un biais significatif lors de l'application d'un modèle développé à partir d'une population espagnole à une population japonaise, ce qui pourrait avoir des conséquences cliniques. Malgré cette limitation fondamentale, le 3D-DXA est actuellement commercialisé en Asie, y compris dans des pays comme le Japon, la Thaïlande et l'Inde.
Un modèle statistique doit être entraîné sur la population à laquelle il est appliqué. Cela pourrait signifier construire des modèles séparés pour chaque sexe, origine ethnique, et potentiellement type de traitement, ou en incluant tous ces sous-groupes dans un seul modèle, à condition que suffisamment de paramètres soient conservés pour capturer toute la gamme de variabilité. Ce principe est bien établi pour les outils d'apprentissage automatique et d'intelligence artificielle [19, 20, 21, 22] mais est encore plus critique pour les approches de modélisation statistique, où les modèles sont activement contraints par la population d'entrée. Néanmoins, le 3D-DXA a été utilisé dans des études avec des populations qui diffèrent manifestement de la population du modèle, notamment : danseurs professionnels[9], footballeurs et nageurs[23] jeunes femmes souffrant d'obésité[24], femmes noires[25], patients avec une masse osseuse élevée [11], avec un déficit en hormone de croissance adulte [26] avec une maladie psoriasique [27], avec un diabète de type 2 [28], avec une hyperparathyroïdie primaire [10, 29], avec une acromégalie [30], avec le syndrome de Down [13], après une gastrectomie en manchon [31], hommes avec une lésion de la moelle épinière [32], hommes australiens d'âge moyen et plus âgés avec une faible masse osseuse [33], et peut-être le plus préoccupant de tous, les survivants de cancer pédiatrique [34].
Précision de reconstruction limitée
Le 3D-DXA est une méthode très complexe sujette aux erreurs à plusieurs étapes. Celles-ci incluent des inexactitudes provenant de la calibration QCT, du recalage déformable pour la construction de modèles statistiques, de la déformation du modèle de densité vers l'instance de forme, des divergences de DMO et de résolution entre le QCT et le DXA, et de la simplification de la projection du modèle par une projection isométrique au lieu de la projection en éventail. Chacun de ces facteurs peut introduire des biais de manière imprévisible, faussant potentiellement les résultats. De plus, des détails d'implémentation spécifiques, tels que la construction du modèle statistique à partir d'un très petit ensemble de 111 sujets espagnols adultes (ce qui limite la variance en forme, densité, et épaisseur corticale), restreignent davantage l'applicabilité de cet outil logiciel.De plus, il n'est pas clair si 3D-Shaper peut lire avec précision les fichiers de données propriétaires des appareils GE et Hologic, en particulier en ce qui concerne l'application correcte des facteurs de calibration et de correction pour des compositions corporelles variables. Ces inexactitudes potentielles peuvent influencer les résultats de 3D-Shaper lorsqu'ils sont appliqués à différentes populations ou lorsque les caractéristiques de la population dérivent au fil du temps.
Il va de soi que si la forme et l'orientation du fémur proximal ne correspondent pas parfaitement à l'image DXA, avec une précision sub-millimétrique, il ne devrait pas être possible d'extraire l'épaisseur corticale avec une précision sub-millimétrique, ni la densité corticale. Malheureusement, il n'est pas possible de générer une reconstruction parfaite à partir d'une seule image DXA 2D, comme l'a déjà montré une première étude avec 3D-DXA [35]. Il y avait été démontré que l'ajout d'une seconde vue réduit l'erreur de forme de 1,3 mm à 0,9 mm, et l'erreur de DMO de 4,4 % à 3,2 %, indiquant une reconstruction clairement sous-optimale à partir d'une seule vue. En revanche, la tomodensitométrie reconstruit un volume en utilisant des centaines de projections acquises sous tous les angles autour du fémur. Ainsi, le QCT permet la mesure indépendante des paramètres corticaux et trabéculaires.
Le 3D-DXA peut produire des modèles de fémur avec une morphologie complètement différente selon l'endroit où la recherche de paramètres de modèle a convergé, en particulier si la rotation correcte n'a pas été récupérée. Cela peut varier grandement, comme en témoigne une étude utilisant le 3D-DXA impliquant des scans DXA répétés le même jour, qui a révélé des différences de résistance prédite allant jusqu'à 62 % [36]. Cette étude a également rapporté des différences de DMO élément par élément atteignant 30 ± 50 %, ce qui se reflétera probablement aussi dans une faible précision de répétabilité pour les paramètres corticaux, bien que ces chiffres n'aient pas été fournis. Dans une étude distincte, la corrélation entre les valeurs de densité 3D-Shaper et QCT a également été rapportée comme faible (r2 = 0.48) [37], indiquant en outre une précision de reconstruction spécifique au sujet limitée.
Dans une étude sur la mesure des paramètres structurels du fémur utilisant le 3D-DXA, un coefficient de corrélation de r = 0,86 a été rapporté pour la longueur de l'axe du col fémoral [38] lors de la corrélation des mesures dérivées du volume 3D-DXA avec les mesures de vérité terrain du CT. C'est moins bon que lorsqu'il est mesuré directement dans l' image DXA (r = 0,90, [39]). De plus, les angles cervico-diaphysaires produits par le 3D-DXA sont d'une précision limitée (r = 0,71, [38]). Une raison évidente de ce manque de précision est que la tête fémorale est exclue du processus de reconstruction à l'aide d'un masque pour empêcher le chevauchement de l'hémi-bassin d'interférer avec la reconstruction, bien que cela pourrait être résolu en ajoutant un second modèle de l'hémi-bassin comme dans [5].
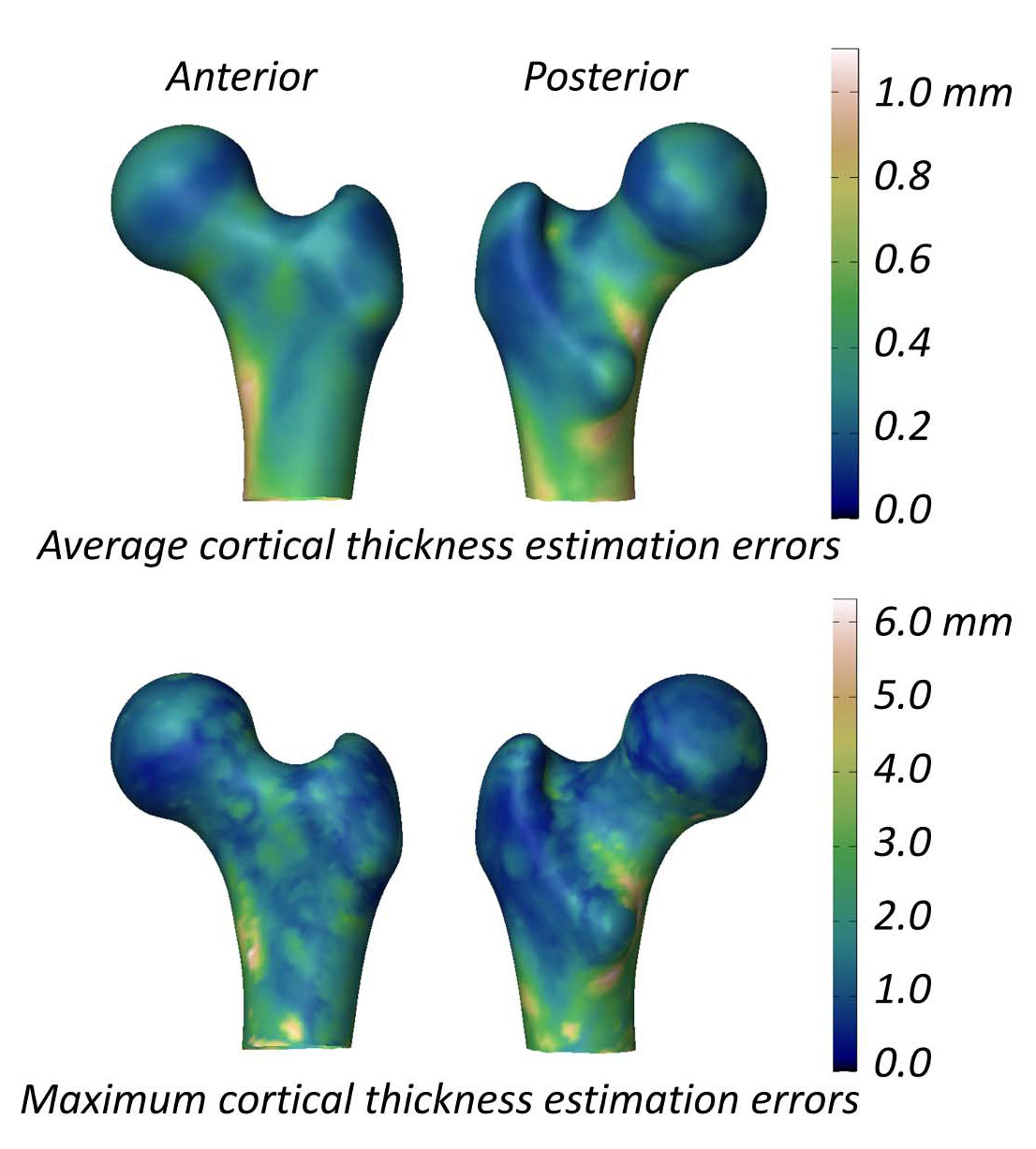
L'étude évaluant la capacité du 3D-DXA à mesurer les paramètres corticaux rapporte une différence moyenne (± écart-type) d'épaisseur corticale entre le 3D-DXA et le QCT de 0,04 ± 0,21 mm au niveau du col fémoral et de -0,07 ± 0,15 mm au niveau du trochanter [2]. Cette étude a également présenté une figure montrant les erreurs absolues moyennes et maximales d'estimation de l'épaisseur corticale sur la surface du modèle de fémur (Figure 5), avec une erreur moyenne supérieure à 0,2 mm et une erreur maximale supérieure à 1 mm sur une grande partie de la surface du fémur. En comparaison, une étude QCT mesurant les changements d'épaisseur corticale après un traitement de 18 mois à l'alendronate a rapporté une augmentation de 1,4 %, correspondant à une augmentation approximative de 0,018 mm de l'épaisseur corticale [40]. Les données compilées à partir de trois essais cliniques sur le tériparatide ont indiqué que l'épaisseur corticale augmentait de 0,035 mm [41]. Considérant que l'erreur du 3D-DXA dépasse ces changements typiques induits par le traitement, il est peu probable que les mesures 3D-DXA distinguent de manière fiable entre les véritables effets thérapeutiques et le bruit méthodologique. En d'autres termes, si l'os cortical d'un individu semble changer, il reste incertain si cela provient d'un véritable changement physiologique ou de l'erreur de mesure inhérente au 3D-DXA.
Bénéfice limité par rapport à la DMO surfacique
Dans le modèle de densité statistique utilisé par 3D-DXA, le premier paramètre du modèle représente la grande majorité de la variation, et l'augmentation de sa valeur entraîne une augmentation à la fois de la densité globale et de tous les paramètres corticaux [7]. Étant donné qu'il y a peu d'informations sur le cortex dans l'image DXA, 3D-DXA s'appuie principalement sur la densité globale, et donc sur le premier paramètre du modèle. En conséquence, les paramètres corticaux et trabéculaires sont intrinsèquement corrélés. Bien qu'il puisse y avoir une certaine contribution des cortex médial et latéral inférieurs de la diaphyse qui sont visibles dans l'image DXA, les paramètres renvoyés par 3D-DXA reflètent principalement la DMO surfacique totale (DMOs). Cela signifie que si la DMOs augmente, l'analyse 3D-DXA montrera des augmentations simultanées de la DMO trabéculaire, de la DMO corticale et de l'épaisseur corticale. En effet, une étude récente présentée au congrès de la Société Européenne des Tissus Calcifiés de 2024 [42] et à la réunion annuelle de la Société Américaine pour la Recherche Osseuse et Minérale de 2024 [43] confirme que les paramètres de 3D-Shaper sont fortement corrélés à la DMOs et ne fournissent donc pas d'informations supplémentaires sur la prédiction des fractures.De plus, bien que la reconstruction 3D-DXA capture la silhouette fémorale globale visible dans l'image DXA, sa capacité à récupérer la longueur de l'axe du col et l'angle cervico-diaphysaire est limitée. En conséquence, la forme reconstruite reflète principalement la taille générale de l'os, qui est déjà fournie par la DMOs et n'apporte pas grand-chose à la prédiction de la résistance à la fracture. Pour illustrer cela, il a été constaté que les prédictions de résistance du 3D-DXA corrélaient avec le QCT (r2 = 0.88), mais n'étaient pas statistiquement meilleures que lorsqu'elles étaient prédites uniquement par la DMOs du col fémoral à partir de l'image DXA (r2 = 0.87) [37]. Une étude de 3D-Shaper Medical montre une corrélation similaire (r2=0.86) mais une comparaison avec la DMOs a été exclue [44]. Dans une étude différente sur une population japonaise, les mesures de 3D-Shaper n'étaient pas statistiquement meilleures pour prédire la fracture de la hanche que la DMOs totale de la hanche [45].
D'autres articles ont été publiés sur une méthode similaire consistant à recaler un modèle statistique 3D sur une image DXA 2D et à prédire la résistance fémorale [46, 47], une étude montrant une amélioration par rapport à la DMOs dans la prédiction du risque de fracture [48]. Cette méthode peut offrir certains avantages par rapport au 3D-DXA, tels que l'utilisation d'un modèle pelvien supplémentaire pour aider à récupérer la forme complète du fémur proximal. Bien qu'elle reste soumise à bon nombre des mêmes limitations méthodologiques.
Si le 3D-DXA ne parvient pas à surpasser la DMOs seule, il ne peut certainement pas surpasser une combinaison de DMOs et de paramètres HSA, qui sont directement mesurés à partir des images DXA. Cela met en évidence les limitations fondamentales du 3D-DXA et remet en question sa justification pour une utilisation dans des contextes cliniques ou de recherche. Néanmoins, 3D-Shaper Medical propose désormais une analyse par éléments finis basée sur le 3D-DXA en tant que service.
Méthodes de validation
Malgré les limitations inhérentes au 3D-DXA, de nombreuses publications rapportent des résultats positifs sur sa précision. Cette divergence peut être attribuée à l'utilisation de méthodes de validation inappropriées [21, 22] qui ont tendance à masquer les véritables limitations du logiciel. Dans les sections suivantes, je discuterai des problèmes liés à ces validations et de la manière dont elles créent une perception de la fiabilité et de l'utilité clinique du 3D-DXA.Mauvaises métriques d'évaluation de la performance
3D-Shaper Medical a comparé le maillage de surface généré par 3D-DXA à partir d'une image DXA avec le maillage de surface généré manuellement à partir du scan QCT des mêmes sujets, résultant en une distance moyenne point-à-surface de 0,93 mm [2]. Ils ont également comparé les paramètres corticaux, trouvant une erreur absolue moyenne de 0,33 mm pour l'épaisseur corticale et de 72 mg/cm³ pour la densité corticale. Cependant, il n'y a pas de cadre de référence pour déterminer si ces erreurs rapportées sont acceptables, ce qui signifie que ces métriques ne valident pas nécessairement l'efficacité du logiciel.Une autre façon dont le 3D-DXA a été évalué a été l'utilisation de corrélations. Des coefficients de corrélation de 0,86, 0,93, 0,95 et 0,91 ont été rapportés pour la DMOv trabéculaire, corticale et intégrale, et l'épaisseur corticale respectivement. Cependant, ces fortes corrélations sont principalement dues au fait que tous les paramètres corticaux dans les modèles 3D-DXA et les scans QCT sont fortement corrélés avec la densité globale. Les patients ayant une DMOs supérieure à la moyenne dans leurs scans DXA présenteront, en moyenne, également une DMOv trabéculaire, corticale et intégrale accrue, ainsi qu'un cortex plus épais. Ces résultats de corrélation ne fournissent pas de preuve concluante de la précision du logiciel pour générer des reconstructions spécifiques au patient et, en fait, peuvent créer une impression trompeuse de sa performance.
Les corrélations sont également utilisées pour évaluer les études basées sur la population utilisant le 3D-DXA. Des effets similaires peuvent être observés lorsque les analyses 3D-DXA montrent des corrélations significatives entre ses paramètres et les facteurs testés ou à travers différentes populations. C'est encore une fois parce que ces paramètres sont intrinsèquement corrélés avec la DMO globale et reflètent donc directement les changements ou les différences de DMOs. Les résultats peuvent sembler sensés et peuvent refléter étroitement les véritables changements. Par exemple, l'exercice augmente à la fois la densité globale et le contenu minéral osseux cortical [49], conduisant à des résultats apparemment sensés d'une analyse 3D-DXA lorsque la DMOs augmente en raison de l'exercice. Cependant, ceux-ci ne reflètent pas les paramètres corticaux réels eux-mêmes, mais simplement les changements ou différences sous-jacents de la DMOs. Par conséquent, ces études peuvent créer une fausse impression de l'efficacité du 3D-DXA, donnant un faux sentiment de sa capacité à mesurer les paramètres corticaux avec précision.
Une évaluation plus appropriée impliquerait de comparer les paramètres corticaux à un modèle de base simple, tel qu'un estimateur aveugle. Ici, un estimateur aveugle fait référence à une méthode d'estimation simple et naïve qui ne tient pas compte de la variabilité individuelle et applique plutôt une valeur moyenne de l'ensemble de la population à tous les sujets. Par exemple, un estimateur aveugle pour l'épaisseur corticale utiliserait la carte d'épaisseur corticale moyenne d'un groupe d'individus et l'appliquerait uniformément à chaque cas, quelles que soient leurs caractéristiques spécifiques. Cette approche sert de référence, ou de norme minimale, par rapport à laquelle des méthodes plus avancées devraient être évaluées. Toute méthode sophistiquée devrait, à tout le moins, surpasser cette estimation de base. À ma connaissance, une telle évaluation n'a pas encore été publiée.
La plupart des publications sur le logiciel 3D-DXA ne présentent que des reconstructions réussies, ce qui peut créer un faux sentiment de confiance dans la fiabilité du logiciel. Pour évaluer quantitativement la fiabilité du 3D-DXA, une évaluation du taux d'échec peut être effectuée. Dans une étude précédente [51], bien que cela ne soit pas explicitement indiqué, seuls 80 des 173 sujets ont été retenus après avoir exclu les reconstructions identifiées comme inexactes par comparaison des projections du modèle avec les images DXA, ce qui donne un taux d'échec supérieur à 50 %. Pour permettre une telle évaluation, 3D-Shaper devrait fournir un affichage côte à côte de la projection du modèle et de l'image DXA. Une évaluation plus robuste comparerait cependant les rendus et les vues en coupe transversale des volumes résultants avec les scans QCT de vérité terrain et évaluerait le taux d'échec dans une évaluation indépendante.
Dans certains cas, le simple fait d'observer des changements ou des différences significatifs est présenté comme une preuve que le 3D-DXA fonctionne, tout en ne tenant pas compte du fait que les effets réels soient corrects ou non. En réponse à ma lettre à l'éditeur, des différences significatives entre les groupes de traitement ont été présentées comme une preuve de l'efficacité du 3D-DXA. Cependant, dans cette évaluation, les auteurs fournissent 2 résultats différents pour les changements de DMO corticale après un traitement au TPTD, l'un montrant une augmentation significative [52] et l'autre une diminution non significative [15]. Aucun de ces résultats ne reflète le changement réel auquel on s'attendrait dans un traitement au TPTD, comme je l'explique dans la section « Résultats trompeurs dans les études d'efficacité des médicaments ».
Absence de correction pour comparaisons multiples
La préoccupation dans cette section n'est pas principalement liée au logiciel 3D-DXA lui-même, mais plutôt au service fourni par 3D-Shaper Medical et aux publications ultérieures. Le problème critique réside dans l'absence de corrections pour comparaisons multiples lors du rapport des changements ou des différences dans les paramètres 3D-DXA, en particulier dans les cartes de paramètres corticaux.L'application de corrections pour comparaisons multiples est cruciale lors de l'analyse de données avec plusieurs mesures distinctes. Pour 3D-Shaper, le logiciel génère 71 paramètres osseux, chacun représentant un test statistique distinct. Sans ajustement pour ces comparaisons multiples, comme avec une correction de Bonferroni, la probabilité d'obtenir des résultats significatifs par hasard augmente, conduisant à de fausses conclusions. Malgré cela, les études utilisant 3D-Shaper rapportent souvent des changements ou des différences significatifs sans appliquer aucune forme de correction pour comparaisons multiples [10, 24, 27, 28], créant un sentiment de confiance injustifié dans les résultats. Cela peut être trompeur lorsque certains paramètres sont mesurés mais non rapportés, une forme de biais de p-hacking [53], où les résultats significatifs sont mis en évidence tout en ignorant le risque accru de faux positifs dû au grand nombre de tests effectués.
Un problème similaire se produit lorsque les études utilisant 3D-Shaper présentent des cartes codées par couleur montrant des changements ou des différences dans les paramètres corticaux sur la surface osseuse ou des valeurs de DMO dans le volume. Dans ces cas, chaque sommet ou voxel représente un test statistique individuel, la signification étant souvent déterminée par un simple test t à chaque point [9, 10, 11, 12, 13, 28, 52, 54, 55]. Cette approche met en évidence des régions apparemment significatives dans les cartes codées par couleur, créant l'illusion de changements ou de différences localisés là où il n'y en a pas. Lors de la présentation de changements ou de différences dans le volume par des vues en coupe transversale codées par couleur, la signification statistique au niveau du voxel n'est généralement pas fournie du tout [9, 11, 30, 52, 54, 55, 56]. De la même manière, cela suggère des changements réels alors qu'en fait, ils peuvent simplement être le résultat d'une variation aléatoire. Par conséquent, ces cartes codées par couleur peuvent donner une impression trop optimiste de l'impact des traitements ou des interventions, suggérant faussement une efficacité là où il n'y en a peut-être pas.
Le problème des faux positifs dus à des corrections inadéquates pour comparaisons multiples a été un défi persistant dans le domaine de la neuro-imagerie [57]. Pour y remédier, la communauté de la neuro-imagerie a développé des solutions qui peuvent également être appliquées aux études examinant les changements de l'os cortical sur la surface osseuse et les changements de densité dans les voxels des scans QCT. Poole et al. [58] décrivent comment SurfStat (http://math.mccgill.ca/keith/surfstat/) peut être utilisé pour tester si les différences dans les paramètres corticaux à chaque point de la surface osseuse étaient statistiquement significatives, avec la théorie des champs aléatoires appliquée pour la correction des comparaisons multiples. Des paquets similaires existent pour l'analyse basée sur les voxels, tels que la bibliothèque Statistical Parametric Mapping (https://www.fil.ion.ucl.ac.uk/spm/) et la bibliothèque logicielle FMRIB (https://fsl.fmrib.ox.ac.uk). L'utilisation de ces outils améliorerait la rigueur statistique des études utilisant le 3D-DXA, bien que les changements ou différences observés refléteraient toujours principalement la corrélation de tous les paramètres avec la DMOs.
Implications
L'utilisation de 3D-DXA a des implications considérables tant dans la recherche que dans la pratique clinique. Les sections suivantes approfondiront ces défis.Résultats trompeurs dans les études d'efficacité des médicaments
Dans la plupart des études, les résultats de 3D-DXA s'alignent sur ce qui est attendu dans le cortex, car les paramètres corticaux chez les individus sains sont généralement corrélés avec la DMOs. Cela conduit souvent à des résultats apparemment sensés. Cependant, cette approche devient défectueuse lorsque les changements ne suivent pas les modèles conventionnels. La méthode est particulièrement problématique dans les essais de médicaments où le remodelage osseux normal est altéré, et où les augmentations ou diminutions proportionnelles habituelles de tous les paramètres peuvent ne pas se produire.Un exemple illustratif est une étude sur le tériparatide, où le 3D-DXA a indiqué une augmentation de tous les paramètres corticaux, y compris une augmentation significative de la DMOv corticale par rapport au placebo [52]. En revanche, en utilisant une technique de mesure corticale équivalente appliquée au QCT, il a été démontré que la DMO corticale diminuait de manière significative après le même traitement de 18 mois au tériparatide, ce qui a été observé de manière cohérente dans les données de trois essais cliniques différents [41]. Cette diminution est attribuée à un taux accru de remodelage, ce qui entraîne une plus grande porosité corticale, comme observé également par micro-CT [59].
Dans une étude antérieure, 3D-Shaper Medical a rapporté une diminution de la DMO corticale en réponse au tériparatide [15]. Bien que cela ait été noté par les auteurs comme une diminution, le changement n'était pas statistiquement significatif. Une étude indépendante plus récente n'a également trouvé aucun changement significatif de la DMO corticale en réponse au traitement au tériparatide en utilisant une analyse 3D-DXA [60]. Il est possible qu'il y ait une certaine influence du cortex de la diaphyse, qui est partiellement visible dans l'image DXA. En raison de la nature du 3D-DXA, une diminution de la DMOs dans cette région aurait pu être projetée sur l'ensemble du modèle fémoral, y compris les zones où aucun cortex n'est visible, puisque les paramètres du modèle influencent globalement la distribution de densité. Cependant, cela n'a pas conduit à la diminution significative correcte de la DMO corticale observée dans les études QCT.
L'étude qui a rapporté une augmentation de tous les paramètres corticaux avec le tériparatide (TPTD) a également évalué l'abaloparatide en parallèle, montrant une augmentation encore plus importante de tous les paramètres pour ce dernier [52]. Des études de suivi utilisant l'analyse 3D-DXA ont également rapporté des augmentations significatives de la DMO corticale après un traitement à l'abaloparatide [55, 56]. Étant donné que l'abaloparatide partage un mécanisme d'action similaire avec le TPTD, augmentant le taux de remodelage osseux, on s'attendrait raisonnablement à ce qu'il conduise également à une diminution de la DMO corticale. En fait, une étude utilisant le QCT a observé une diminution de la DMO corticale après une période similaire de traitement à l'abaloparatide chez 35 patients [61], bien que la réduction n'ait pas été statistiquement significative. Cela suggère que les études 3D-DXA ont non seulement produit des changements inexacts, mais ont probablement aussi abouti à une évaluation trop favorable des effets de l'abaloparatide.
Une étude de Lewiecki et al. [54] illustre davantage les limitations du 3D-DXA dans la mesure de changements corticaux discordants. Leur analyse 3D-DXA a rapporté des augmentations de tous les paramètres corticaux en réponse au romosozumab. En revanche, une analyse QCT précédente n'a trouvé aucune augmentation de la DMO corticale après le même traitement [62]. Les auteurs ont noté : « Il n'est pas clair pourquoi les données obtenues par QCT et 3D-SHAPER basé sur DXA pour le traitement au romosozumab sur la DMOv intégrale et trabéculaire de la hanche étaient similaires entre les études mais différaient pour la DMOv corticale. » Étant donné que la lettre à l'éditeur de Bone vue par certains des mêmes auteurs avait déjà expliqué et prédit cette divergence [7], il semble qu'il persiste un malentendu concernant les capacités et les limitations du 3D-DXA. En conséquence, ce malentendu a probablement conduit à nouveau à une évaluation trop optimiste de l'efficacité du médicament.
Ces études diffusent davantage de résultats potentiellement incorrects en présentant des cartes en couleur des changements osseux corticaux et trabéculaires. Le 3D-DXA ne peut pas mesurer de changements localisés ou focaux, en partie parce que chaque paramètre du modèle affecte la distribution de densité globalement, et aussi parce que ces changements ne sont pas visibles sur une image DXA. L'absence d'application de corrections pour comparaisons multiples dans ces études mine encore davantage les résultats, car les régions apparemment significatives dans les cartes sont, en fait, beaucoup moins significatives, conduisant à une évaluation trop optimiste de divers médicaments.
Prise en charge des patients
Alors que le logiciel 3D-Shaper peut produire 71 mesures, la version approuvée cliniquement ne produit que la DMOv trabéculaire globale et la DMOs corticale ainsi qu'un T-score et un Z-score associés. Il n'est pas clair de quelle population les T-score et Z-score sont dérivés, bien que dans un webinaire de 3D-Shaper Medical, des données de référence caucasiennes soient notées [63]. Des courbes de référence ont déjà été produites pour une population espagnole [64] et argentine [65], qui sont toutes deux reproduites dans la Figure 6. Ces courbes semblent cependant distinctes les unes des autres et des figures produites par le logiciel 3D-Shaper. 3D-Shaper Medical, DMS Imaging et leurs distributeurs ne divulguent pas cette population, ni comment ces données ont été dérivées. Cependant, il est confirmé par Toyo Medic Co., Ltd. (Tokyo, Japon), le distributeur de 3D-Shaper au Japon, que le logiciel 3D-Shaper approuvé pour le marché japonais n'utilise pas de données de référence d'une population japonaise. Considérant la grande différence des paramètres corticaux et trabéculaires entre les populations caucasiennes et asiatiques [68], l'application de ces T-scores et Z-scores au Japon ne semble pas prudente sans validation supplémentaire. Leur validité devrait également être confirmée pour chaque population dans laquelle ils sont appliqués.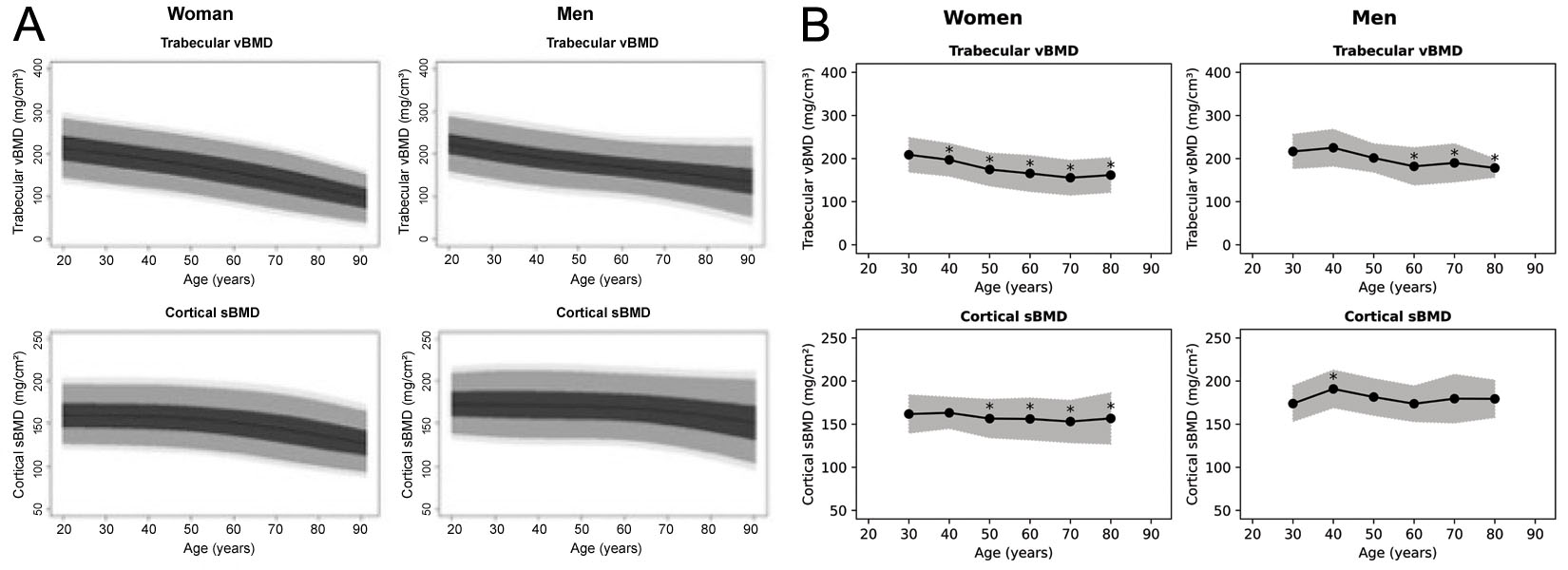
Dans un webinaire [66], 3D-Shaper Medical a suggéré une utilisation clinique potentielle où 3D-Shaper a abouti à une faible DMOs corticale et une très faible DMOv trabéculaire. Puisque le tériparatide, selon le tableau, améliore l'os trabéculaire plus que l'os cortical, le tériparatide a été déclaré comme étant le meilleur traitement. Cependant, sur la base de ce tableau, un clinicien choisirait naturellement le Denosumab ou l'Abaloparatide plutôt que le tériparatide s'il négligeait la DMOs vertébrale.
Le 3D-DXA ne sera probablement utilisé qu'en complément des évaluations régulières du T-score et du Z-score DXA. Ainsi, le danger de manquer un individu à haut risque sera minime. Cependant, en raison de l'erreur associée au 3D-DXA, la DMOs corticale et la DMOv trabéculaire seront toujours légèrement supérieures ou inférieures. Chez les patients à la limite du traitement, cela peut inciter le clinicien à administrer des médicaments anti-ostéoporose là où cela ne serait pas indiqué par la DMOs seule.
Une étude sur le score de l'os trabéculaire (TBS) montre que cette évaluation supplémentaire influence significativement les décisions de traitement dans l'ostéoporose secondaire [67]. Dans cette étude, 21 à 25,5 % des patients avec des mesures de DMO sans particularité avaient une mauvaise qualité osseuse indiquée par le TBS, ce qui a changé la décision de traitement. Un effet similaire pourrait se produire avec le 3D-DXA, conduisant potentiellement à des conséquences involontaires, telles qu'une prescription excessive. Si le tableau était utilisé, cela pourrait également inciter le clinicien à choisir un médicament plutôt qu'un autre.
Il est également déclaré par 3D-Shaper Medical que les patients peuvent être surveillés pour déterminer si le traitement sélectionné a bien l'effet attendu sur le cortex et le compartiment trabéculaire. Cependant, étant donné que les erreurs de 3D-DXA sont supérieures aux changements attendus, et que la répétabilité est faible [36], il ne peut être établi si les changements observés lors d'une évaluation de suivi 3D-DXA sont dus à des effets réels ou simplement à l'erreur inhérente au 3D-DXA. Si un clinicien fait confiance à ces résultats, il peut être amené à changer inutilement le traitement.
(A)
| 2D DXA (Hanche totale) DMOs | 3D-DXA (3D-Shaper) DMOv Trabéculaire | 3D-DXA (3D-Shaper) DMOs Corticale | |
|---|---|---|---|
| Alendronate | + | + | + |
| Denosumab | ++ | ++ | ++ |
| Zoledronic acid | + | + | ++ |
| Teriparatide [15, 52, 55*, 56] | + | ++ | = |
| Abaloparatide | ++ | ++ | ++ |
| Romosozumab | +++ | +++ | +++ |
(B)
| DMOs | DMOv | DMOs | |
|---|---|---|---|
| Teriparatide [52, 56] (18 mois) | ++ (3.3%) | ++/+++ (9%) | + (1.8%) |
| Teriparatide [15] (24 mois) | = (p > 0.05) | ++/+++ (5.9%) | = (p > 0.05) |
| Teriparatide [60] (24 mois) | = (p > 0.05) | ++/+++ (>14%) | = (p > 0.05) |
(C)
| Symbole | (Hanche totale) DMOs | DMOv Trabéculaire | DMOs Corticale |
|---|---|---|---|
| +++ | Δ > n/a % | Δ > n/a % | Δ > n/a % |
| ++ | 2 < Δ ≤ n/a % | 4 < Δ ≤ n/a % | 2 < Δ ≤ n/a % |
| + | 0.5 < Δ ≤ 2 % | 0.5 < Δ ≤ 4 % | 0.5 < Δ ≤ 2 % |
| = | -0.5 ≤ Δ ≤ 0.5 % | -0.5 ≤ Δ ≤ 0.5 % | -0.5 ≤ Δ ≤ 0.5 % |
| - | -2 ≤ Δ < -0.5 % | -4 ≤ Δ < -0.5 % | -2 ≤ Δ < -0.5 % |
| -- | Δ < -2 % | Δ < -4 % | Δ < -2 % |
Bien que la version clinique du 3D-DXA ne fournisse pas d'informations sur la DMOs corticale dans les différentes régions anatomiques, elle affiche un modèle 3D codé par couleur de la DMOs sur la surface osseuse. 3D-Shaper Medical suggère par la suite que cela peut être utilisé pour détecter une fragilité locale [66]. Malheureusement, le 3D-DXA ne peut pas reconstruire la carte corticale spécifique au patient. Je renvoie à nouveau à la Figure 2 pour une explication intuitive de cela. Ainsi, si une carte corticale 3D-DXA suggère des déficiences locales, celles-ci peuvent être des sorties statistiquement plausibles du modèle, mais ne correspondent pas à l'anatomie réelle du patient. Cela peut à nouveau conduire à une décision de traitement inutile ou inappropriée.
Le logiciel 3D-Shaper a maintenant également reçu l'approbation de la FDA via le processus de notification pré-commercialisation 510(k) [68]. 3D-Shaper Medical a obtenu cela en utilisant une étude de corrélation comparant l'aire de la section transversale (CSA), le moment d'inertie de la section transversale (CSMI), le module de section (Z), le rapport de flambement (BR), la densité minérale osseuse surfacique corticale (sBMD), la densité minérale osseuse volumétrique trabéculaire (vBMD) et la vBMD intégrale à des mesures similaires du logiciel Hip Structural Analysis (HSA) de Hologic Inc., qui avait précédemment reçu l'approbation de la FDA.
Notamment, la longueur de l'axe du col et l'angle cervico-diaphysaire sont restés absents de cette évaluation, et donc l'utilisation de ces paramètres n'est pas approuvée par la FDA. Il convient de noter que les directives de la Société Internationale de Densitométrie Clinique (ISCD) recommandent de ne pas utiliser les paramètres HSA pour évaluer le risque de fracture de la hanche, à l'exception de la longueur de l'axe de la hanche [69]. De plus, cette approbation réglementaire n'inclut pas de T-score ou de Z-score pour comparer les mesures avec des données de référence. Cela soulève des inquiétudes quant à l'applicabilité clinique de 3D-Shaper aux États-Unis.
Enfin, les paramètres de 3D-Shaper ont été considérés comme substantiellement équivalents à l'option HSA pour les densitomètres osseux à rayons X Hologic QDR. La FDA n'est pas en mesure de confirmer si 3D-Shaper peut être utilisé avec d'autres scanners DXA, laissant la question de la compatibilité avec d'autres appareils aux États-Unis non résolue.
Discussion
En résumé, le 3D-DXA produit une variété de paramètres osseux qui semblent très détaillés, mais reflètent principalement la DMO surfacique globale plutôt que de mesurer des propriétés corticales ou trabéculaires distinctes. Bien que le logiciel puisse donner des résultats corrélés aux valeurs réelles dans les populations où les changements corticaux et trabéculaires sont proportionnels à la DMOs, il ne parvient pas à capturer des mesures spécifiques au patient ou des changements localisés. Cette limitation est particulièrement prononcée dans des scénarios tels que la thérapie anabolique, où les paramètres osseux corticaux et trabéculaires peuvent changer de manière inverse et où le 3D-DXA ne parvient pas à refléter ces véritables changements observés par QCT. Cela soulève des inquiétudes importantes quant à son utilisation dans les soins cliniques de routine ou en tant qu'outil de recherche fiable.Le 3D-DXA a été initialement développé pour mieux diagnostiquer l'ostéoporose en fournissant une estimation de la DMOv intégrale [70, 71]. En ne tentant pas d'évaluer séparément les compartiments corticaux et trabéculaires, la DMOv intégrale produite par le 3D-DXA peut toujours représenter une estimation valable. La méthodologie a ensuite été étendue pour tenter d'améliorer les estimations du risque de fracture en analysant directement les paramètres du modèle, puisque ces paramètres décrivent entièrement la morphologie du modèle statistique [51, 72, 73, 74]. Cependant, les limitations clés du 3D-DXA, telles que détaillées dans cette revue, demeurent et compromettent sa précision et sa fiabilité.
Cette étude a été limitée par le manque de transparence des sociétés commercialisant le 3D-DXA, notamment 3D-Shaper Medical, DMS Imaging et Fujifilm. Par conséquent, elle repose sur des informations accessibles au public et sur ma propre expérience dans le développement de cette méthodologie. J'encourage les lecteurs à demander des éclaircissements à ces sociétés ou à leurs représentants concernant les aspects de 3D-DXA et de 3D-Shaper qui n'ont pas été divulgués.
Les évaluations des sociétés professionnelles pourraient fournir des conseils précieux en fournissant des évaluations indépendantes de la validité du 3D-DXA et en établissant des recommandations officielles concernant son utilisation. Bien qu'une mise à jour de la directive de pratique pour l'absorptiométrie à rayons X à double énergie par le Groupe de travail international sur les meilleures pratiques DXA indique concernant le 3D-DXA que « plus de preuves sont nécessaires pour faire des recommandations pour l'application de ces nouvelles techniques d'imagerie dans la pratique clinique » [75], je crois qu'il existe maintenant suffisamment de preuves sur lesquelles fonder une recommandation, et j'espère que cette revue sera utile à cet égard.
En conclusion, compte tenu des limitations fondamentales du 3D-DXA, mon évaluation professionnelle est que les paramètres corticaux et trabéculaires fournis par le 3D-DXA ne devraient pas être utilisés à des fins de recherche, et ne conviennent pas non plus aux applications cliniques telles que le diagnostic, la surveillance ou l'aide à la décision thérapeutique.
Contributions des auteurs
TW a contribué à la conceptualisation, à la conservation des données, à l'analyse formelle, à l'investigation, à la méthodologie, aux ressources, à la visualisation et à la rédaction du manuscrit.Financement
Aucun financement n'a été reçu pour cette étude.Disponibilité des données
Toutes les données présentées dans cet article sont disponibles auprès de l'auteur sur demande.Conflits d'intérêts
L'auteur est co-inventeur d'un brevet lié à la méthodologie sous-jacente au logiciel 3D-DXA. L'auteur a participé à des discussions concernant la propriété intellectuelle et les origines du code logiciel commercial 3D-DXA, des modèles statistiques et du matériel promotionnel. L'auteur n'est pas affilié à 3D-Shaper Medical ou à d'autres sociétés impliquées dans l'exploitation commerciale du 3D-DXA et n'a reçu ni capitaux propres, ni redevances, ni autre compensation financière. L'auteur a donné des conférences pour UCB dans des forums éducatifs et a reçu des subventions de recherche d'Amgen Inc. et de Lilly. Les opinions exprimées dans cet article sont uniquement celles de l'auteur et sont basées sur une évaluation critique de la méthodologie et des preuves scientifiques disponibles.Références
- Whitmarsh T (2012). 3D Reconstruction of the Proximal Femur and Lumbar Vertebrae from Dual-Energy X-Ray Absorptiometry for Osteoporotic Risk Assessment
- Humbert L, Martelli Y, Fonolla R, et al. (2017). 3D-DXA: Assessing the Femoral Shape, the Trabecular Macrostructure and the Cortex in 3D from DXA images. IEEE Transactions on Medical Imaging, 36(1), 27–39.
- Whitmarsh T, Humbert L, De Craene M, et al. (2011). Reconstructing the 3D Shape and Bone Mineral Density Distribution of the Proximal Femur From Dual-Energy X-Ray Absorptiometry. IEEE Transactions on Medical Imaging, 30(12), 2101–2114.
- Ahmad O, Ramamurthi K, Wilson KE, et al. (2010). Volumetric DXA (VXA): A new method to extract 3D information from multiple in vivo DXA images. Journal of Bone and Mineral Research, 25(12), 2744–2751.
- Väänänen SP, Grassi L, Flivik G, et al. (). Generation of 3D shape, density, cortical thickness and finite element mesh of proximal femur from a DXA image. Medical Image Analysis, 24(1).
- Whitmarsh T, Humbert L, De Craene M, et al. 3D bone mineral density distribution and shape reconstruction of the proximal femur from a single simulated DXA image: an in vitro study. In: Dawant BM, Haynor DR, eds. Medical Imaging 2010: Image Processing. Vol. 7623. SPIE; 2010:76234U.
- Whitmarsh T. Concerns regarding the use of 3D-DXA. Bone. 2021;149:115939.
- Treece G, Gee A (2015). Independent measurement of femoral cortical thickness and cortical bone density using clinical CT. Medical Image Analysis, 20(1), 249–264.
- Freitas L, Amorim T, Humbert L, et al. (2018). Cortical and trabecular bone analysis of professional dancers using 3D-DXA: a case–control study. Journal of Sports Sciences, 37(1), 82–89.
- Gracia-Marco L, García-Fontana B, Ubago-Guisado E, et al. (2019). Analysis of Bone Impairment by 3D DXA Hip Measures in Patients With Primary Hyperparathyroidism: A Pilot Study. The Journal of Clinical Endocrinology \& Metabolism, 105(1), 175–184.
- Orduna G, Humbert L, Fonolla R, et al. (2018). Cortical and Trabecular Bone Analysis of Patients With High Bone Mass From the Barcelona Osteoporosis Cohort Using 3-Dimensional Dual-Energy X-ray Absorptiometry: A Case-Control Study. Journal of Clinical Densitometry, 21(4), 480–484.
- Gifre L, Humbert L, Muxi A, et al. (2017). Analysis of the evolution of cortical and trabecular bone compartments in the proximal femur after spinal cord injury by 3D-DXA. Osteoporosis International, 29(1), 201–209.
- García Hoyos M, Humbert L, Salmón Z, et al. (2019). Analysis of volumetric BMD in people with Down syndrome using DXA-based 3D modeling. Archives of Osteoporosis, 14(1).
- Beck B, Harding A, Weeks B, et al. (2021). Response to “Concerns regarding the use of 3D-DXA”. Bone, 149, 115936.
- Winzenrieth R, Humbert L, Di Gregorio S, Bonel E, García M, Del Rio L. Effects of osteoporosis drug treatments on cortical and trabecular bone in the femur using DXA-based 3D modeling. Osteoporos Int.2018;29(10):2323–2333.
- Cummings SR, Cauley JA, Palermo L, et al. Racial differences in hip axis lengths might explain racial differences in rates of hip fracture. Osteoporos Int.1994;4(4):226–229.
- Kim KM, Brown JK, Kim KJ, et al. Differences in femoral neck geometry associated with age and ethnicity. Osteoporos Int. 2010;22(7):2165–2174.
- Sone T, Humbert L, Lopez M, et al. (2022). Assessment of femoral shape, trabecular and cortical bone in Japanese subjects using DXA-based 3D modelling. JOURNAL OF BONE AND MINERAL RESEARCH, 37, 214--214.
- Varoquaux G, Cheplygina V (2022). Machine learning for medical imaging: methodological failures and recommendations for the future. npj Digital Medicine, 5(1).
- Hadjiiski L, Cha K, Chan H, et al. (). AAPM task group report 273: Recommendations on best practices for AI and machine learning for computer‐aided diagnosis in medical imaging. Medical Physics, 50(2).
- Huisman M (2024). When AUC-ROC and accuracy are not accurate: what everyone needs to know about evaluating artificial intelligence in radiology. European Radiology, 34(12), 7892–7894.
- Gallifant J, Bitterman DS, Celi LA, et al. (2024). Ethical debates amidst flawed healthcare artificial intelligence metrics. npj Digital Medicine, 7(1).
- Amani A, Bellver M, del Rio L, et al. (2022). Femur 3D-DXA Assessment in Female Football Players, Swimmers, and Sedentary Controls. International Journal of Sports Medicine, 44(06), 420–426.
- Maïmoun L, Renard E, Humbert L, et al. (2021). Modification of bone mineral density, bone geometry and volumetric BMD in young women with obesity. Bone, 150, 116005.
- Jain RK, López Picazo M, Humbert L, et al. (2025). Bone Structural Parameters as Measured by 3-Dimensional Dual-Energy X-Ray Absorptiometry Are Superior in Black Women and Demonstrate Unique Associations With Prior Fracture Versus White Women. Endocrine Practice, 31(2), 152–158.
- Gracia-Marco L, Gonzalez-Salvatierra S, Garcia-Martin A, et al. (2021). 3D DXA Hip Differences in Patients with Acromegaly or Adult Growth Hormone Deficiency. Journal of Clinical Medicine, 10(4), 657.
- Toussirot E, Winzenrieth R, Aubin F, et al. (2024). Areal bone mineral density, trabecular bone score and 3D-DXA analysis of proximal femur in psoriatic disease. Frontiers in Medicine, 11.
- Ubago-Guisado E, Moratalla-Aranda E, González-Salvatierra S, et al. (2023). Do patients with type 2 diabetes have impaired hip bone microstructure? A study using 3D modeling of hip dual-energy X-ray absorptiometry. Frontiers in Endocrinology, 13.
- Guerra FS, Palladino N, Winzenrieth R, et al. (2024). Advanced 3D-DXA insights into bone density changes in hyperparathyroidism. Journal of Diabetes \& Metabolic Disorders, 23(2), 2191–2199.
- Kužma M, Vaňuga P, Ságová I, et al. Non-invasive DXA derived bone structure assessment of acromegaly patients: a cross sectional study. Eur J Endocrinol. 2019;180(3):201–211.
- Maïmoun L, Aouinti S, Puech M, et al. Modification of bone architecture following sleeve gastrectomy: a five-year follow-up. J Bone Miner Res. 2024;40(2):251–261.
- Maïmoun L, Gelis A, Serrand C, et al. (2023). Alteration of Volumetric Bone Mineral Density Parameters in Men with Spinal Cord Injury. Calcified Tissue International, 113(3), 304–316.
- Harding AT, Weeks BK, Lambert C, et al. (2020). Effects of supervised high-intensity resistance and impact training or machine-based isometric training on regional bone geometry and strength in middle-aged and older men with low bone mass: The LIFTMOR-M semi-randomised controlled trial. Bone, 136, 115362.
- Gil-Cosano JJ, Ubago-Guisado E, Sánchez MJ, et al. (2020). The effect of an online exercise programme on bone health in paediatric cancer survivors (iBoneFIT): study protocol of a multi-centre randomized controlled trial. BMC Public Health, 20(1).
- Humbert L, Whitmarsh T, De Craene M, et al. (2010). 3D reconstruction of both shape and Bone Mineral Density distribution of the femur from DXA images. 2010 IEEE International Symposium on Biomedical Imaging: From Nano to Macro, 456–459.
- O’Rourke D, Beck BR, Harding AT, et al. (2021). Assessment of femoral neck strength and bone mineral density changes following exercise using 3D-DXA images. Journal of Biomechanics, 119, 110315.
- Dudle A, Gugler Y, Pretterklieber M, et al. (2023). 2D-3D reconstruction of the proximal femur from DXA scans: Evaluation of the 3D-Shaper software. Frontiers in Bioengineering and Biotechnology, 11.
- Clotet J, Martelli Y, Di Gregorio S, et al. (2018). Structural Parameters of the Proximal Femur by 3-Dimensional Dual-Energy X-ray Absorptiometry Software: Comparison With Quantitative Computed Tomography. Journal of Clinical Densitometry, 21(4), 550–562.
- Ramamurthi K, Ahmad O, Engelke K, et al. (2011). An in vivo comparison of hip structure analysis (HSA) with measurements obtained by QCT. Osteoporosis International, 23(2), 543–551.
- Whitmarsh T, Treece GM, Gee AH, et al. (2015). Mapping Bone Changes at the Proximal Femoral Cortex of Postmenopausal Women in Response to Alendronate and Teriparatide Alone, Combined or Sequentially. Journal of Bone and Mineral Research, 30(7), 1309–1318.
- Whitmarsh T, Treece GM, Gee AH, et al. (2016). The Effects on the Femoral Cortex of a 24 Month Treatment Compared to an 18 Month Treatment with Teriparatide: A Multi-Trial Retrospective Analysis. PLOS ONE, 11(2), e0147722.
- Huininga K, Koromani F, Zillikens M, et al. (2024). Use of 3D Shaper Analysis for the Assessment of Fracture Risk in a Population-Based Setting. JBMR Plus, 8(Supplement\_1), i1--i340.
- Huininga K, Koromani F, Zillikens MC, et al. (2024). Use of 3D Shaper Analysis for the Assessment of Fracture Risk in a Population-based Setting. ASBMR 2024 Annual Meeting Abstracts and Abstract Book.
- Qasim M, López Picazo M, Ruiz Wills C, et al. (2024). 3D-DXA Based Finite Element Modelling for Femur Strength Prediction: Evaluation Against QCT. Journal of Clinical Densitometry, 27(2), 101471.
- Iki M, Winzenrieth R, Tamaki J, et al. (2021). Predictive ability of novel volumetric and geometric indices derived from dual-energy X-ray absorptiometric images of the proximal femur for hip fracture compared with conventional areal bone mineral density: the Japanese Population-based Osteoporosis (JPOS) Cohort Study. Osteoporosis International, 32(11), 2289–2299.
- Grassi L, Väänänen SP, Ristinmaa M, et al. Prediction of femoral strength using 3D finite element models reconstructed from DXA images: validation against experiments. Biomechanics and Modeling in Mechanobiology, 16(3).
- Grassi L, Fleps I, Sahlstedt H, et al. (). Validation of 3D finite element models from simulated DXA images for biofidelic simulations of sideways fall impact to the hip. Bone, 142.
- Grassi L, Väänänen SP, Jehpsson L, et al. (). 3D Finite Element Models Reconstructed From 2D Dual‐Energy X‐Ray Absorptiometry (DXA) Images Improve Hip Fracture Prediction Compared to Areal BMD in Osteoporotic Fractures in Men (MrOS) Sweden Cohort. Journal of Bone and Mineral Research, 38(9).
- Grassi L, Väänänen SP, Voss A, et al. DXA-based 3D finite element models predict hip fractures better than areal BMD in elderly women. Bone. 2025;195:117457.
- Allison SJ, Poole KES, Treece GM, et al. (2015). The Influence of High-Impact Exercise on Cortical and Trabecular Bone Mineral Content and 3D Distribution Across the Proximal Femur in Older Men: A Randomized Controlled Unilateral Intervention. Journal of Bone and Mineral Research, 30(9), 1709–1716.
- Whitmarsh T, Fritscher KD, Humbert L, et al. (2011). Hip fracture discrimination using 3D reconstructions from Dual-energy X-ray Absorptiometry. 2011 IEEE International Symposium on Biomedical Imaging: From Nano to Macro, 1189–1192.
- Winzenrieth R, Ominsky M, Wang Y, et al. (2021). Differential effects of abaloparatide and teriparatide on hip cortical volumetric BMD by DXA-based 3D modeling. Osteoporosis International, 32(3), 575–583.
- England JR, Cheng PM (2019). Artificial Intelligence for Medical Image Analysis: A Guide for Authors and Reviewers. American Journal of Roentgenology, 212(3), 513–519.
- Lewiecki EM, Betah D, Humbert L, et al. (2024). 3D-modeling from hip DXA shows improved bone structure with romosozumab followed by denosumab or alendronate. Journal of Bone and Mineral Research, 39(4), 473–483.
- Winzenrieth R, Kostenuik P, Boxberger J, et al. (2022). Proximal Femur Responses to Sequential Therapy With Abaloparatide Followed by Alendronate in Postmenopausal Women With Osteoporosis by 3D Modeling of Hip Dual‐Energy X‐Ray Absorptiometry (DXA). JBMR Plus, 6(4).
- Winzenrieth R, Humbert L, Boxberger JI, et al. (2022). Abaloparatide Effects on Cortical Volumetric BMD and Estimated Strength Indices of Hip Subregions by 3D-DXA in Women With Postmenopausal Osteoporosis. Journal of Clinical Densitometry, 25(3), 392–400.
- Bennett C, Miller M, Wolford G (2009). Neural correlates of interspecies perspective taking in the post-mortem Atlantic Salmon: an argument for multiple comparisons correction. NeuroImage, 47, S125.
- Poole KE, Treece GM, Gee AH, et al. (2014). Denosumab Rapidly Increases Cortical Bone in Key Locations of the Femur: A 3D Bone Mapping Study in Women With Osteoporosis. Journal of Bone and Mineral Research, 30(1), 46–54.
- Sato M, Westmore M, Ma YL, et al. (2004). Teriparatide [PTH(1–34)] Strengthens the Proximal Femur of Ovariectomized Nonhuman Primates Despite Increasing Porosity. Journal of Bone and Mineral Research, 19(4), 623–629.
- Hadji P, Kamali L, Thomasius F, et al. (2024). Real-world efficacy of a teriparatide biosimilar (RGB-10) compared with reference teriparatide on bone mineral density, trabecular bone score, and bone parameters assessed using quantitative ultrasound, 3D-SHAPER® and high-resolution peripheral computer tomography in postmenopausal women with osteoporosis and very high fracture risk. Osteoporosis International, 35(12), 2107–2116.
- Sone T, Ohnaru K, Sugai T, et al. (2023). The effects of abaloparatide on hip geometry and biomechanical properties in Japanese osteoporotic patients assessed using DXA-based hip structural analysis: results of the Japanese phase 3 ACTIVE-J trial. Archives of Osteoporosis, 18(1).
- Genant HK, Engelke K, Bolognese MA, et al. (2016). Effects of Romosozumab Compared With Teriparatide on Bone Density and Mass at the Spine and Hip in Postmenopausal Women With Low Bone Mass. Journal of Bone and Mineral Research, 32(1), 181–187.
- MEDICAL 3S (2021). Webinar - Use of 3D-Shaper in clinical research: state of the art and potential applications
- Casado Burgos E, Di Gregorio S, González Macías J, et al. (2019). Datos de referencia de mediciones óseas en modelos 3D de fémur proximal en población española cn DXA: Proyecto SEIOMM 3D-SHAPPER. Congreso SEIOMM (24º : 2019 : Gerona).
- Brance ML, Saravi FD, Henr{\'i}quez MM, et al. (2020). Reference Values of Three-Dimensional Proximal Femur Parameters from Bone Densitometry Images in Healthy Subjects from Argentina. World Congress on Osteoporosis, Osteoarthritis and Musculoskeletal Diseases, 372--372.
- Jennings I (). 3D Shaper Technology: Revolutionizing Bone Health Analysis
- Al-Hashimi L, Klotsche J, Ohrndorf S, et al. (2023). Trabecular Bone Score Significantly Influences Treatment Decisions in Secondary Osteoporosis. Journal of Clinical Medicine, 12(12), 4147.
- Food {, Administration} D (2022). 510(k) Summary: K220822
- Broy SB, Cauley JA, Lewiecki ME, et al. (2015). Fracture Risk Prediction by Non-BMD DXA Measures: the 2015 ISCD Official Positions Part 1: Hip Geometry. Journal of Clinical Densitometry, 18(3), 287–308.
- Whitmarsh T, Humbert L, Craene MD, et al. (2009). Reconstrucción de la forma del fémur y densidad mineral ósea en 3D para el diagnóstico de osteoporosis a partir de DXA
- Whitmarsh T, Humbert L, Del Río Barquero LM, et al. (2011). Volumetric Bone Mineral Density Estimation using a 3D Reconstruction Method from Dual-energy X-ray Absorptiometry. ASBMR 2011 Annual Meeting Abstracts and Abstract Book.
- Whitmarsh T, Fritscher KD, Humbert L, et al. (2011). A Statistical Model of Shape and Bone Mineral Density Distribution of the Proximal Femur for Fracture Risk Assessment. Medical Image Computing and Computer-Assisted Intervention – MICCAI 2011, 393–400.
- Whitmarsh T, Fritscher KD, Humbert L, et al. (2012). Hip fracture discrimination from dual-energy X-ray absorptiometry by statistical model registration. Bone, 51(5), 896–901.
- Martelli Y, Whitmarsh T, Humbert L, et al. (2012). A software framework for 3D reconstruction and fracture risk assessment of the proximal femur from dual-energy x-ray absorptiometry. Proceedings of VPH 2012: Virtual Physiological Human - Integrative approaches to computational biomedicine.
- Slart RHJA, Punda M, Ali DS, et al. (2024). Updated practice guideline for dual-energy X-ray absorptiometry (DXA). European Journal of Nuclear Medicine and Molecular Imaging, 52(2), 539–563.