Zusammenfassung
3D-DXA, wie es im Software-Tool 3D-Shaper implementiert ist, ist eine Softwaremethode, die eine 3D-Rekonstruktion des proximalen Femurs aus einem einzelnen 2D-DXA-Bild durch Registrierung eines statistischen Modells generiert. Implementierungen von 3D-DXA zielen darauf ab, Schätzungen von trabekulären, kortikalen und strukturellen Parametern zu liefern, die denen aus der quantitativen Computertomographie (QCT) ähneln. Als Erfinder und Entwickler der Softwaremethoden, auf denen 3D-DXA aufbaut, habe ich deren Einführung und weitverbreitete Nutzung mit zunehmender Sorge beobachtet. Dieser Artikel bietet eine kritische Bewertung der dem 3D-DXA innewohnenden methodischen Einschränkungen und diskutiert deren Auswirkungen auf Forschung und Patientenversorgung. Das Hauptproblem besteht darin, dass die begrenzte Sichtbarkeit der Kortex in einem DXA-Bild verhindert, dass 3D-DXA kortikale Parameter genau ableiten kann. Stattdessen verlässt sich die Software auf Vorhersagen, die auf der allgemeinen BMD basieren, anstatt auf direkte kortikale Messungen. Dies kann zu Ergebnissen führen, die nicht die tatsächlichen kortikalen Messungen widerspiegeln. Weitere Bedenken umfassen die Populationsverzerrung (Population Bias), da das statistische Modell von einer spezifischen Demografie abgeleitet ist, sowie die begrenzte Rekonstruktionsgenauigkeit durch die Verwendung von Einzelansicht-DXA-Bildern. Diese Einschränkungen haben wahrscheinlich zu fehlerhaften Messungen und Forschungsergebnissen geführt, die weitgehend unerkannt geblieben sind, da ungeeignete Bewertungsmetriken verwendet wurden und Korrekturen für multiples Testen in Studien mit 3D-DXA fehlten. Trotz dieser Einschränkungen hat 3D-DXA in verschiedenen Ländern eine behördliche Zulassung erhalten, was potenziell die Genauigkeit klinischer Diagnosen und Behandlungsentscheidungen beeinträchtigt. Durch das Hervorheben dieser Probleme zielt dieser Artikel darauf ab, Kliniker, Forscher und Regulierungsbehörden über die signifikanten Einschränkungen von 3D-DXA zu informieren. Er unterstreicht die dringende Notwendigkeit einer Neubewertung seiner Verwendung in Forschung und klinischen Einstellungen, um Fehlinterpretationen von Ergebnissen zu verhindern und die Patientensicherheit zu gewährleisten.Schlüsselwörter
3D-DXA, 3D-Shaper, Quantitative Computertomographie, Knochenmineraldichte, Dual-Röntgen-Absorptiometrie, Kortikale Parameterkartierung, Hüftstrukturanalyse.Laienzusammenfassung
Diese Übersicht untersucht kritisch die 3D-DXA-Software, auch bekannt als 3D-Shaper, die darauf abzielt, trabekuläre, kortikale und strukturelle Parameter des proximalen Femurs aus einem einzelnen DXA-Bild zu schätzen. 3D-DXA hat mehrere inhärente Einschränkungen, die zu ungenauen Messungen führen können, was potenzielle Auswirkungen auf Forschungsergebnisse und Behandlungsentscheidungen für Patienten haben kann. Das Verständnis dieser Probleme ist für Forscher und Kliniker entscheidend, um Fehlinterpretationen zu vermeiden, die unser Wissen über die Knochenphysiologie, die Auswirkungen von medikamentösen Behandlungen und die Patientensicherheit beeinträchtigen könnten.Einleitung
3D-DXA ist eine Softwaremethode, die ein statistisches verformbares 3D-Modell auf ein einzelnes 2D-DXA-Bild registriert, um ein 3D-Modell des proximalen Femurs zu generieren [1]. Das Modell wird aus einem Satz von quantitativen Computertomographie (QCT)-Scans einer spanischen kaukasischen Population von 81 Frauen und 30 Männern mit einem Durchschnittsalter von 56,2 ± 12,1 Jahren (Bereich zwischen 30 und 84 Jahren) erstellt [2]. Die Parameter des statistischen Modells beschreiben anschließend die Hauptvariation in Form und Dichteverteilung dieser Population. In einem iterativen Prozess werden die Parameter des Modells sowie Position, Orientierung und Größe gesucht, in dem Versuch, dass die Projektion des Modells dem DXA-Bild ähnelt (Abbildung 1). Aus dem resultierenden 3D-Modell werden dann kortikale Parameter über die Knochenoberfläche gemessen, zusammen mit trabekulären volumetrischen BMD-Werten im Inneren. Ein mittlerer absoluter Fehler von 0,33 mm für die kortikale Dicke und 72 mg/cm³ für die kortikale Dichte wurde berichtet, als 3D-DXA mit QCT verglichen wurde, mit Korrelationskoeffizienten größer oder gleich 0,86 [2].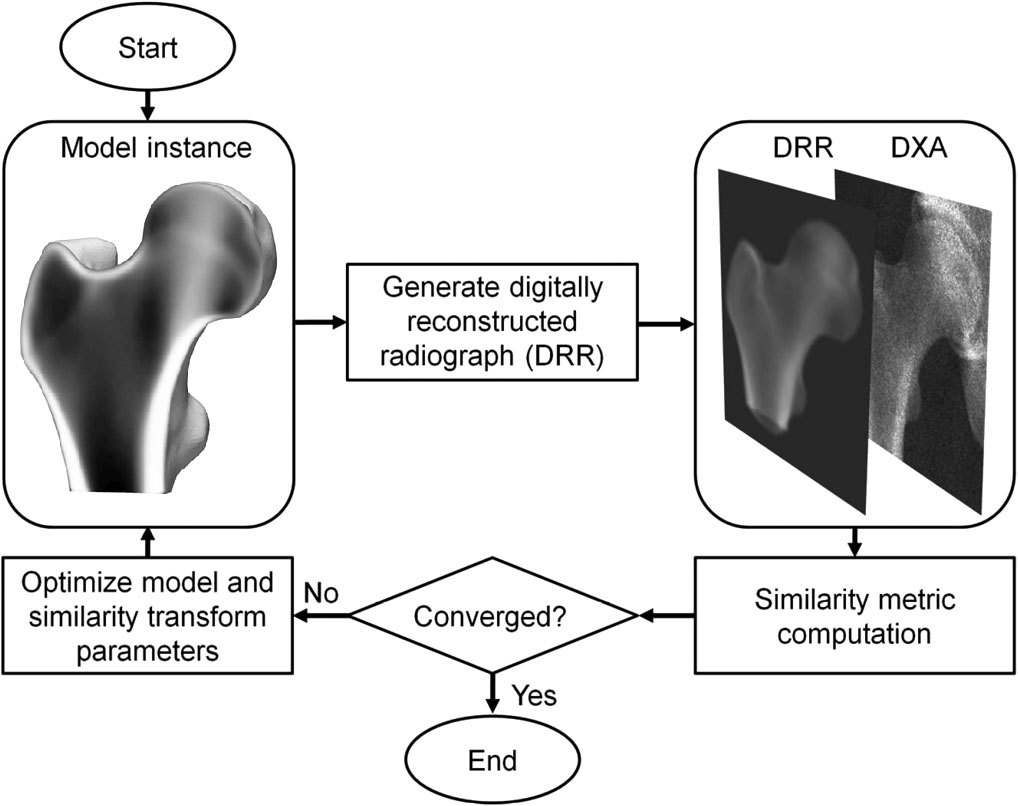
Obwohl andere Methoden für die 3D-Rekonstruktion von Knochenstrukturen aus DXA-Bildern unter Verwendung eines statistischen Modells vorgeschlagen wurden [4, 5], ist es die Softwaremethode, die zuerst im Jahr 2010 veröffentlicht wurde [6], die später als 3D-DXA von Galgo Medical SL (Barcelona, Spanien), einem Spin-off-Unternehmen der Universitat Pompeu Fabra (Barcelona, Spanien), kommerzialisiert wurde. Diese Software wurde später erweitert, um die kortikale Dicke und die kortikale Knochenmineraldichte (BMD) aus den volumetrischen Rekonstruktionen zu messen [2], was heute als 3D-Shaper von 3D-Shaper Medical SL (Barcelona, Spanien), einem weiteren Spin-off-Unternehmen von Galgo Medical SL, das sowohl einen Service als auch eine Software anbietet, kommerzialisiert wird. Die Software ist an DMS Imaging (Mauguio, Frankreich) lizenziert, um als 3D-DXA mit ihren Stratos/Medix DXA-Geräten verkauft zu werden. Fujifilm (Tokio, Japan) verkauft dieselben DXA-Geräte von DMS unter dem Markennamen Fujifilm FDX Visionary DXA. Auch Imex Medical (São José, Brasilien) verkauft diese Geräte als Elipse-Serie und Radiología SA (Madrid, Spanien) verkauft sie als Radioscore - DR. Diese alle beinhalten die Option, 3D-DXA hinzuzufügen.
Als Entwickler der ursprünglichen Softwaremethode [1] besitze ich ein tiefes Verständnis ihrer inhärenten Einschränkungen, die für andere Benutzer und Forscher möglicherweise nicht offensichtlich sind. Obwohl ich die Haupt- einschränkung dieser Software in einem Leserbrief an Bone erklärt habe [7], wird 3D-DXA weiterhin weltweit verkauft und genutzt. 3D-Shaper hat die Zulassung von Regulierungsbehörden in der EU, Japan, Thailand, Argentinien und eine 510(k)-Zulassung der FDA erhalten, die ihre Verwendung zur Diagnose und Entscheidungsfindung für Behandlungen bei Patienten autorisiert. Angesichts dieser Bestätigungen ist es kritisch und dringend, einige der Missverständnisse über diese Software anzusprechen und zu klären und damit das Verständnis ihrer Einschränkungen zu verbessern.
Methodische Einschränkungen
In diesem Abschnitt werde ich einige der Einschränkungen der Methodik erläutern, auf der 3D-DXA basiert, sowie spezifische Implementierungsdetails, die zu weiteren Ungenauigkeiten beitragen können.Kortikale Parameter werden nicht gemessen
Das Hauptproblem liegt in der fehlenden Sichtbarkeit der Kortex in DXA-Bildern, aus denen 3D-DXA seine kortikalen Parameter ableiten könnte. Um dies zu veranschaulichen, möchte ich eine Abbildung aus dem Leserbrief an Bone wieder aufgreifen (Abbildung 2). Das DXA-Bild zeigt deutlich, dass an den meisten Stellen der Knochenoberfläche keine erkennbare Kortex vorhanden ist, aus der die kortikalen Parameter abgeleitet werden könnten. Dies gilt für die Kontur der Knochenprojektion (A) und ist besonders zutreffend, wo zwei gegenüberliegende Kortizes senkrecht zum Röntgendetektor stehen (B). Dies ist in diesem Bild vom GE iDXA-Scanner mit einer Pixelgröße von 0,3 x 0,25 mm offensichtlich, wird aber bei Bildern, die ältere GE Prodigy DXA-Geräte verwenden, noch ausgeprägter, die Bilder mit deutlich niedrigerer Auflösung mit einer Pixelgröße von 0,6 x 1,05 mm erzeugen, aber ebenfalls von der 3D-Shaper-Software unterstützt werden.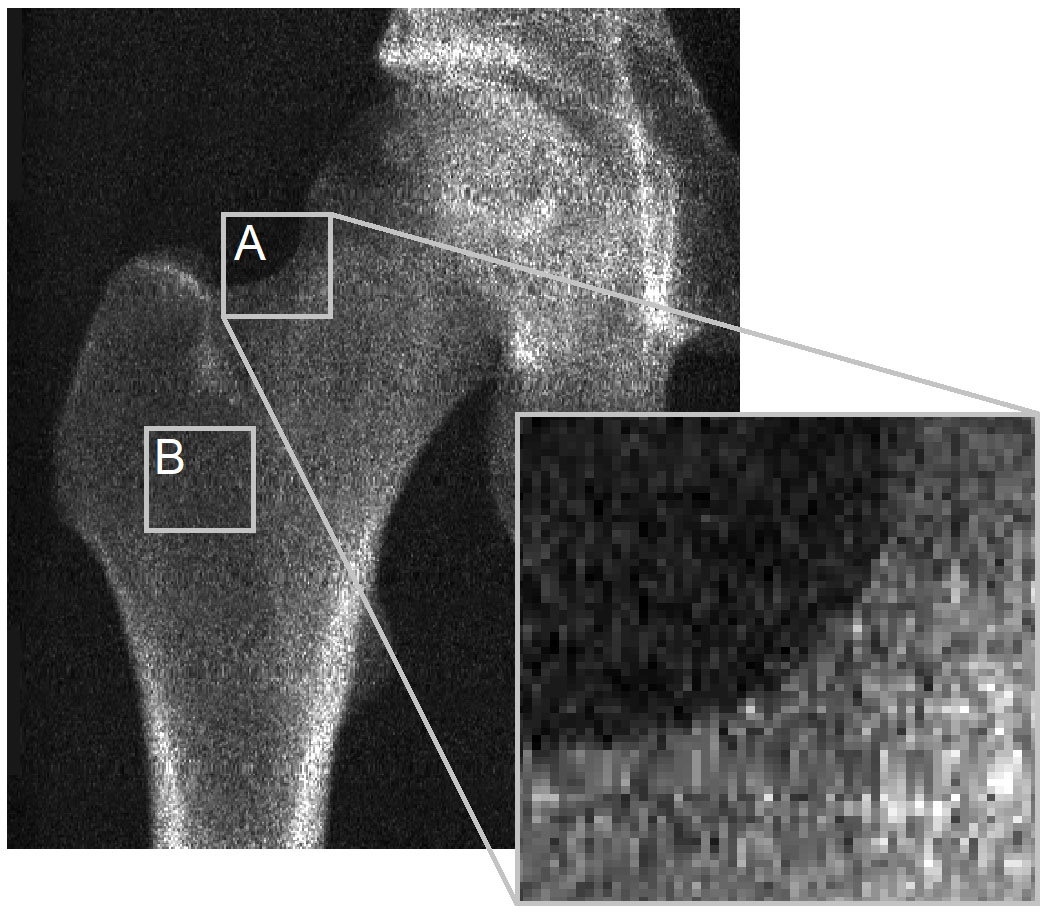
Anstatt die kortikalen Parameter direkt aus dem DXA-Bild zu messen, registriert 3D-DXA ein statistisches Modell der Form und Dichteverteilung auf das DXA-Bild [7] und extrahiert die kortikalen Parameter aus diesem Modell [2]. Dieses Modell wird aus einer Reihe von kalibrierten QCT-Scans konstruiert, in denen die Hounsfield-Einheiten der Voxel in einem Standard-CT-Scan unter Verwendung eines Kalibrierungsphantoms in BMD-Werte umgewandelt werden.
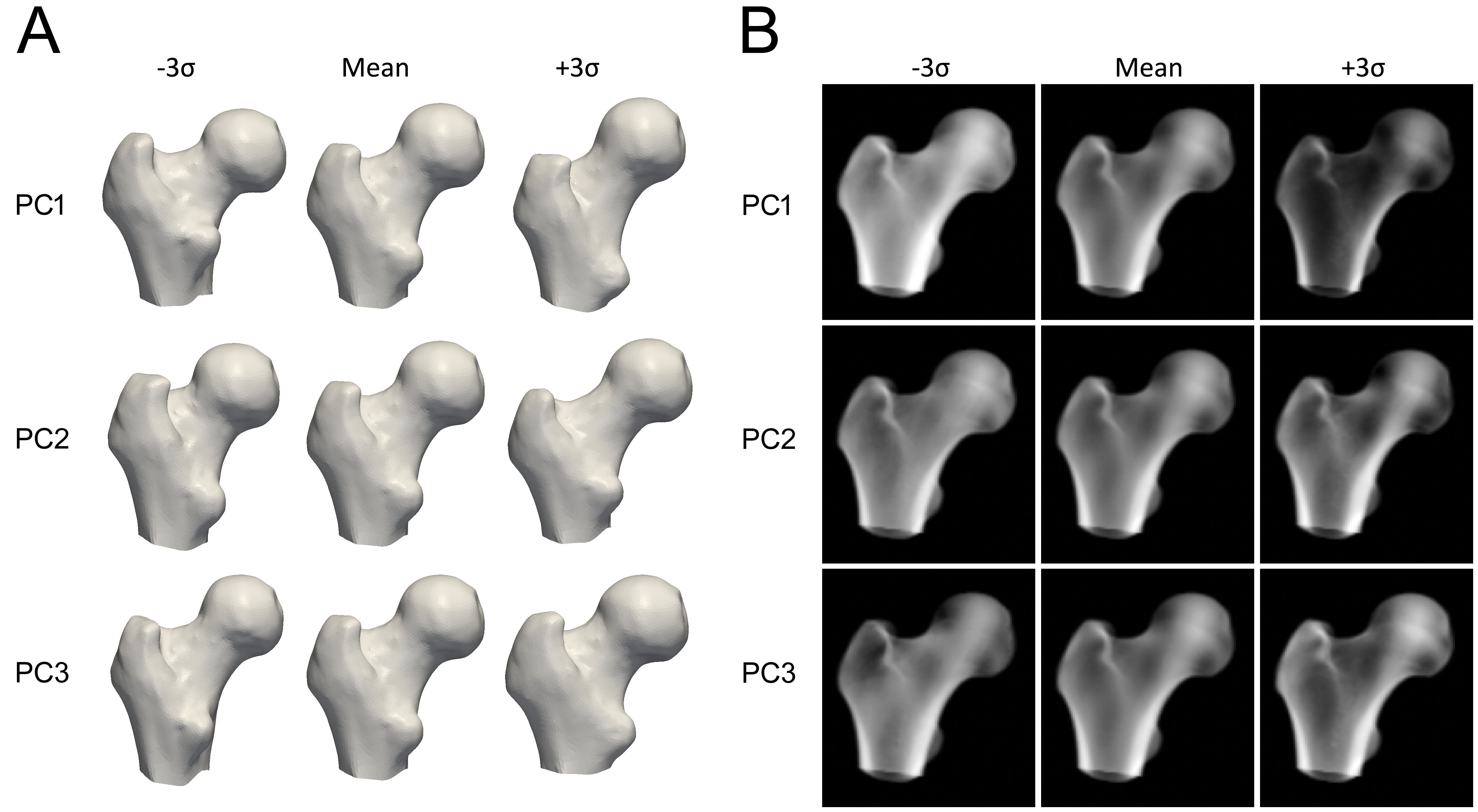
Um das Modell zu konstruieren, wird der proximale Femur in jedem QCT-Scan zunächst segmentiert, was bedeutet, dass ein Oberflächennetz des proximalen Femurs konstruiert wird. Eine mathematische Technik, wie die Hauptkomponentenanalyse (Principal Component Analysis), wird dann auf die Punkte der ausgerichteten Femurknochenoberflächen angewendet, was zu einer durchschnittlichen Form und einer Reihe von Hauptkomponenten (PCs) führt, die die Variationen in der Form beschreiben, geordnet nach ihrer Wichtigkeit.
Um das statistische Modell der Dichteverteilung zu konstruieren, werden die QCT-Volumina auf die mittlere Form deformiert, und dieselbe statistische Methode wird auf die BMD-Werte in den Volumina angewendet, wodurch ein mittleres Volumen und eine Reihe von PCs generiert werden, die die Variation der Knochenmineraldichte über das Volumen beschreiben.
Jede Hauptkomponente repräsentiert die Art und Weise, wie die Form oder Dichte des Knochens variieren kann (Abbildung 3). Die Modellparameter sind numerische Faktoren, die bestimmen, wie viel von jeder Komponente zum mittleren Modell hinzugefügt wird. Das Anpassen dieser Parameter modifiziert die Form oder Dichteverteilung, wodurch neue Modellinstanzen erzeugt werden. Die Parameter sind auf typischerweise 2,5 bis 3 Standardabweichungen ihrer Variation beschränkt, um sicherzustellen, dass das Knochenmodell gemäß dem Satz von QCT-Scans, aus dem es erstellt wurde, immer realistisch aussieht. Um eine neue Instanz des Modells zu erstellen, wird das Dichtevolumen deformiert, um der neuen Form zu entsprechen, unter Verwendung einer Thin Plate Splines (TPS)-Transformation, die mit einer Teilmenge der Formpunkte berechnet wird.
3D-DXA generiert anschließend eine 3D-Rekonstruktion durch iteratives Ändern der Modellparameter und Generieren entsprechender Modellinstanzen sowie Rotieren und Translatieren des Modells, bis die Projektion des Modells mit dem DXA-Bild gemäß einem vorgegebenen Ähnlichkeitsmetrik-Schwellenwert übereinstimmt (Abbildung 1).
Die kortikale Dicke und kortikale Dichte werden dann aus der Instanz des Modells unter Verwendung einer Methode gemessen, die einem für QCT vorgeschlagenen Dekonvolutionsansatz entspricht [8]. Daher werden die kortikalen Parameter nicht aus dem DXA-Bild gemessen, sondern aus einem parametrischen Modell, das auf dieses Bild registriert wurde.
Wenn also Karten der kortikalen Parameter von 3D-DXA präsentiert werden, mit Werten an Stellen, an denen keine Kortex möglicherweise gemessen werden konnte [9, 10, 11, 12, 13], wurden diese Karten lediglich aus der Modellinstanz abgeleitet. Obwohl 3D-Shaper Medical in einer Antwort auf einen Leserbrief an Bone [14] klarstellt, dass diese Parameter geschätzt statt gemessen werden, wäre eine genauere Beschreibung, dass 3D-DXA diese Werte unter Verwendung einer komplexen und potenziell fehleranfälligen statistischen Methode vorhersagt. Angesichts der begrenzten Sichtbarkeit der Kortex in DXA-Bildern verlässt sich die Software primär auf die allgemeine Knochendichte und wird durch die statistischen Charakteristika der spanischen Population, auf der das Modell basiert, eingeschränkt. Die breiteren Auswirkungen dieser Einschränkung werden im weiteren Verlauf der Übersicht untersucht.
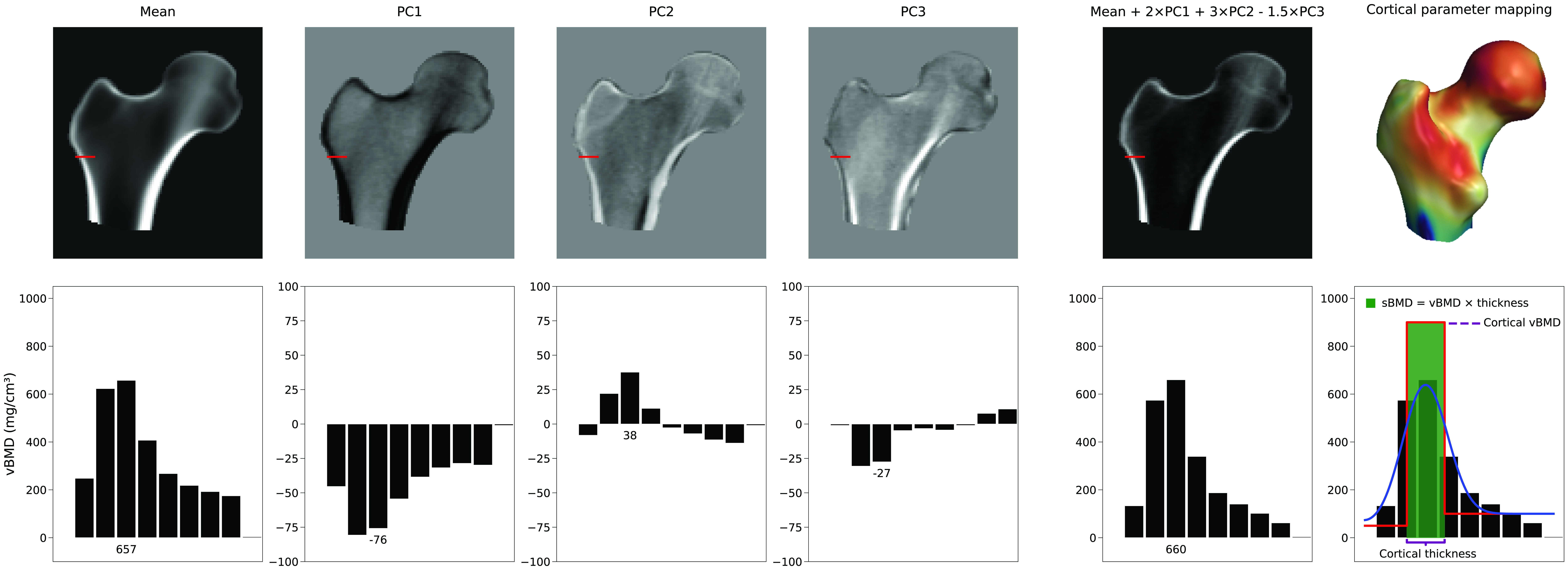
Anzahl der verwendeten Modellparameter
Es gibt keinen einzelnen Parameter, der die kortikale Dicke erhöht. Stattdessen hängt die Darstellung der Kortex von einer linearen Kombination des durchschnittlichen 3D-Volumens und der PCs des Dichtemodells ab. In Abbildung 4 sehen wir ein Beispiel, wie der Mittelwert und die ersten drei PCs eine neue Modellinstanz generieren können. In diesem Beispiel haben die Modellparameter, die die Skalierungsfaktoren für die PCs sind, Werte von 2, 3 bzw. -1,5. Während PC1 die Dichte überall erhöht oder verringert, ändern die anderen PCs die Dichteverteilung auf nicht deskriptive Weise. Diese Abbildung veranschaulicht auch, wie die kortikalen Parameter anschließend aus diesem neuen Volumen geschätzt werden, indem ein geglättetes Treppenstufenmodell angepasst wird. Selektive und unabhängige Anpassungen der kortikalen Dicke, kortikalen Dichte oder trabekulären Dichte, falls überhaupt erreichbar, würden eine komplexe Kombination mehrerer Hauptkomponenten und folglich vieler Modellparameter erfordern.Typischerweise wird eine Teilmenge von Hauptkomponenten beibehalten, die die Hauptmodi der Variation beschreiben. Dies reduziert die Variation der BMD-Verteilung und der Oberflächenpunkte auf einen reduzierten Satz von Parametern. Wie viele Modellparameter benötigt werden, wird typischerweise bestimmt, indem die Anzahl der Form- und Dichtemodellparameter berechnet wird, die 95% der Variationen innerhalb seiner Population beschreiben, oder durch Bestimmung des "Ellbogens" im kumulativen Varianzdiagramm. Jedoch ist es genauer, Horns Parallelanalyse [6] zu verwenden, die mathematisch bewertet, welche PCs als Rauschen betrachtet und daher verworfen werden können.
Obwohl die Anzahl der verwendeten Parameter ein kritisches Element in jedem statistischen Modellierungsansatz ist, wurde diese Zahl meines Wissens nach von 3D-Shaper Medical nie offengelegt. Wenn die Anzahl der Parameter nicht angemessen groß ist, wie durch Horns Parallelanalyse bestimmt, ist sie möglicherweise nicht in der Lage, den vollen Variationsbereich der Femurmorphologie der Eingabepopulation genau darzustellen. Darüber hinaus, wenn diese Anzahl von Parametern in Forschungs- und klinischen Anwendungen nicht gleich ist, wird es eine Diskrepanz in der berichteten und klinischen Genauigkeit von 3D-DXA geben.
Potenzielle Populationsverzerrung
Jedes von 3D-DXA generierte 3D-Knochenmodell wird aus Statistiken über die Variationen der Eingabepopulation abgeleitet. Im Fall von 3D-Shaper wird das statistische Modell aus einer spanischen Population von 81 Frauen und 30 Männern mit einem Durchschnittsalter von 56,2 ± 12,1 Jahren [30 Jahre – 84 Jahre] [2] ohne Behandlungen oder Krankheiten, die den Knochenstoffwechsel beeinflussen [15], erstellt. Es ist klar, dass sich die Femurmorphologie zwischen Männern und Frauen unterscheidet, aber auch Demografien spielen eine wichtige Rolle. Zum Beispiel unterscheiden sich die Femurknochen kaukasischer Populationen signifikant von denen asiatischer Populationen, wie in früheren Studien dokumentiert wurde [16].Ein aus einer kaukasischen Population erstelltes Modell wird nicht in der Lage sein, eine Rekonstruktion zu generieren, die zu jedem Subjekt in einer asiatischen Population passt. Dies liegt daran, dass die Parameter eines statistischen Modells auf 3 Standardabweichungen um das durchschnittliche Femurmodell einer spanischen Population beschränkt sind. Beispielsweise berichtet eine Studie, dass weiße Frauen eine Kortikalisdicke des Schenkelhalses von 1,84 ± 0,03 mm haben, während sie bei koreanischen Frauen 2,41 ± 0,71 mm beträgt, gemessen durch QCT-Scans [17]. Folglich würde eine koreanische Frau mit einer durchschnittlichen Kortikalisdicke von 2,41 mm außerhalb des Variationsbereichs für eine weiße Population fallen, wenn dieser auf drei Standardabweichungen (1,75–1,93 mm) beschränkt ist. Dieses Beispiel veranschaulicht die Bedeutung, dass das Modell die Zielpopulation repräsentiert.
Obwohl die Messungen von 3D-DXA mit QCT in einer japanischen Population korrelieren [18], liegt dies einfach daran, dass alle Parameter mit der flächenbezogenen BMD korrelieren. Es bedeutet nicht, dass patientenspezifische Rekonstruktionen erhalten wurden. Insbesondere können die geschätzten kortikalen Parameter erheblich von den wahren Werten abweichen, insbesondere hinsichtlich ihrer räumlichen Verteilung. Selbst wenn die vorhergesagte Femurform fehlerhaft ist, werden die Dichtewerte, einschließlich kortikaler Dicke und kortikaler BMD, immer noch die aBMD widerspiegeln, solange die Projektion des statistischen Modells weitgehend mit dem Knochen im DXA-Bild überlappt. Eine Person mit niedriger aBMD wird eine niedrige vBMD, eine niedrige kortikale BMD und eine dünnere Kortex im Vergleich zu einem Patienten mit hoher aBMD in jeder Population haben. Darüber hinaus berichtete [18] nur Korrelationen, und es kann eine signifikante Verzerrung geben, wenn ein Modell angewendet wird, das aus einer spanischen Population entwickelt wurde, auf eine japanische Population, was klinische Konsequenzen haben könnte. Trotz dieser fundamentalen Einschränkung wird 3D-DXA derzeit in Asien vermarktet, einschließlich Ländern wie Japan, Thailand und Indien.
Ein statistisches Modell muss an der Population trainiert werden, auf die es angewendet wird. Dies könnte bedeuten, separate Modelle für jedes Geschlecht, jede Ethnie und potenziell jeden Behandlungstyp zu erstellen oder alle diese Untergruppen in einem Modell einzuschließen, vorausgesetzt, dass genügend Parameter beibehalten werden, um den vollen Variabilitätsbereich zu erfassen. Dieses Prinzip ist für maschinelles Lernen und Werkzeuge der künstlichen Intelligenz gut etabliert [19, 20, 21, 22], ist jedoch für statistische Modellierungsansätze noch kritischer, wo Modelle aktiv durch die Eingabepopulation eingeschränkt werden. Dennoch wurde 3D-DXA in Studien mit Populationen verwendet, die offensichtlich von der Modellpopulation abweichen, einschließlich: professionellen Tänzern [9], Fußballspielern und Schwimmern [23] jungen Frauen mit Adipositas [24], schwarzen Frauen [25], Patienten mit hoher Knochenmasse [11], mit erwachsenem Wachstumshormonmangel [26] mit Psoriasis-Krankheit [27], mit Typ-2-Diabetes [28], mit primärem Hyperparathyreoidismus [10, 29], mit Akromegalie [30], mit Down-Syndrom [13], nach Schlauchmagen-Operation [31], Männern mit Rückenmarksverletzung [32], australischen Männern mittleren und älteren Alters mit niedriger Knochenmasse [33], und vielleicht am besorgniserregendsten von allen, pädiatrischen Krebsüberlebenden [34].
Begrenzte Rekonstruktionsgenauigkeit
3D-DXA ist eine hochkomplexe Methode, die anfällig für Fehler in mehreren Stadien ist. Dazu gehören Ungenauigkeiten aus der QCT- Kalibrierung, deformierbare Registrierung zum Erstellen statistischer Modelle, Deformation des Dichtemodells zur Forminstanz, Diskrepanzen in BMD und Auflösung zwischen QCT und DXA sowie die Vereinfachung der Modellprojektion durch eine isometrische Projektion anstelle der Fächerstrahlprojektion. Jeder dieser Faktoren kann Verzerrungen auf unvorhersehbare Weise einführen, was die Ergebnisse potenziell verfälschen kann. Zusätzlich beschränken spezifische Implementierungsdetails, wie das Erstellen des statistischen Modells aus einem sehr kleinen Satz von 111 erwachsenen spanischen Subjekten (was die Varianz in Form, Dichte und kortikaler Dicke begrenzt), die Anwendbarkeit dieses Softwaretools weiter.Darüber hinaus ist es nicht klar, ob 3D-Shaper die proprietären Datendateien von GE- und Hologic- Geräten genau lesen kann, insbesondere im Hinblick auf die korrekte Anwendung der Kalibrierungs- und Korrekturfaktoren für unterschiedliche Körperzusammensetzungen. Diese potenziellen Ungenauigkeiten können 3D-Shaper-Ergebnisse beeinflussen, wenn sie auf verschiedene Populationen angewendet werden oder wenn sich Populationsmerkmale im Laufe der Zeit verschieben.
Es liegt auf der Hand, dass, wenn die Form und Orientierung des proximalen Femurs nicht perfekt mit dem DXA-Bild übereinstimmt, innerhalb einer Sub-Millimeter-Genauigkeit, es nicht möglich sein sollte, die kortikale Dicke innerhalb einer Sub-Millimeter-Genauigkeit, noch die kortikale Dichte zu extrahieren. Leider ist es nicht möglich, eine perfekte Rekonstruktion aus nur einem einzelnen 2D-DXA-Bild zu generieren, wie eine frühe Studie mit 3D-DXA bereits zeigte [35]. Hier wurde gezeigt, dass das Hinzufügen einer zweiten Ansicht den Formfehler von 1,3 mm auf 0,9 mm und den BMD-Fehler von 4,4% auf 3,2% reduziert, was auf eine klare suboptimale Rekonstruktion aus einer einzelnen Ansicht hinweist. Im Gegensatz dazu rekonstruiert die Computertomographie ein Volumen unter Verwendung von Hunderten von Projektionen, die aus allen Winkeln um den Femur herum erfasst wurden. Dadurch ermöglicht QCT die unabhängige Messung von kortikalen und trabekulären Parametern.
3D-DXA kann Femurmodelle mit einer völlig unterschiedlichen Morphologie produzieren, je nachdem, wo die Suche nach den Modellparametern konvergierte, insbesondere wenn die korrekte Rotation nicht wiederhergestellt wurde. Dies kann stark variieren, wie durch eine Studie unter Verwendung von 3D-DXA mit wiederholten DXA-Scans am selben Tag belegt wurde, die Unterschiede in der vorhergesagten Stärke von bis zu 62% enthüllte [36]. Diese Studie berichtete auch über elementweise BMD-Unterschiede, die 30 ± 50% erreichten, was sich wahrscheinlich auch in einer niedrigen Wiederholgenauigkeit für die kortikalen Parameter widerspiegeln wird, obwohl diese Zahlen nicht bereitgestellt wurden. In einer separaten Studie wurde auch berichtet, dass die Korrelation zwischen 3D-Shaper- und QCT-Dichtewerten niedrig war (r2 = 0,48) [37], was weiter auf eine begrenzte subjektspezifische Rekonstruktionsgenauigkeit hinweist.
In einer Studie zur Messung der strukturellen Parameter des Femurs unter Verwendung von 3D-DXA wurde ein Korrelationskoeffizient von r = 0,86 für die Schenkelhalsachsenlänge berichtet [38], wenn die aus dem 3D-DXA-Volumen abgeleitet Messungen mit den Ground-Truth-Messungen aus CT korreliert wurden. Dies ist schlechter als bei direkter Messung im DXA-Bild (r = 0,90, [39]). Auch die von 3D-DXA produzierten Schenkelhalswinkel sind von begrenzter Genauigkeit (r = 0,71, [38]). Ein offensichtlicher Grund für den Mangel an dieser Genauigkeit ist, dass der Femurkopf aus dem Rekonstruktionsprozess unter Verwendung einer Maske ausgeschlossen wird, um zu verhindern, dass die Überlappung des Hemipelvis die Rekonstruktion stört, obwohl dies durch Hinzufügen eines zweiten Modells des Hemipelvis wie in [5] gelöst werden könnte.
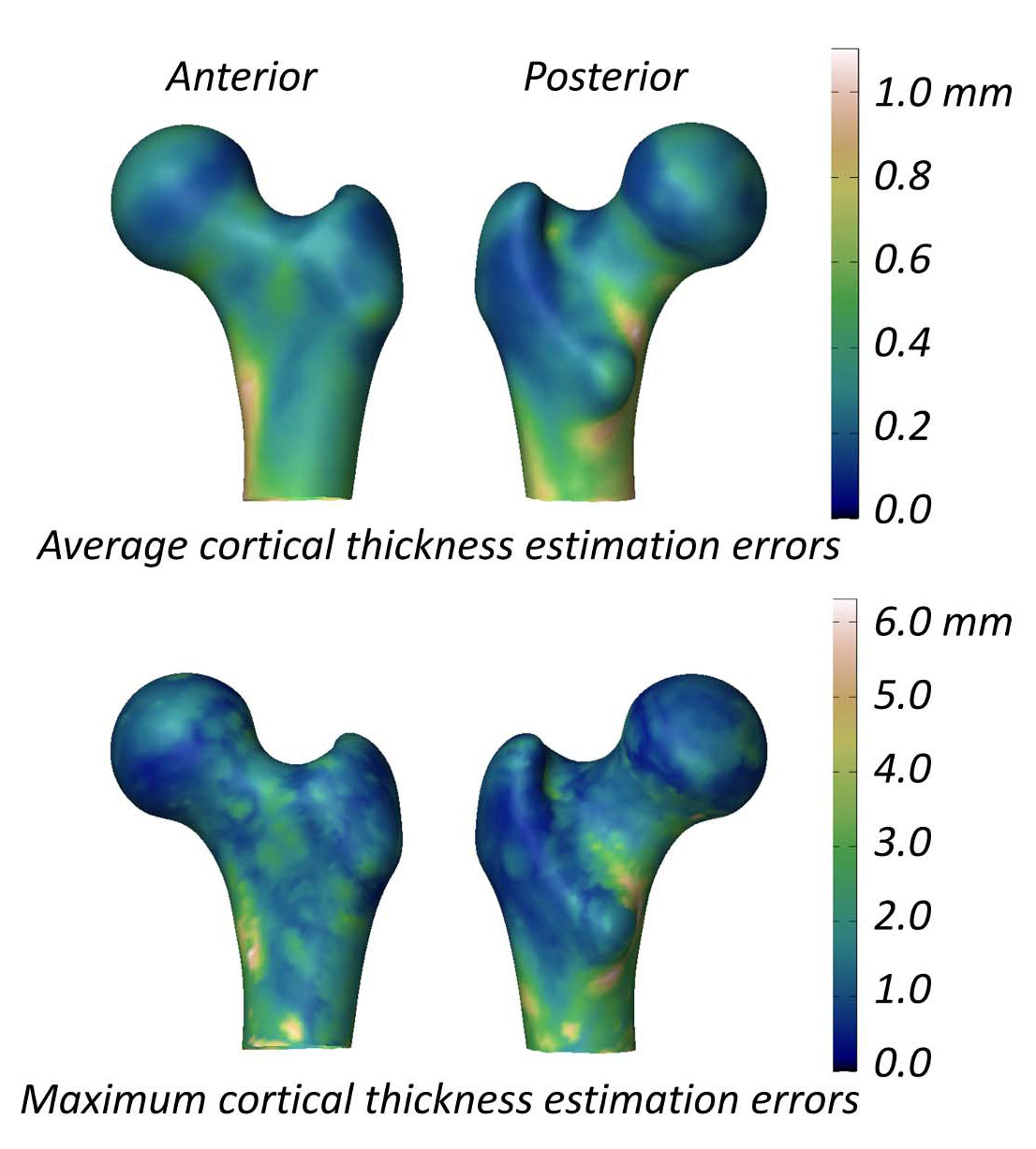
Die Studie, die die Fähigkeit von 3D-DXA zur Messung der kortikalen Parameter bewertet, berichtet über einen mittleren (± Standardabweichung) Unterschied der kortikalen Dicke zwischen 3D-DXA und QCT von 0,04 ± 0,21 mm am Schenkelhals und -0,07 ± 0,15 mm am Trochanter [2]. Diese Studie präsentierte auch eine Abbildung, die die mittleren und maximalen absoluten Fehler der Schätzung der kortikalen Dicke über die Oberfläche des Femurmodells zeigt (Abbildung 5), mit einem mittleren Fehler größer als 0,2 mm und einem maximalen Fehler größer als 1 mm über einen Großteil der Femuroberfläche. Im Vergleich dazu berichtete eine QCT-Studie, die Änderungen der kortikalen Dicke nach einer 18-monatigen Alendronat-Behandlung maß, einen Anstieg von 1,4%, entsprechend einem ungefähren Anstieg der kortikalen Dicke von 0,018 mm [40]. Daten, die aus drei klinischen Studien zu Teriparatid zusammengestellt wurden, zeigten an, dass die kortikale Dicke um 0,035 mm zunahm [41]. In Anbetracht dessen, dass der 3D-DXA-Fehler diese typischen behandlungsinduzierten Änderungen übersteigt, sind 3D-DXA-Messungen wahrscheinlich nicht in der Lage, zuverlässig zwischen echten therapiebedingten Effekten und methodischem Rauschen zu unterscheiden. Mit anderen Worten, wenn sich der kortikale Knochen eines Individuums zu ändern scheint, bleibt unklar, ob dies auf eine echte physiologische Veränderung oder auf den inhärenten 3D-DXA-Messfehler zurückzuführen ist.
Begrenzter Nutzen gegenüber flächenbezogener BMD
In dem statistischen Dichtemodell, das 3D-DXA verwendet, ist der erste Modellparameter für den Großteil der Variation verantwortlich, und eine Erhöhung seines Wertes führt zu einer Zunahme sowohl der Gesamtdichte als auch aller kortikalen Parameter [7]. Da im DXA-Bild nur wenig Information über die Kortex vorhanden ist, verlässt sich 3D-DXA hauptsächlich auf die Gesamtdichte und damit auf den ersten Modellparameter. Folglich sind die kortikalen und trabekulären Parameter inhärent korreliert. Obwohl es einen gewissen Beitrag von den unteren medialen und lateralen Kortizes des Schafts geben kann, die im DXA-Bild sichtbar sind, spiegeln die von 3D-DXA zurückgegebenen Parameter überwiegend die gesamte flächenbezogene BMD (aBMD) wider. Das bedeutet, dass, wenn die aBMD zunimmt, die 3D-DXA-Analyse gleichzeitige Anstiege bei trabekulärer BMD, kortikaler BMD und kortikaler Dicke zeigen wird. Tatsächlich bestätigt eine aktuelle Studie, die auf dem Kongress der European Calcified Tissue Society 2024 [42] und dem Jahrestreffen der American Society for Bone and Mineral Research 2024 [43] vorgestellt wurde, dass 3D-Shaper-Parameter stark mit aBMD korrelieren und daher keine zusätzlichen Informationen zur Frakturvorhersage liefern.Darüber hinaus erfasst die 3D-DXA-Rekonstruktion zwar die gesamte im DXA-Bild sichtbare Femursilhouette, ihre Fähigkeit, die Halsachsenlänge und den Hals-Schaft-Winkel wiederherzustellen, ist jedoch begrenzt. Folglich spiegelt die rekonstruierte Form hauptsächlich die allgemeine Knochengröße wider, die bereits durch aBMD bereitgestellt wird und nicht viel zur Vorhersage der Bruchfestigkeit beiträgt. Illustrativ hierfür ist der Befund, dass Stärkevorhersagen von 3D-DXA mit QCT korrelierten (r2 = 0,88), aber statistisch nicht besser waren als bei Vorhersage nur durch Schenkelhals-aBMD aus dem DXA-Bild (r2 = 0,87) [37]. Eine Studie von 3D-Shaper Medical zeigt eine ähnliche Korrelation (r2=0,86), aber ein Vergleich mit aBMD wurde ausgeschlossen [44]. In einer anderen Studie an einer japanischen Population waren Maßnahmen von 3D-Shaper statistisch nicht besser bei der Vorhersage von Hüftfrakturen als die Gesamthüft-aBMD [45].
Es wurden andere Artikel über eine ähnliche Methode veröffentlicht, bei der ein statistisches 3D-Modell auf ein 2D-DXA-Bild registriert wird und die Femurstärke vorhergesagt wird [46, 47], wobei eine Studie eine Verbesserung gegenüber aBMD bei der Vorhersage des Frakturrisikos zeigte [48]. Diese Methode kann einige Vorteile gegenüber 3D-DXA bieten, wie die Verwendung eines zusätzlichen Beckenmodells, um zu helfen, die volle Form des proximalen Femurs wiederherzustellen. Obwohl sie vielen der gleichen methodischen Einschränkungen unterliegt.
Wenn 3D-DXA es nicht schafft, aBMD allein zu übertreffen, kann es sicherlich keine Kombination aus aBMD und HSA-Parametern übertreffen, die direkt aus DXA-Bildern gemessen werden. Dies unterstreicht die fundamentalen Einschränkungen von 3D-DXA und stellt seine Rechtfertigung für die Nutzung in klinischen oder Forschungsumgebungen in Frage. Dennoch bietet 3D-Shaper Medical jetzt eine auf 3D-DXA basierende Finite-Elemente-Analyse als Dienstleistung an.
Validierungsmethoden
Trotz der inhärenten Einschränkungen von 3D-DXA berichten zahlreiche Publikationen über positive Ergebnisse hinsichtlich seiner Genauigkeit. Diese Diskrepanz kann auf die Verwendung ungeeigneter Validierungsmethoden [21, 22] zurückgeführt werden, die dazu neigen, die wahren Einschränkungen der Software zu verschleiern. In den folgenden Abschnitten werde ich die Probleme mit diesen Validierungen diskutieren und wie sie eine Wahrnehmung der Zuverlässigkeit und klinischen Nützlichkeit von 3D-DXA erzeugen.Falsche Leistungsbewertungsmetriken
3D-Shaper Medical verglich das von 3D-DXA aus einem DXA-Bild generierte Oberflächennetz mit dem Oberflächennetz, das manuell aus dem QCT-Scan derselben Subjekte generiert wurde, was zu einem mittleren Punkt-zu-Oberfläche-Abstand von 0,93 mm führte [2]. Sie verglichen auch die kortikalen Parameter und fanden einen mittleren absoluten Fehler von 0,33 mm für die kortikale Dicke und 72 mg/cm³ für die kortikale Dichte. Es gibt jedoch keinen Referenzrahmen, um zu bestimmen, ob diese berichteten Fehler akzeptabel sind, was bedeutet, dass diese Metriken nicht notwendigerweise die Wirksamkeit der Software validieren.Eine weitere Möglichkeit, wie 3D-DXA evaluiert wurde, war die Verwendung von Korrelationen. Korrelationskoeffizienten von 0,86, 0,93, 0,95 und 0,91 wurden für trabekuläre, kortikale und integrale vBMD bzw. kortikale Dicke berichtet. Diese starken Korrelationen sind jedoch hauptsächlich darauf zurückzuführen, dass alle kortikalen Parameter sowohl in 3D-DXA-Modellen als auch in QCT-Scans stark mit der Gesamtdichte korrelieren. Patienten mit überdurchschnittlicher aBMD in ihren DXA-Scans werden im Durchschnitt auch eine erhöhte trabekuläre, kortikale und integrale vBMD sowie eine dickere Kortex aufweisen. Diese Korrelationsergebnisse liefern keinen schlüssigen Beweis für die Genauigkeit der Software bei der Generierung patientenspezifischer Rekonstruktionen und können tatsächlich einen irreführenden Eindruck von ihrer Leistung erwecken.
Korrelationen werden auch verwendet, um populationsbasierte Studien unter Verwendung von 3D-DXA zu bewerten. Ähnliche Effekte können gesehen werden, wenn 3D-DXA-Analysen signifikante Korrelationen zwischen ihren Parametern und den getesteten Faktoren oder über verschiedene Populationen hinweg zeigen. Dies liegt wiederum daran, dass diese Parameter inhärent mit der Gesamt-BMD korrelieren und somit direkt Änderungen oder Unterschiede in der aBMD widerspiegeln. Die Ergebnisse können vernünftig erscheinen und können wahre Änderungen eng widerspiegeln. Zum Beispiel erhöht körperliche Betätigung sowohl die Gesamtdichte als auch den kortikalen Knochenmineralgehalt [49], was zu scheinbar vernünftigen Ergebnissen einer 3D-DXA-Analyse führt, wenn die aBMD aufgrund von körperlicher Betätigung zunimmt. Diese spiegeln jedoch nicht die tatsächlichen kortikalen Parameter selbst wider, sondern lediglich die zugrunde liegenden Änderungen oder Unterschiede in der aBMD. Folglich können diese Studien einen irreführenden Eindruck von der Wirksamkeit von 3D-DXA erwecken und ein falsches Gefühl für seine Fähigkeit geben, kortikale Parameter genau zu messen.
Eine angemessenere Bewertung würde den Vergleich der kortikalen Parameter mit einem grundlegenden Basismodell beinhalten, wie einem blinden Schätzer. Hier bezeichnet ein blinder Schätzer eine einfache, naive Schätzmethode, die individuelle Variabilität nicht berücksichtigt und stattdessen einen Durchschnittswert aus der gesamten Population auf alle Subjekte anwendet. Zum Beispiel würde ein blinder Schätzer für die kortikale Dicke die mittlere Karte der kortikalen Dicke einer Gruppe von Individuen verwenden und sie einheitlich auf jeden Fall anwenden, unabhängig von ihren spezifischen Merkmalen. Dieser Ansatz dient als Basislinie oder Mindeststandard, an dem fortgeschrittenere Methoden gemessen werden sollten. Jede ausgefeilte Methode sollte zumindest diese grundlegende Schätzung übertreffen. Meines Wissens wurde eine solche Bewertung noch nicht veröffentlicht.
Die meisten Publikationen zur 3D-DXA-Software zeigen nur erfolgreiche Rekonstruktionen, was ein falsches Gefühl von Vertrauen in die Zuverlässigkeit der Software erzeugen kann. Um die Zuverlässigkeit von 3D-DXA quantitativ zu bewerten, kann eine Bewertung der Fehlerrate durchgeführt werden. In einer früheren Studie [51], obwohl nicht explizit angegeben, wurden nur 80 von 173 Subjekten beibehalten, nachdem Rekonstruktionen ausgeschlossen wurden, die durch Vergleich der Modellprojektionen mit den DXA-Bildern als ungenau identifiziert wurden, was eine Fehlerrate von über 50% ergibt. Um eine solche Bewertung zu ermöglichen, müsste 3D-Shaper eine Seite-an-Seite-Anzeige der Modellprojektion und des DXA-Bildes bereitstellen. Eine robustere Bewertung würde jedoch Renderings und Querschnittsansichten der resultierenden Volumina mit den Ground-Truth-QCT-Scans vergleichen und die Fehlerrate in einer unabhängigen Bewertung beurteilen.
In einigen Fällen wird lediglich das Beobachten signifikanter Änderungen oder Unterschiede als Beweis dafür präsentiert, dass 3D-DXA funktioniert, wobei außer Acht gelassen wird, ob die tatsächlichen Effekte korrekt sind. Als Reaktion auf meinen Leserbrief wurden signifikante Unterschiede zwischen den Behandlungsgruppen als Beweis für die Wirksamkeit von 3D-DXA präsentiert. In dieser Bewertung liefern die Autoren jedoch 2 unterschiedliche Ergebnisse für Änderungen der kortikalen BMD nach TPTD-Behandlung, wobei eines einen signifikanten Anstieg [52] und das andere einen nicht signifikanten Rückgang zeigt [15]. Keines von beiden spiegelt die tatsächliche Änderung wider, die man bei einer TPTD-Behandlung erwarten würde, wie ich in Abschnitt „Irreführende Ergebnisse in Studien zur Arzneimittelwirksamkeit“ erkläre.
Fehlen einer Korrektur für multiples Testen
Die Besorgnis in diesem Abschnitt bezieht sich nicht primär auf die 3D-DXA-Software selbst, sondern vielmehr auf den von 3D-Shaper Medical angebotenen Service und die nachfolgenden Publikationen. Das kritische Problem liegt im Fehlen von Korrekturen für multiples Testen (multiple comparison corrections) bei der Berichterstattung über Änderungen oder Unterschiede in den 3D-DXA-Parametern, insbesondere in den Karten der kortikalen Parameter.Die Anwendung von Korrekturen für multiples Testen ist entscheidend, wenn Daten mit mehreren unterschiedlichen Messungen analysiert werden. Für 3D-Shaper generiert die Software 71 Knochenparameter, wobei jeder einen separaten statistischen Test darstellt. Ohne Anpassung für diese multiplen Vergleiche, wie z.B. mit einer Bonferroni-Korrektur, steigt die Wahrscheinlichkeit, signifikante Ergebnisse durch Zufall zu erhalten, was zu falschen Schlussfolgerungen führt. Trotzdem berichten Studien, die 3D-Shaper verwenden, oft über signifikante Änderungen oder Unterschiede, ohne irgendeine Form der Korrektur für multiples Testen anzuwenden [10, 24, 27, 28], was ein ungerechtfertigtes Vertrauen in die Ergebnisse schafft. Dies kann irreführend sein, wenn bestimmte Parameter gemessen, aber nicht berichtet werden, eine Form des p-Hacking-Bias [53], bei dem signifikante Ergebnisse hervorgehoben werden, während das erhöhte Risiko falsch positiver Ergebnisse aufgrund der großen Anzahl durchgeführter Tests ignoriert wird.
Ein ähnliches Problem tritt auf, wenn Studien, die 3D-Shaper verwenden, farbcodierte Karten präsentieren, die Änderungen oder Unterschiede in kortikalen Parametern auf der Knochenoberfläche oder BMD-Werte im Volumen zeigen. In diesen Fällen repräsentiert jeder Vertex oder Voxel einen individuellen statistischen Test, wobei die Signifikanz oft durch einen einfachen t-Test an jedem Punkt bestimmt wird [9, 10, 11, 12, 13, 28, 52, 54, 55]. Dieser Ansatz hebt scheinbar signifikante Regionen in den farbcodierten Karten hervor und schafft die Illusion lokalisierter Änderungen oder Unterschiede, wo keine vorhanden sind. Bei der Präsentation von Änderungen oder Unterschieden im Volumen durch farbcodierte Querschnittsansichten wird die statistische Signifikanz auf Voxel-Ebene im Allgemeinen überhaupt nicht bereitgestellt [9, 11, 30, 52, 54, 55, 56]. Auf dieselbe Weise suggeriert dies echte Änderungen, wenn sie tatsächlich einfach ein Ergebnis zufälliger Variation sein könnten. Folglich können diese farbcodierten Karten einen übermäßig optimistischen Eindruck von der Wirkung von Behandlungen oder Interventionen vermitteln und fälschlicherweise Wirksamkeit suggerieren, wo möglicherweise keine vorhanden ist.
Das Problem falsch positiver Ergebnisse aufgrund unzureichender Korrekturen für multiples Testen ist eine anhaltende Herausforderung im Bereich der Neurobildgebung gewesen [57]. Um dies anzugehen, hat die Neurobildgebungsgemeinschaft Lösungen entwickelt, die auch auf Studien angewendet werden können, die Änderungen des kortikalen Knochens auf der Knochenoberfläche und Dichteänderungen in den Voxeln von QCT-Scans untersuchen. Poole et al. [58] beschreiben, wie SurfStat (http://math.mccgill.ca/keith/surfstat/) verwendet werden kann, um zu testen, ob Unterschiede in den kortikalen Parametern an jedem Punkt auf der Knochenoberfläche statistisch signifikant waren, wobei die Random-Field-Theorie für die Korrektur für multiples Testen angewendet wurde. Ähnliche Pakete existieren für die voxelbasierte Analyse, wie die Statistical Parametric Mapping Library (https://www.fil.ion.ucl.ac.uk/spm/) und die FMRIB Software Library (https://fsl.fmrib.ox.ac.uk). Die Verwendung dieser Tools würde die statistische Strenge von Studien, die 3D-DXA verwenden, verbessern, obwohl die beobachteten Änderungen oder Unterschiede immer noch überwiegend die Korrelation aller Parameter mit der aBMD widerspiegeln würden.
Auswirkungen
Die Verwendung von 3D-DXA hat weitreichende Auswirkungen sowohl in der Forschung als auch in der klinischen Praxis. Die folgenden Abschnitte werden auf diese Herausforderungen eingehen.Irreführende Ergebnisse in Studien zur Arzneimittelwirksamkeit
In den meisten Studien stimmen die Ergebnisse von 3D-DXA mit dem überein, was in der Kortex erwartet wird, da kortikale Parameter bei gesunden Individuen typischerweise mit der aBMD korrelieren. Dies führt oft zu scheinbar vernünftigen Ergebnissen. Dieser Ansatz wird jedoch fehlerhaft, wenn die Änderungen nicht den herkömmlichen Mustern folgen. Die Methode ist besonders problematisch in Medikamentenstudien, in denen der normale Knochenumbau (Modeling und Remodeling) verändert ist und die üblichen proportionalen Anstiege oder Rückgänge aller Parameter möglicherweise nicht auftreten.Ein illustratives Beispiel ist eine Studie zu Teriparatid, bei der 3D-DXA einen Anstieg aller kortikalen Parameter anzeigte, einschließlich eines signifikanten Anstiegs der kortikalen vBMD im Vergleich zu Placebo [52]. Im Gegensatz dazu wurde unter Verwendung einer äquivalenten kortikalen Messtechnik, die auf QCT angewendet wurde, gezeigt, dass die kortikale BMD nach derselben 18-monatigen Teriparatid-Behandlung signifikant abnahm, was in Daten aus drei verschiedenen klinischen Studien konsistent beobachtet wurde [41]. Dieser Rückgang wird auf eine erhöhte Umbaurate zurückgeführt, die zu einer größeren kortikalen Porosität führt, wie auch bei Verwendung von Mikro-CT beobachtet wurde [59].
In einer früheren Studie berichtete 3D-Shaper Medical tatsächlich über einen Rückgang der kortikalen BMD als Reaktion auf Teriparatid [15]. Obwohl dies von den Autoren als Rückgang vermerkt wurde, war die Änderung statistisch nicht signifikant. Eine neuere unabhängige Studie fand ebenfalls keine signifikanten Änderungen der kortikalen BMD als Reaktion auf Teriparatid-Behandlung unter Verwendung einer 3D-DXA-Analyse [60]. Es ist möglich, dass es einen gewissen Einfluss von der Kortex des Schafts gibt, der im DXA-Bild teilweise sichtbar ist. Aufgrund der Natur von 3D-DXA könnte ein aBMD-Rückgang in dieser Region über das gesamte Femurmodell projiziert worden sein, einschließlich Bereichen, in denen keine Kortex sichtbar ist, da die Modellparameter die Dichteverteilung global beeinflussen. Dies führte jedoch nicht zu dem korrekten signifikanten Rückgang der kortikalen BMD, der in QCT-Studien beobachtet wurde.
Die Studie, die einen Anstieg aller kortikalen Parameter mit Teriparatid (TPTD) berichtete, bewertete auch Abaloparatid parallel und zeigte einen noch größeren Anstieg aller Parameter für Letzteres [52]. Folgestudien unter Verwendung der 3D-DXA-Analyse berichteten ebenfalls über signifikante Anstiege der kortikalen BMD nach Abaloparatid-Behandlung [55, 56]. Da Abaloparatid einen ähnlichen Wirkmechanismus wie TPTD teilt und die Rate des Knochenumbaus erhöht, würde man vernünftigerweise erwarten, dass es ebenfalls zu einem Rückgang der kortikalen BMD führt. Tatsächlich beobachtete eine Studie unter Verwendung von QCT einen Rückgang der kortikalen BMD nach einem ähnlichen Zeitraum der Abaloparatid-Behandlung bei 35 Patienten [61], obwohl die Reduktion statistisch nicht signifikant war. Dies deutet darauf hin, dass die 3D-DXA-Studien nicht nur ungenaue Änderungen produzierten, sondern wahrscheinlich auch zu einer übermäßig günstigen Bewertung der Wirkungen von Abaloparatid führten.
Eine Studie von Lewiecki et al. [54] veranschaulicht weiter die Grenzen von 3D-DXA bei der Messung diskordanter kortikaler Änderungen. Ihre 3D-DXA-Analyse berichtete über Anstiege aller kortikalen Parameter als Reaktion auf Romosozumab. Im Gegensatz dazu fand eine frühere QCT-Analyse keinen Anstieg der kortikalen BMD nach derselben Behandlung [62]. Die Autoren bemerkten: „Es ist unklar, warum Daten, die durch QCT und DXA-basierten 3D-SHAPER für Romosozumab-Behandlung erhalten wurden, für integrale und trabekuläre vBMD der Hüfte über die Studien hinweg ähnlich waren, sich aber für kortikale vBMD unterschieden.“ Da der Leserbrief an Bone, der von einigen derselben Autoren gesehen wurde, diese Diskrepanz bereits erklärt und vorhergesagt hatte [7], scheint es, dass weiterhin ein Missverständnis bezüglich der Fähigkeiten und Grenzen von 3D-DXA besteht. Infolgedessen hat dieses Missverständnis wahrscheinlich erneut zu einer übermäßig optimistischen Bewertung der Wirksamkeit des Medikaments geführt.
Diese Studien verbreiten weiter potenziell falsche Ergebnisse durch die Präsentation von Farbkarten kortikaler und trabekulärer Knochenänderungen. 3D-DXA kann keine lokalisierten oder fokalen Änderungen messen, teilweise weil jeder Modellparameter die Dichteverteilung global beeinflusst und auch weil diese Änderungen auf einem DXA-Bild nicht sichtbar sind. Das Versäumnis, Korrekturen für multiples Testen in diesen Studien anzuwenden, untergräbt die Ergebnisse weiter, da die scheinbar signifikanten Regionen in den Karten tatsächlich viel weniger signifikant sind, was zu einer übermäßig optimistischen Bewertung verschiedener Medikamente führt.
Patientenmanagement
Während die 3D-Shaper-Software 71 Messwerte generieren kann, produziert die klinisch zugelassene Version nur die globale trabekuläre vBMD und kortikale sBMD sowie einen zugehörigen T-Score und Z-Score. Es ist nicht klar, aus welcher Population der T- und Z-Score abgeleitet werden, obwohl in einem Webinar von 3D-Shaper Medical kaukasische Referenzdaten erwähnt werden [63]. Referenzdiagramme wurden zuvor für eine spanische [64] und eine argentinische [65] Population erstellt, die beide in Abbildung 6 reproduziert sind. Diese Diagramme scheinen jedoch voneinander und von den von der 3D-Shaper-Software produzierten Abbildungen abzuweichen. 3D-Shaper Medical, DMS Imaging und ihre Distributoren legen diese Population nicht offen, oder wie diese Daten abgeleitet wurden. Es wurde jedoch von Toyo Medic Co., Ltd. (Tokio, Japan), dem Distributor von 3D-Shaper in Japan, bestätigt, dass die für den japanischen Markt zugelassene 3D-Shaper-Software keine Referenzdaten aus einer japanischen Population verwendet. Angesichts des großen Unterschieds in kortikalen und trabekulären Parametern zwischen kaukasischen und asiatischen Populationen [68], scheint die Anwendung dieser T- und Z-Scores in Japan ohne weitere Validierung nicht ratsam. Ihre Gültigkeit sollte auch für jede Population bestätigt werden, in der sie angewendet werden.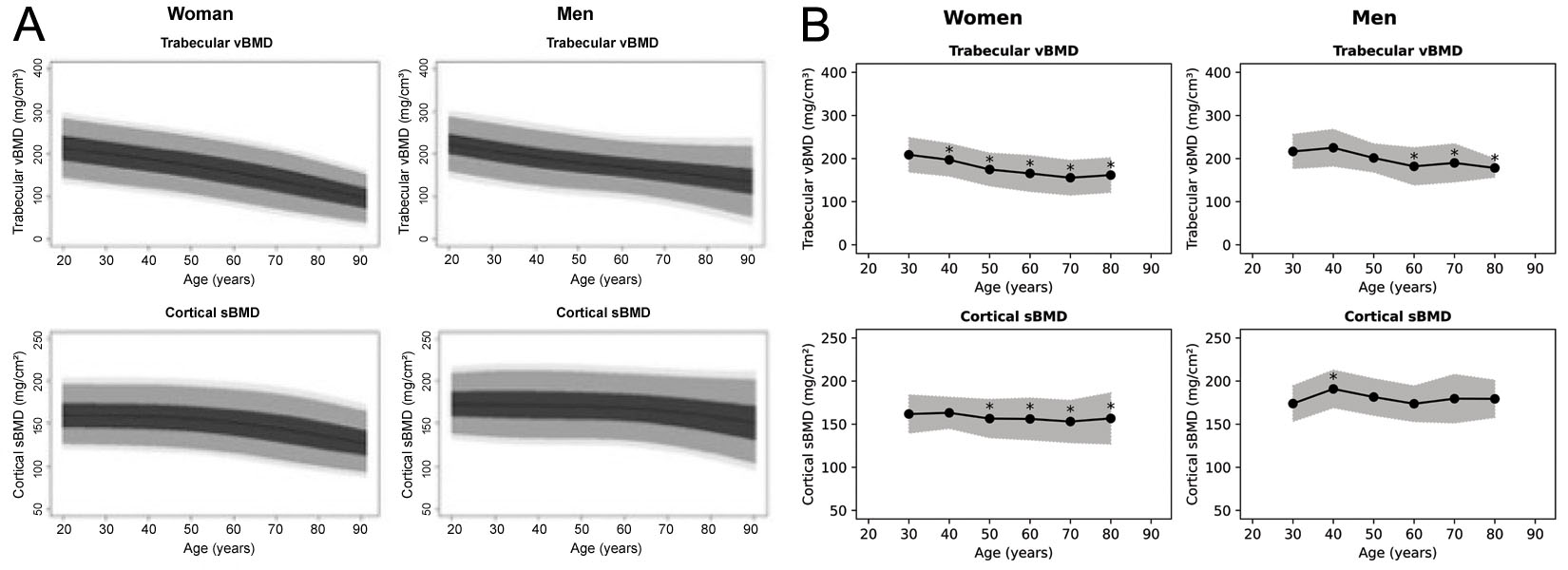
In einem Webinar [66] schlug 3D-Shaper Medical eine mögliche klinische Anwendung vor, bei der 3D-Shaper zu einer niedrigen kortikalen sBMD und sehr niedrigen trabekulären vBMD führte. Da Teriparatid laut Tabelle den trabekulären Knochen stärker verbessert als den kortikalen Knochen, wurde gesagt, dass Teriparatid die beste Behandlung sei. Basierend auf dieser Tabelle würde ein Kliniker jedoch natürlich Denosumab oder Abaloparatid gegenüber Teriparatid wählen, wenn er die vertebrale aBMD vernachlässigt.
3D-DXA wird wahrscheinlich nur zusammen mit regulären DXA T-Score- und Z-Score-Bewertungen verwendet. Somit wird die Gefahr, ein Hochrisiko-Individuum zu übersehen, minimal sein. Aufgrund des mit 3D-DXA verbundenen Fehlers werden die kortikale sBMD und die trabekuläre vBMD jedoch immer etwas höher oder niedriger sein. Bei Patienten an der Grenze zur Behandlung kann dies den Kliniker dazu verleiten, Anti-Osteoporose-Medikamente zu verabreichen, wo dies durch aBMD allein nicht indiziert wäre.
Eine Studie zum Trabecular Bone Score (TBS) zeigt, dass diese zusätzliche Bewertung Behandlungsentscheidungen bei sekundärer Osteoporose signifikant beeinflusst [67]. In dieser Studie hatten 21–25,5% der Patienten mit unauffälligen BMD-Messungen eine schlechte Knochenqualität, die durch TBS angezeigt wurde, was die Behandlungsentscheidung änderte. Ein ähnlicher Effekt könnte bei 3D-DXA auftreten, was potenziell zu unbeabsichtigten Konsequenzen wie Überverschreibung führen könnte. Wenn die Tabelle verwendet würde, könnte dies den Kliniker auch dazu verleiten, ein Medikament einem anderen vorzuziehen.
Es wird auch von 3D-Shaper Medical angegeben, dass Patienten überwacht werden können, um festzustellen, ob die gewählte Behandlung tatsächlich die erwartete Wirkung auf das kortikale und trabekuläre Kompartiment hat. Bedenkt man jedoch, dass Fehler von 3D-DXA größer sind als erwartete Änderungen und dass die Wiederholbarkeit gering ist [36], kann nicht festgestellt werden, ob Änderungen, die in einer Folge-3D-DXA-Bewertung gesehen werden, auf echte Effekte oder lediglich auf den inhärenten Fehler von 3D-DXA zurückzuführen sind. Wenn ein Kliniker diesen Ergebnissen vertraut, kann er dazu verleitet werden, die Behandlung unnötigerweise zu ändern.
(A)
| 2D DXA (Total hip) aBMD | 3D-DXA (3D-Shaper) Trabecular vBMD | 3D-DXA (3D-Shaper) Cortical sBMD | |
|---|---|---|---|
| Alendronate | + | + | + |
| Denosumab | ++ | ++ | ++ |
| Zoledronic acid | + | + | ++ |
| Teriparatide [15, 52, 55*, 56] | + | ++ | = |
| Abaloparatide | ++ | ++ | ++ |
| Romosozumab | +++ | +++ | +++ |
(B)
| aBMD | vBMD | sBMD | |
|---|---|---|---|
| Teriparatide [52, 56] (18 months) | ++ (3.3%) | ++/+++ (9%) | + (1.8%) |
| Teriparatide [15] (24 months) | = (p > 0.05) | ++/+++ (5.9%) | = (p > 0.05) |
| Teriparatide [60] (24 months) | = (p > 0.05) | ++/+++ (>14%) | = (p > 0.05) |
(C)
| Symbol | (Total hip) aBMD | Trabecular vBMD | Cortical sBMD |
|---|---|---|---|
| +++ | Δ > n/a % | Δ > n/a % | Δ > n/a % |
| ++ | 2 < Δ ≤ n/a % | 4 < Δ ≤ n/a % | 2 < Δ ≤ n/a % |
| + | 0.5 < Δ ≤ 2 % | 0.5 < Δ ≤ 4 % | 0.5 < Δ ≤ 2 % |
| = | -0.5 ≤ Δ ≤ 0.5 % | -0.5 ≤ Δ ≤ 0.5 % | -0.5 ≤ Δ ≤ 0.5 % |
| - | -2 ≤ Δ < -0.5 % | -4 ≤ Δ < -0.5 % | -2 ≤ Δ < -0.5 % |
| -- | Δ < -2 % | Δ < -4 % | Δ < -2 % |
Obwohl die klinische Version von 3D-DXA keine Informationen über die kortikale sBMD in den verschiedenen anatomischen Regionen liefert, zeigt sie ein farbcodiertes 3D-Modell der sBMD über die Knochenoberfläche an. 3D-Shaper Medical schlägt anschließend vor, dass dies verwendet werden kann, um lokale Fragilität zu erkennen [66]. Leider kann 3D-DXA die patientenspezifische kortikale Karte nicht rekonstruieren. Ich verweise erneut auf Abbildung 2 für eine intuitive Erklärung dafür. Wenn also eine 3D-DXA-Kortikalis-Karte lokale Defizite suggeriert, können diese statistisch plausible Ausgaben des Modells sein, entsprechen aber nicht der tatsächlichen Anatomie des Patienten. Dies kann wiederum zu einer unnötigen oder unangemessenen Behandlungsentscheidung führen.
Die 3D-Shaper-Software hat nun auch die FDA-Zulassung über das 510(k)-Premarket-Notification-Verfahren erhalten [68]. 3D-Shaper Medical erhielt diese durch eine Korrelationsstudie, in der die Querschnittsfläche (CSA), das Querschnittsträgheitsmoment (CSMI), das Widerstandsmoment (Z), das Knickverhältnis (BR), die kortikale Oberflächen- Knochenmineraldichte (sBMD), die trabekuläre volumetrische Knochenmineraldichte (vBMD) und die integrale vBMD mit ähnlichen Messungen der Software für Hüftstrukturanalysen (HSA) von Hologic Inc. verglichen wurden, die zuvor die FDA-Zulassung erhalten hatte.
Bemerkenswerterweise blieben die Halsachsenlänge und der Hals-Schaft-Winkel in dieser Bewertung unberücksichtigt, und somit ist die Verwendung dieser Parameter nicht von der FDA freigegeben. Es sollte beachtet werden, dass die Richtlinien der International Society for Clinical Densitometry (ISCD) empfehlen, dass HSA-Parameter nicht zur Bewertung des Risikos von Hüftfrakturen verwendet werden sollten, mit Ausnahme der Hüftachsenlänge [69]. Darüber hinaus beinhaltet diese behördliche Zulassung keinen T-Score oder Z-Score, um die Messungen mit Referenzdaten zu vergleichen. Dies wirft Bedenken hinsichtlich der klinischen Anwendbarkeit von 3D-Shaper in den Vereinigten Staaten auf.
Schließlich wurden die 3D-Shaper-Parameter als im Wesentlichen äquivalent zur HSA-Option für die Hologic QDR Röntgen-Knochendensitometer angesehen. Die FDA kann nicht bestätigen, ob 3D-Shaper mit anderen DXA-Scannern verwendet werden kann, was die Frage der Kompatibilität mit anderen Geräten in den Vereinigten Staaten ungelöst lässt.
Diskussion
Zusammenfassend lässt sich sagen, dass 3D-DXA eine Vielzahl von Knochenparametern produziert, die sehr detailliert erscheinen, aber primär die gesamte flächenbezogene BMD widerspiegeln, anstatt unterschiedliche kortikale oder trabekuläre Eigenschaften zu messen. Während die Software Ergebnisse liefern mag, die mit wahren Werten in Populationen korrelieren, in denen kortikale und trabekuläre Änderungen proportional zur aBMD sind, versagt sie bei der Erfassung patientenspezifischer Messungen oder lokalisierter Änderungen. Diese Einschränkung ist besonders ausgeprägt in Szenarien wie der anabolen Therapie, wo sich kortikale und trabekuläre Knochenparameter invers ändern können und 3D-DXA diese wahren Änderungen, die durch QCT beobachtet werden, nicht widerspiegelt. Dies wirft erhebliche Bedenken für seinen Einsatz in der routinemäßigen klinischen Versorgung oder als zuverlässiges Forschungsinstrument auf.3D-DXA wurde ursprünglich entwickelt, um Osteoporose durch die Bereitstellung einer Schätzung der integralen vBMD besser zu diagnostizieren [70, 71]. Indem nicht versucht wird, die kortikalen und trabekulären Kompartimente separat zu bewerten, kann die von 3D-DXA produzierte integrale vBMD immer noch eine valide Schätzung darstellen. Die Methodik wurde später erweitert, um zu versuchen, Frakturrisikoschätzungen durch direkte Analyse der Modellparameter zu verbessern, da diese Parameter die Morphologie des statistischen Modells vollständig beschreiben [51, 72, 73, 74]. Die Hauptbeschränkungen von 3D-DXA, wie in diesem Review detailliert beschrieben, bleiben jedoch bestehen und untergraben seine Genauigkeit und Zuverlässigkeit.
Diese Studie wurde durch die mangelnde Transparenz der Unternehmen, die 3D-DXA kommerzialisieren, einschließlich 3D-Shaper Medical, DMS Imaging und Fujifilm, eingeschränkt. Infolgedessen stützt sie sich auf öffentlich zugängliche Informationen und meine eigene Erfahrung bei der Entwicklung dieser Methodik. Ich ermutige die Leser, Klärungen von diesen Unternehmen oder ihren Vertretern bezüglich Aspekten von 3D-DXA und 3D-Shaper zu suchen, die nicht offengelegt wurden.
Bewertungen von Fachgesellschaften könnten wertvolle Orientierungshilfen bieten, indem sie unabhängige Bewertungen der Validität von 3D-DXA bereitstellen und offizielle Empfehlungen bezüglich seiner Verwendung festlegen. Obwohl ein Update der Praxisleitlinie für Dual-Röntgen-Absorptiometrie durch die International Working Group on DXA Best Practices bezüglich 3D-DXA feststellt, dass "mehr Beweise erforderlich sind, um Empfehlungen für die Anwendung dieser neuartigen Bildgebungstechniken in der klinischen Praxis abzugeben" [75], glaube ich, dass es jetzt genügend Beweise gibt, um eine Empfehlung darauf zu stützen, und ich hoffe, dass dieser Review in dieser Hinsicht hilfreich sein wird.
Abschließend ist es angesichts der fundamentalen Einschränkungen von 3D-DXA meine professionelle Einschätzung, dass die kortikalen und trabekulären Parameter, die von 3D-DXA bereitgestellt werden, nicht für Forschungszwecke verwendet werden sollten, noch sind sie für klinische Anwendungen wie Diagnose, Überwachung oder Unterstützung bei Behandlungsentscheidungen geeignet.
Autorenbeiträge
TW trug zur Konzeption, Datenkuratierung, formalen Analyse, Untersuchung, Methodik, Ressourcen, Visualisierung und zum Schreiben des Manuskripts bei.Finanzierung
Für diese Studie wurde keine Finanzierung erhalten.Datenverfügbarkeit
Alle in diesem Artikel präsentierten Daten sind auf Anfrage beim Autor erhältlich.Interessenkonflikte
Der Autor ist Miterfinder eines Patents, das sich auf die der 3D-DXA-Software zugrunde liegende Methodik bezieht. Der Autor war an Diskussionen über das geistige Eigentum und die Ursprünge des kommerziellen 3D-DXA-Softwarecodes, der statistischen Modelle und des Werbematerials beteiligt. Der Autor ist nicht mit 3D-Shaper Medical oder anderen Unternehmen verbunden, die an der kommerziellen Verwertung von 3D-DXA beteiligten sind, und hat kein Eigenkapital, keine Lizenzgebühren oder andere finanzielle Entschädigungen erhalten. Der Autor hat Vorträge für UCB in Bildungsforen gehalten und Forschungsunterstützung von Amgen Inc. und Lilly erhalten. Die in diesem Artikel geäußerten Ansichten sind ausschließlich die des Autors und basieren auf einer kritischen Bewertung der Methodik und der verfügbaren wissenschaftlichen Beweise.Referenzen
- Whitmarsh T (2012). 3D Reconstruction of the Proximal Femur and Lumbar Vertebrae from Dual-Energy X-Ray Absorptiometry for Osteoporotic Risk Assessment
- Humbert L, Martelli Y, Fonolla R, et al. (2017). 3D-DXA: Assessing the Femoral Shape, the Trabecular Macrostructure and the Cortex in 3D from DXA images. IEEE Transactions on Medical Imaging, 36(1), 27–39.
- Whitmarsh T, Humbert L, De Craene M, et al. (2011). Reconstructing the 3D Shape and Bone Mineral Density Distribution of the Proximal Femur From Dual-Energy X-Ray Absorptiometry. IEEE Transactions on Medical Imaging, 30(12), 2101–2114.
- Ahmad O, Ramamurthi K, Wilson KE, et al. (2010). Volumetric DXA (VXA): A new method to extract 3D information from multiple in vivo DXA images. Journal of Bone and Mineral Research, 25(12), 2744–2751.
- Väänänen SP, Grassi L, Flivik G, et al. (). Generation of 3D shape, density, cortical thickness and finite element mesh of proximal femur from a DXA image. Medical Image Analysis, 24(1).
- Whitmarsh T, Humbert L, De Craene M, et al. 3D bone mineral density distribution and shape reconstruction of the proximal femur from a single simulated DXA image: an in vitro study. In: Dawant BM, Haynor DR, eds. Medical Imaging 2010: Image Processing. Vol. 7623. SPIE; 2010:76234U.
- Whitmarsh T. Concerns regarding the use of 3D-DXA. Bone. 2021;149:115939.
- Treece G, Gee A (2015). Independent measurement of femoral cortical thickness and cortical bone density using clinical CT. Medical Image Analysis, 20(1), 249–264.
- Freitas L, Amorim T, Humbert L, et al. (2018). Cortical and trabecular bone analysis of professional dancers using 3D-DXA: a case–control study. Journal of Sports Sciences, 37(1), 82–89.
- Gracia-Marco L, García-Fontana B, Ubago-Guisado E, et al. (2019). Analysis of Bone Impairment by 3D DXA Hip Measures in Patients With Primary Hyperparathyroidism: A Pilot Study. The Journal of Clinical Endocrinology \& Metabolism, 105(1), 175–184.
- Orduna G, Humbert L, Fonolla R, et al. (2018). Cortical and Trabecular Bone Analysis of Patients With High Bone Mass From the Barcelona Osteoporosis Cohort Using 3-Dimensional Dual-Energy X-ray Absorptiometry: A Case-Control Study. Journal of Clinical Densitometry, 21(4), 480–484.
- Gifre L, Humbert L, Muxi A, et al. (2017). Analysis of the evolution of cortical and trabecular bone compartments in the proximal femur after spinal cord injury by 3D-DXA. Osteoporosis International, 29(1), 201–209.
- García Hoyos M, Humbert L, Salmón Z, et al. (2019). Analysis of volumetric BMD in people with Down syndrome using DXA-based 3D modeling. Archives of Osteoporosis, 14(1).
- Beck B, Harding A, Weeks B, et al. (2021). Response to “Concerns regarding the use of 3D-DXA”. Bone, 149, 115936.
- Winzenrieth R, Humbert L, Di Gregorio S, Bonel E, García M, Del Rio L. Effects of osteoporosis drug treatments on cortical and trabecular bone in the femur using DXA-based 3D modeling. Osteoporos Int.2018;29(10):2323–2333.
- Cummings SR, Cauley JA, Palermo L, et al. Racial differences in hip axis lengths might explain racial differences in rates of hip fracture. Osteoporos Int.1994;4(4):226–229.
- Kim KM, Brown JK, Kim KJ, et al. Differences in femoral neck geometry associated with age and ethnicity. Osteoporos Int. 2010;22(7):2165–2174.
- Sone T, Humbert L, Lopez M, et al. (2022). Assessment of femoral shape, trabecular and cortical bone in Japanese subjects using DXA-based 3D modelling. JOURNAL OF BONE AND MINERAL RESEARCH, 37, 214--214.
- Varoquaux G, Cheplygina V (2022). Machine learning for medical imaging: methodological failures and recommendations for the future. npj Digital Medicine, 5(1).
- Hadjiiski L, Cha K, Chan H, et al. (). AAPM task group report 273: Recommendations on best practices for AI and machine learning for computer‐aided diagnosis in medical imaging. Medical Physics, 50(2).
- Huisman M (2024). When AUC-ROC and accuracy are not accurate: what everyone needs to know about evaluating artificial intelligence in radiology. European Radiology, 34(12), 7892–7894.
- Gallifant J, Bitterman DS, Celi LA, et al. (2024). Ethical debates amidst flawed healthcare artificial intelligence metrics. npj Digital Medicine, 7(1).
- Amani A, Bellver M, del Rio L, et al. (2022). Femur 3D-DXA Assessment in Female Football Players, Swimmers, and Sedentary Controls. International Journal of Sports Medicine, 44(06), 420–426.
- Maïmoun L, Renard E, Humbert L, et al. (2021). Modification of bone mineral density, bone geometry and volumetric BMD in young women with obesity. Bone, 150, 116005.
- Jain RK, López Picazo M, Humbert L, et al. (2025). Bone Structural Parameters as Measured by 3-Dimensional Dual-Energy X-Ray Absorptiometry Are Superior in Black Women and Demonstrate Unique Associations With Prior Fracture Versus White Women. Endocrine Practice, 31(2), 152–158.
- Gracia-Marco L, Gonzalez-Salvatierra S, Garcia-Martin A, et al. (2021). 3D DXA Hip Differences in Patients with Acromegaly or Adult Growth Hormone Deficiency. Journal of Clinical Medicine, 10(4), 657.
- Toussirot E, Winzenrieth R, Aubin F, et al. (2024). Areal bone mineral density, trabecular bone score and 3D-DXA analysis of proximal femur in psoriatic disease. Frontiers in Medicine, 11.
- Ubago-Guisado E, Moratalla-Aranda E, González-Salvatierra S, et al. (2023). Do patients with type 2 diabetes have impaired hip bone microstructure? A study using 3D modeling of hip dual-energy X-ray absorptiometry. Frontiers in Endocrinology, 13.
- Guerra FS, Palladino N, Winzenrieth R, et al. (2024). Advanced 3D-DXA insights into bone density changes in hyperparathyroidism. Journal of Diabetes \& Metabolic Disorders, 23(2), 2191–2199.
- Kužma M, Vaňuga P, Ságová I, et al. Non-invasive DXA derived bone structure assessment of acromegaly patients: a cross sectional study. Eur J Endocrinol. 2019;180(3):201–211.
- Maïmoun L, Aouinti S, Puech M, et al. Modification of bone architecture following sleeve gastrectomy: a five-year follow-up. J Bone Miner Res. 2024;40(2):251–261.
- Maïmoun L, Gelis A, Serrand C, et al. (2023). Alteration of Volumetric Bone Mineral Density Parameters in Men with Spinal Cord Injury. Calcified Tissue International, 113(3), 304–316.
- Harding AT, Weeks BK, Lambert C, et al. (2020). Effects of supervised high-intensity resistance and impact training or machine-based isometric training on regional bone geometry and strength in middle-aged and older men with low bone mass: The LIFTMOR-M semi-randomised controlled trial. Bone, 136, 115362.
- Gil-Cosano JJ, Ubago-Guisado E, Sánchez MJ, et al. (2020). The effect of an online exercise programme on bone health in paediatric cancer survivors (iBoneFIT): study protocol of a multi-centre randomized controlled trial. BMC Public Health, 20(1).
- Humbert L, Whitmarsh T, De Craene M, et al. (2010). 3D reconstruction of both shape and Bone Mineral Density distribution of the femur from DXA images. 2010 IEEE International Symposium on Biomedical Imaging: From Nano to Macro, 456–459.
- O’Rourke D, Beck BR, Harding AT, et al. (2021). Assessment of femoral neck strength and bone mineral density changes following exercise using 3D-DXA images. Journal of Biomechanics, 119, 110315.
- Dudle A, Gugler Y, Pretterklieber M, et al. (2023). 2D-3D reconstruction of the proximal femur from DXA scans: Evaluation of the 3D-Shaper software. Frontiers in Bioengineering and Biotechnology, 11.
- Clotet J, Martelli Y, Di Gregorio S, et al. (2018). Structural Parameters of the Proximal Femur by 3-Dimensional Dual-Energy X-ray Absorptiometry Software: Comparison With Quantitative Computed Tomography. Journal of Clinical Densitometry, 21(4), 550–562.
- Ramamurthi K, Ahmad O, Engelke K, et al. (2011). An in vivo comparison of hip structure analysis (HSA) with measurements obtained by QCT. Osteoporosis International, 23(2), 543–551.
- Whitmarsh T, Treece GM, Gee AH, et al. (2015). Mapping Bone Changes at the Proximal Femoral Cortex of Postmenopausal Women in Response to Alendronate and Teriparatide Alone, Combined or Sequentially. Journal of Bone and Mineral Research, 30(7), 1309–1318.
- Whitmarsh T, Treece GM, Gee AH, et al. (2016). The Effects on the Femoral Cortex of a 24 Month Treatment Compared to an 18 Month Treatment with Teriparatide: A Multi-Trial Retrospective Analysis. PLOS ONE, 11(2), e0147722.
- Huininga K, Koromani F, Zillikens M, et al. (2024). Use of 3D Shaper Analysis for the Assessment of Fracture Risk in a Population-Based Setting. JBMR Plus, 8(Supplement\_1), i1--i340.
- Huininga K, Koromani F, Zillikens MC, et al. (2024). Use of 3D Shaper Analysis for the Assessment of Fracture Risk in a Population-based Setting. ASBMR 2024 Annual Meeting Abstracts and Abstract Book.
- Qasim M, López Picazo M, Ruiz Wills C, et al. (2024). 3D-DXA Based Finite Element Modelling for Femur Strength Prediction: Evaluation Against QCT. Journal of Clinical Densitometry, 27(2), 101471.
- Iki M, Winzenrieth R, Tamaki J, et al. (2021). Predictive ability of novel volumetric and geometric indices derived from dual-energy X-ray absorptiometric images of the proximal femur for hip fracture compared with conventional areal bone mineral density: the Japanese Population-based Osteoporosis (JPOS) Cohort Study. Osteoporosis International, 32(11), 2289–2299.
- Grassi L, Väänänen SP, Ristinmaa M, et al. Prediction of femoral strength using 3D finite element models reconstructed from DXA images: validation against experiments. Biomechanics and Modeling in Mechanobiology, 16(3).
- Grassi L, Fleps I, Sahlstedt H, et al. (). Validation of 3D finite element models from simulated DXA images for biofidelic simulations of sideways fall impact to the hip. Bone, 142.
- Grassi L, Väänänen SP, Jehpsson L, et al. (). 3D Finite Element Models Reconstructed From 2D Dual‐Energy X‐Ray Absorptiometry (DXA) Images Improve Hip Fracture Prediction Compared to Areal BMD in Osteoporotic Fractures in Men (MrOS) Sweden Cohort. Journal of Bone and Mineral Research, 38(9).
- Grassi L, Väänänen SP, Voss A, et al. DXA-based 3D finite element models predict hip fractures better than areal BMD in elderly women. Bone. 2025;195:117457.
- Allison SJ, Poole KES, Treece GM, et al. (2015). The Influence of High-Impact Exercise on Cortical and Trabecular Bone Mineral Content and 3D Distribution Across the Proximal Femur in Older Men: A Randomized Controlled Unilateral Intervention. Journal of Bone and Mineral Research, 30(9), 1709–1716.
- Whitmarsh T, Fritscher KD, Humbert L, et al. (2011). Hip fracture discrimination using 3D reconstructions from Dual-energy X-ray Absorptiometry. 2011 IEEE International Symposium on Biomedical Imaging: From Nano to Macro, 1189–1192.
- Winzenrieth R, Ominsky M, Wang Y, et al. (2021). Differential effects of abaloparatide and teriparatide on hip cortical volumetric BMD by DXA-based 3D modeling. Osteoporosis International, 32(3), 575–583.
- England JR, Cheng PM (2019). Artificial Intelligence for Medical Image Analysis: A Guide for Authors and Reviewers. American Journal of Roentgenology, 212(3), 513–519.
- Lewiecki EM, Betah D, Humbert L, et al. (2024). 3D-modeling from hip DXA shows improved bone structure with romosozumab followed by denosumab or alendronate. Journal of Bone and Mineral Research, 39(4), 473–483.
- Winzenrieth R, Kostenuik P, Boxberger J, et al. (2022). Proximal Femur Responses to Sequential Therapy With Abaloparatide Followed by Alendronate in Postmenopausal Women With Osteoporosis by 3D Modeling of Hip Dual‐Energy X‐Ray Absorptiometry (DXA). JBMR Plus, 6(4).
- Winzenrieth R, Humbert L, Boxberger JI, et al. (2022). Abaloparatide Effects on Cortical Volumetric BMD and Estimated Strength Indices of Hip Subregions by 3D-DXA in Women With Postmenopausal Osteoporosis. Journal of Clinical Densitometry, 25(3), 392–400.
- Bennett C, Miller M, Wolford G (2009). Neural correlates of interspecies perspective taking in the post-mortem Atlantic Salmon: an argument for multiple comparisons correction. NeuroImage, 47, S125.
- Poole KE, Treece GM, Gee AH, et al. (2014). Denosumab Rapidly Increases Cortical Bone in Key Locations of the Femur: A 3D Bone Mapping Study in Women With Osteoporosis. Journal of Bone and Mineral Research, 30(1), 46–54.
- Sato M, Westmore M, Ma YL, et al. (2004). Teriparatide [PTH(1–34)] Strengthens the Proximal Femur of Ovariectomized Nonhuman Primates Despite Increasing Porosity. Journal of Bone and Mineral Research, 19(4), 623–629.
- Hadji P, Kamali L, Thomasius F, et al. (2024). Real-world efficacy of a teriparatide biosimilar (RGB-10) compared with reference teriparatide on bone mineral density, trabecular bone score, and bone parameters assessed using quantitative ultrasound, 3D-SHAPER® and high-resolution peripheral computer tomography in postmenopausal women with osteoporosis and very high fracture risk. Osteoporosis International, 35(12), 2107–2116.
- Sone T, Ohnaru K, Sugai T, et al. (2023). The effects of abaloparatide on hip geometry and biomechanical properties in Japanese osteoporotic patients assessed using DXA-based hip structural analysis: results of the Japanese phase 3 ACTIVE-J trial. Archives of Osteoporosis, 18(1).
- Genant HK, Engelke K, Bolognese MA, et al. (2016). Effects of Romosozumab Compared With Teriparatide on Bone Density and Mass at the Spine and Hip in Postmenopausal Women With Low Bone Mass. Journal of Bone and Mineral Research, 32(1), 181–187.
- MEDICAL 3S (2021). Webinar - Use of 3D-Shaper in clinical research: state of the art and potential applications
- Casado Burgos E, Di Gregorio S, González Macías J, et al. (2019). Datos de referencia de mediciones óseas en modelos 3D de fémur proximal en población española cn DXA: Proyecto SEIOMM 3D-SHAPPER. Congreso SEIOMM (24º : 2019 : Gerona).
- Brance ML, Saravi FD, Henr{\'i}quez MM, et al. (2020). Reference Values of Three-Dimensional Proximal Femur Parameters from Bone Densitometry Images in Healthy Subjects from Argentina. World Congress on Osteoporosis, Osteoarthritis and Musculoskeletal Diseases, 372--372.
- Jennings I (). 3D Shaper Technology: Revolutionizing Bone Health Analysis
- Al-Hashimi L, Klotsche J, Ohrndorf S, et al. (2023). Trabecular Bone Score Significantly Influences Treatment Decisions in Secondary Osteoporosis. Journal of Clinical Medicine, 12(12), 4147.
- Food {, Administration} D (2022). 510(k) Summary: K220822
- Broy SB, Cauley JA, Lewiecki ME, et al. (2015). Fracture Risk Prediction by Non-BMD DXA Measures: the 2015 ISCD Official Positions Part 1: Hip Geometry. Journal of Clinical Densitometry, 18(3), 287–308.
- Whitmarsh T, Humbert L, Craene MD, et al. (2009). Reconstrucción de la forma del fémur y densidad mineral ósea en 3D para el diagnóstico de osteoporosis a partir de DXA
- Whitmarsh T, Humbert L, Del Río Barquero LM, et al. (2011). Volumetric Bone Mineral Density Estimation using a 3D Reconstruction Method from Dual-energy X-ray Absorptiometry. ASBMR 2011 Annual Meeting Abstracts and Abstract Book.
- Whitmarsh T, Fritscher KD, Humbert L, et al. (2011). A Statistical Model of Shape and Bone Mineral Density Distribution of the Proximal Femur for Fracture Risk Assessment. Medical Image Computing and Computer-Assisted Intervention – MICCAI 2011, 393–400.
- Whitmarsh T, Fritscher KD, Humbert L, et al. (2012). Hip fracture discrimination from dual-energy X-ray absorptiometry by statistical model registration. Bone, 51(5), 896–901.
- Martelli Y, Whitmarsh T, Humbert L, et al. (2012). A software framework for 3D reconstruction and fracture risk assessment of the proximal femur from dual-energy x-ray absorptiometry. Proceedings of VPH 2012: Virtual Physiological Human - Integrative approaches to computational biomedicine.
- Slart RHJA, Punda M, Ali DS, et al. (2024). Updated practice guideline for dual-energy X-ray absorptiometry (DXA). European Journal of Nuclear Medicine and Molecular Imaging, 52(2), 539–563.